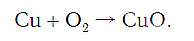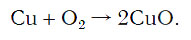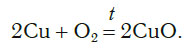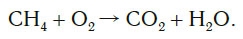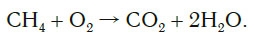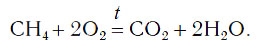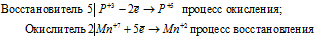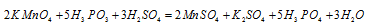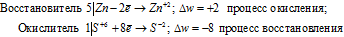Урок 12. Составление уравнений химических реакций
В уроке 12 «Составление уравнений химических реакций» из курса «Химия для чайников» мы научимся составлять уравнения химических реакций и правильно расставлять в них коэффициенты.
Составлять химические уравнения и производить расчеты по ним нужно, опираясь на закон сохранения массы веществ при химических реакциях. Рассмотрим, как можно составить химическое уравнение, на примере реакции меди с кислородом.
Слева запишем названия исходных веществ, справа — продуктов реакции. Если веществ два и более, соединяем их знаком «+». Между левой и правой частями пока поставим стрелку:
медь + кислород → соединение меди с кислородом.
Подобное выражение называют схемой химической реакции. Запишем эту схему при помощи химических формул:
Число атомов кислорода в левой части схемы равно двум, а в правой — одному. Так как при химических реакциях атомы не исчезают, а происходит только их перегруппировка, то число атомов каждого элемента до реакции и после реакции должно быть одинаковым. Чтобы уравнять число атомов кислорода в левой и правой частях схемы, перед формулой CuO ставим коэффициент 2:
Теперь число атомов меди после реакции (в правой части схемы) равно двум, а до реакции (в левой части схемы) — только одному, поэтому перед формулой меди Cu так же поставим коэффициент 2. В результате произведенных действий число атомов каждого вида в левой и правой частях схемы одинаково, что дает нам основание заменить стрелку на знак «=» (равно). Схема превратилась в уравнение химической реакции:
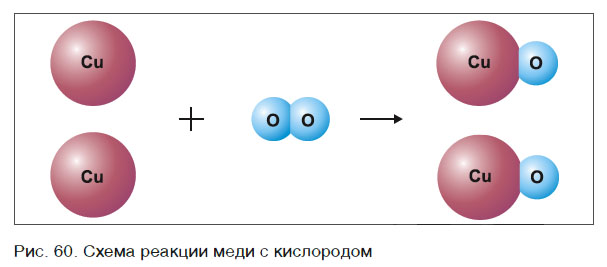
Это уравнение читается так: два купрум плюс о-два равно два купрум-о (рис. 60).
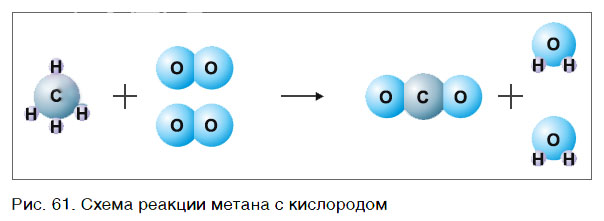
Рассмотрим еще один пример химической реакции между веществами СН4 (метан) и кислородом. Составим схему реакции, в которой слева запишем формулы метана и кислорода, а справа — формулы продуктов реакции — воды и соединения углерода с кислородом (углекислый газ):
Обратите внимание, что в левой части схемы число атомов углерода равно их числу в правой части. Поэтому уравнивать нужно числа атомов водорода и кислорода. Чтобы уравнять число атомов водорода, поставим перед формулой воды коэффициент 2:
Теперь число атомов водорода справа стало 2×2=4 и слева — также четыре. Далее посчитаем число атомов кислорода в правой части схемы: два атома кислорода в молекуле углекислого газа (1×2=2) и два атома кислорода в двух молекулах воды (2×1=2), суммарно 2+2=4. В левой части схемы кислорода только два атома в молекуле кислорода. Для того чтобы уравнять число атомов кислорода, поставим коэффициент 2 перед формулой кислорода:
В результате проведенных действий число атомов всех химических элементов до реакции равно их числу после реакции. Уравнение составлено. Читается оно так: це-аш-четыре плюс два о-два равно це-о-два плюс два аш-два-о (рис. 61).
Данный способ расстановки коэффициентов называют методом подбора.
В химии существуют и другие методы уравнивания чисел атомов элементов в левой и правой частях уравнений реакций, с которыми мы познакомимся позднее.
Краткие выводы урока:
Для составления уравнений химических реакций необходимо соблюдать следующий порядок действий.
- Установить состав исходных веществ и продуктов реакции.
- Записать формулы исходных веществ слева, продуктов реакции — справа.
- Между левой и правой частями уравнения сначала поставить стрелку.
- Расставить коэффициенты, т. е. уравнять числа атомов каждого химического элемента до и после реакции.
- Связать левую и правую части уравнения знаком «=» (равно).
Надеюсь урок 12 «Составление уравнений химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Как определять степень окисления
Степень окисления — это число электронов, перешедших от одного атома — к другому. Знак «минус», стоящий перед степенью окисления, говорит о том, что атом электроны потерял; знак «плюс» — получил.
Степень окисления равна нулю:
- у свободных атомов;
- у атомов, входящих в состав неполярных молекул (например, H2, O2, N2, Cl2. );
- в сумме значений степеней окисления всех элементов, входящих в соединение.
Последний пункт дает возможность определять неизвестную степень окисления элемента, если известны степени окисления других элементов в этом соединении:
Для определения степени окисления азота составляем и решаем уравнение:
Во многих случаях степень окисления численно равна валентности.
Как составлять уравнения окислительно-восстановительных реакций
Напомним, что окислительно-восстановительными реакциями называются химические реакции, протекающие с изменением степеней окисления элементов (всех или некоторых).
Главный момент любой окислительно-восстановительной реакции, о котором всегда следует помнить — кол-во электронов, которые отдал элемент-восстановитель, всегда равно кол-ву электронов, принятых элементом-окислителем.
Уравнения окислительно-восстановительных реакций составляются при помощи метода электронного баланса, либо метода полуреакций.
Метод электронного баланса
Алгоритм составления уравнения окислительно-восстановительной реакции:
- Дана следующая схема реакции:
- В левой и правой частях уравнения рядом с элементами в формулах веществ проставляем степени их окисления:
- Внимательно смотрим, и определяем элементы с разной степенью окисления в левой и правой частях, в нашем случае — это марганец и хлор:
- Рядом запишем получившиеся атомы с «новой» степенью окисления:
- Записыаем кол-во перешедших электронов:
- Справа проводится вертикальная черта за которой записываются коэффициенты, стоящие перед электронами, при этом, верхний коэффициент записывается вниз, а нижний — вверх:
- проверяем, чтобы общая сумма электронов атома (иона элемента-окислителя) была равна общему числу электронов атома (иона элемента-восстановителя);
- Переносим коэффициенты электронных уравнений в уравнение реакции в молекулярной форме, которые следует проставить в уравнении перед соответствующими формулами, и проверяем равенстов кол-ва атомов элементов в левой и правой части уравнения:
Приведем еще один пример составления уравнения окислительно-восстановительной реакции методом электронного баланса.
- Дана следующая схема реакции:
- Записываем степени окисления всех элементов в обеих частях схемы, после чего определяем элементы, изменяющие свои степени окисления в ходе реакции:
- Пишем уравнения окисления и восстановления, поскольку продуктом окисления является двухатомная молекула брома, то и в левой части берем также два атома брома:
- Записываем множители для уравнения:
- Основное правило метода электронного баланса выполняется: 2 атома марганца принимают 10 электронов (2·5), а 10 атомов брома отдают 10 электронов (каждый атом — по одному электрону);
- Найденные множители записываются в качестве коэффициентов перед формулами веществ, содержащих элементы, участвующие в процессе окисления-восстановления:
- Осталось уравнять кол-во атомов элементов, не изменяющих степени окисления (калий, сера, водород, кислород):
- В последнюю очередь уравниваются кол-ва атомов кислорода и водорода.
Рассмотрим пример окислительно-восстановительной реакции, в которой меняют свои степени окисления сразу три элемента.
- Схема реакции:
- Определяем элементы, меняющие свои степени окисления:
- В процессе реакции окисляются фосфор и сера, а восстанавливается азот, при этом кол-во электронов, участвующих в процессах окисления, равно 22, а в процессе восстановления участвует только 1 электрон:
- Записываем найденные множители в схему реакции, как коэффициенты перед формулами соответствующих веществ:
- На последней стадии проводим уравнение кол-ва атомов кислорода и водорода:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Методы составления уравнений окислительно-восстановительных реакций (овр)
Окислительно-восстановительными (ОВР) называются реакции, сопровождающиеся изменением степени окисления атомов, входящих в состав реагирующих веществ. Под степенью окисления (О) понимают стехиометрическую валентность со знаком (+) или (-). Знак (+) приписывают более электроположительному элементу (металлу), а (–) более электроотрицательному (неметаллу). Окисление-восстановление — это единый, взаимосвязанный процесс.
Окисление соответствует увеличению степени окисления элемента, а восстановление — ее уменьшению.
Степень окисления простых ионов совпадает с их зарядом: Fe 3+ , K + , Cl — и т. д. Степень окисления сложного нона совпадает с его зарядом (NH4 + ), (SO4 2— ), (PO4 3— ) и. т. д.
Степень окисления атома внутри сложного иона или молекулы прямо не связана с зарядом на этом атоме. Например, заряд атома Сr в молекулах CrCl2, CrCl3, K2CrO4 равен 1,9; 1,3 и 0,2 заряда электрона (со знаком ‘+‘), а степени окисления — +2, +3 и +6 соответственно. Нахождение степени окисления основывается на следующем правиле: сумма степеней окисления атомов в молекуле равна нулю, а в сложном ионе равна заряду этого иона. Атом, находящийся в высшей степени окисления, может быть только окислителем, если он находится в низшей степени окисления — только восстановителем, а если он обладает промежуточной степенью окисления, то может быть и окислителем и восстановителем. Например: N +5 (HNO3), S +6 (H2SO4) — проявляют только окислительные свойства (высшая степень окисления); N +4 (NO2), S +4 (SO2) — проявляют окислительные и восстановительные свойства (промежуточные степени окисления); N -3 (NH3), S -2 (H2S) — проявляют только восстановительные свойства (низшие степени окисления).
Для реакций окисления-восстановления применяют два метода составления уравнений: метод баланса степеней окисления и метод полуреакций.
Метод баланса степеней окисления
При этом методе для нахождения коэффициентов учитывают правило, согласно которому общее изменение степеней окисления в реакции равно нулю, то есть повышение степени окисления восстановителя равно ее понижению у окислителя.
Пример 1. Составьте уравнение окислительно-восстановительной реакции, идущей по схеме: 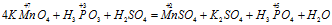
Решение.
Вычисляем, как изменяют свою степень окисления восстановитель и окислитель, и отражаем это в уравнениях:
Уравнения электронного баланса:
Изменение степеней окисления ( 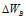
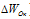
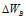
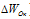
В данной реакции окислителем является KMnO 4 , в котором атом марганца уменьшает свою степень окисленности от +7 до +2, а восстановителем является Н 3 PO 3 , в котором фосфор увеличивает свою степень окисленности от +3 до +5. Таким образом, атомы, изменяющие свои степени окисленности, находятся в молекулах разных веществ, значит, данная реакция относится к реакциям межмолекулярного окисления-восстановления.
Пример 2. Составьте уравнение реакции взаимодействия цинка с концентрированной серной кислотой, принимая максимальное восстановление последней.
Решение.
Цинк (как любой металл) проявляет только восстановительные свойства. В концентрированной серной кислоте окислительную функцию несет сера (+6). Максимальное восстановление серы означает, что она приобретает минимальную степень окисления. Минимальная степень окисления серы как р- элемента VI А группы равна -2. Цинк как металл II В группы имеет постоянную степень окисления +2. Отражаем сказанное в уравнениях:
Уравнения электронного баланса:
Составляем уравнение реакции :
Перед H2SO4 стоит коэффициент 5, а не 1, так как четыре молекулы кислоты идут на связывание четырех ионов Zn 2+ (то есть H2SO4 — и окислитель, и среда реакции).
При повышении степени окисления протекает процесс окисления, а само вещество является восстановителем. При понижении степени окисления протекает процесс восстановления, а само вещество является окислителем. Далее по балансу атомов водорода определяют число молей воды, Для проверки правильности подобранных коэффициентов подсчитывают баланс кислорода.
В данной реакции окислителем является H2SO4 , в котором атом серы уменьшает свою степень окисленности от +6 до -2, а восстановителем является Zn, в котором он увеличивает свою степень окисленности от 0 до +2. Таким образом, атомы, изменяющие свои степени окисленности, находятся в молекулах разных веществ, значит, данная реакция относится к реакциям межмолекулярного окисления-восстановления.
Метод полуреакций
В тех случаях, когда реакция протекает в водном растворе (расплаве), при составлении уравнений исходят не из изменения степени окисления атомов, входящих в состав реагирующих веществ, а учитывают форму существования веществ в растворе (простой или сложный ион, атом или молекула нерастворенного или слабодиссоциирующего в воде вещества). В этом случае при составлении ионных уравнений окислительно- восстановительных реакций следует придерживаться той же формы записи, которая принята для ионных уравнений обменного характера, а именно: малорастворимые, малодиссоциированные и газообразные соединения следует писать в молекулярной форме, а ноны, не изменяющие своего состояния, — исключать из уравнения.
Метод полуреакций точнее отражает истинные изменения веществ в процессе окислительно-восстановительных реакций и облегчает составление уравнений этих процессов в ионно-молекулярной форме. Поскольку из одних и тех же реагентов могут быть получены разные продукты в зависимости от характера среды (кислотного, щелочного, нейтрального) для таких реакций в ионной схеме кроме частиц, выполняющих функции окислителя и восстановителя, обязательно указывается частица, характеризующая реакцию среды (то есть ионы Н + или ион ОН — , или молекула Н20).
Пример 3. Используя метод полуреакций, расставьте коэффициенты в реакции:
КMnO4 + КNO2 + Н2SO4 → МnSO4 + KNO2 + K2SO4 + Н2O.
Решение.
Записываем реакцию в ионном виде:
K + и SO4 2— остаются без изменения, поэтому в ионной схеме их не указывают). Из ионной схемы видно, что перманганат-ион MnO4 — превращается в Мn 2+ и при этом освобождаются четыре частицы кислорода.
В кислой среде каждая освобождающаяся частица кислорода связывается с 2H + с образованием молекулы воды.
Отсюда следует: MnO4 — + 8Н + → Mn 2+ + 4Н20.
Находим разницу зарядов 
Для второго процесса, превращения NO2 — в NO3 — , недостающий кислород берется из воды, и в результате образуется избыток ионов H + :
NO2 — + Н20; 
Таким образом, получаем:
Уравнения ионно-молекулярного баланса:
Восстановитель 2 


Окислитель 5 


Умножая члены первого уравнения на 2. а второго — на 5 и складывая их, получим ионно-молекулярное уравнение данной реакции:
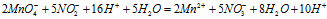
Сократив одинаковые частицы в левой и правой части уравнения, получаем окончательно ионно-молекулярное уравнение:
По ионному уравнению составляем молекулярное уравнение:
В щелочной и нейтральных средах можно руководствоваться следующими правилами.
В щелочной среде каждая освобождающаяся частица кислорода соединяется с одной молекулой воды, образуя два гидроксид-иона (2ОН — ), а каждая недостающая — берется из 2ОН — — ионов с образованием одной молекулы воды.
В нейтральной среде каждая освобождающаяся частица кислорода соединяется с одной молекулой Н20, образуя 2ОН — — нона, а каждая недостающая берется из воды с освобождением двух ионов водорода (2Н + ).
Если в окислительно-восстановительной реакции участвует перекись водорода (Н2О2), надо учитывать роль Н2О2 в конкретной реакции. В Н2О2 кислород находится в промежуточной степени окисления (-1), поэтому перекись водорода в окислительно-восстановительных реакциях проявляет окислительно-восстановительную двойственность. В тех случаях, когда Н2О2 является окислителем, полуреакции имеют следующий вид:
Н2О2 + 2H + —2 

Н2О2 —2 

Если перекись водорода является восстановителем:
Н2О2 + 2 

Н2О2 + 2ОН — + 2 

Типы окислительно-восстановительных реакций
Различают три типа окислительно-восстановительных реакций:
1. Межмолекулярные окислительно-восстановительные реакции, при которых изменяются степени окисления атомов элементов, входящих в состав разных веществ. Реакции, рассмотренные в примерах 1-3, относится к этому типу. Например:
Пример 4. Составьте уравнение окислительно-восстановительной реакции, идущей по схеме: 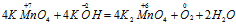
Решение.
Составляем уравнения ионно-молекулярного баланса, получим:
Восстановитель 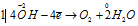
Окислитель 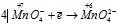
В данной реакции окислителем является KMnO4, в котором атом марганца уменьшает свою степень окисленности от +7 до +6, а восстановителем является КОН, в котором кислород увеличивает свою степень окисленности от -2 до 0. Таким образом, атомы, изменяющие свои степени окисленности, находятся в молекулах разных веществ, значит, данная реакция относится к реакциям межмолекулярного окисления-восстановления.
2. Реакции самоокисления-самовосстановления (диспропорционирования, дисмутации).
В этом случае степень окисления одного и того же элемента и повышается, и понижается. Реакции диспропорционировация характерны для соединений или элементов веществ, соответствующих одной из промежуточных степеней окисления элемента. Например:
Пример 5. Составьте уравнение окислительно-восстановительной реакции, идущей по схеме:
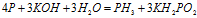
Решение.
Уравнения электронного баланса:
Восстановитель 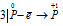
Окислитель 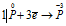
Данная реакция относится к реакции диспропорционирования, потому что сопровождается одновременным увеличением и уменьшением степени окисленности атомов одного и того же элемента (фосфора), находящегося в одном веществе (Р).
Пример 6. Составьте уравнение окислительно-восстановительной реакции, идущей по схеме: 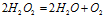
Решение.
Уравнения электронного баланса:
Восстановитель 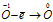
Окислитель 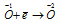
Данная реакция относится к реакции диспропорционирования, потому что сопровождается одновременным увеличением и уменьшением степени окисленности атомов одного и того же элемента (кислорода), находящегося в одном веществе (пероксид водорода Н2О2).
3. Реакции внутримолекулярного окисления-восстановления, при котором происходит выравнивание степеней окисленности атомов элемента, находящихся в одном и том же веществе, называется внутримолекулярным окислением-восстановлением (реакция конпропорционирования). Например:
Пример 7. Составьте уравнение окислительно-восстановительной реакции, идущей по схеме:
NH4NO2 = N2 + H2O
Решение.
N -3 H4N +3 O2 = N2 0 + H2O
Уравнения ионно-молекулярного баланса:
Восстановитель 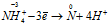
Окислитель 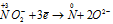
Ионно-молекулярная форма процесса:
молекулярная форма процесса:
В данной реакции атомы азота, находящиеся в нитрите аммония NH4NO2, изменяют свои степени окисленности один с -3 до 0, другой с +3 до 0. Процесс, в результате которого происходит выравнивание степеней окисленности атомов элемента, находящихся в одном и том же веществе, называется внутримолекулярным окислением-восстановлением (реакция конпропорционирования).
http://prosto-o-slognom.ru/chimia/22_2_uravneniya_ovr.html
http://buzani.ru/raznoe/metodika/677-okislitelno-vosstanovitelnye-reaktsii