Составление уравнений электродных процессов и суммарной реакции, происходящей при работе гальванического элемента
Задача 652.
Гальванический элемент состоит из серебряного электрода, погруженного в 1 М раствор AgNO3, и стандартного водородного электрода. Написать уравнения электродных процессов и суммарной реакции, происходящей при работе элемента. Чему равна его э.д.с.?
Решение: 


H20 — 2 
Серебро, потенциал которой +0,80 В, — катод, т.е. электрод, на котором протекает восстановительный процесс:
Ag + + 2 
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов, получим
H20 + 2Ag + = 2H + + 2Ag 0
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т.е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:


Ответ: +0,80В.
Задача 653.
Э. д. с. гальванического элемента, состоящего из стандартного водородного электрода и свинцового электрода, погруженного в 1 М раствор соли свинца, равна 126 мВ. При замыкании элемента электроны во внешней цепи перемещаются от свинцового к водородному электроду. Чему равен потенциал свинцового электрода? Составить схему элемента. Какие процессы протекают на его электродах?
Решение: 
Pb 0 — 2 
А на водородном – восстановительный:
2H + + 2 
Таким образом, свинцовый электрод будет анодом, а водородный – катодом.
Уравнение окислительно-восстановительного процесса, протекающего при работе данного гальванического элемента, можно получить, сложив электронные процессы на электродах:
Pb 0 + 2H + = Pb 2+ + H2 0
Для расчета электродного потенциала свинца, можно использовать уравнение определения ЭДС гальванического элемента:
E = 

Подставив в уравнение данные задачи, получим:
Е = 



Ответ: -0,126В.
Задача 654.
Рассчитать электродные потенциалы магния в растворе его соли при концентрациях иона Mg 2+ 0,1, 0,01 и 0,001 молы/л.
Решение:
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация (при точных измерениях активность) гидратированных ионов металла в растворе. Е 0 для магния равен -2,34 В.
Определим электродные потенциалы магния в растворах при разных значениях концентрации его ионов:
а) Mg 2+ = 0,1 молы/л.
б) Mg 2+ = 0,01 молы/л.
в) Mg 2+ = 0,001 молы/л.
Ответ: а) 2,37 В; б) 2,40 В; в) 2,43 В.
1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот).
Что такое электролиз? Для более простого понимания ответа на этот вопрос давайте представим себе любой источник постоянного тока. У каждого источника постоянного тока всегда можно найти положительный и отрицательный полюс:
Подсоединим к нему две химически стойких электропроводящих пластины, которые назовем электродами. Пластину, присоединенную к положительному полюсу назовем анодом, а к отрицательному катодом:
Далее, представьте, что у вас есть возможность опустить эти два электрода в расплав хлорида натрия:
Хлорид натрия является электролитом, при его расплавлении происходит диссоциация на катионы натрия и хлорид-ионы:
Очевидно, что заряженные отрицательно анионы хлора направятся к положительно заряженному электроду – аноду, а положительно заряженные катионы Na + направятся к отрицательно заряженному электроду – катоду. В результате этого и катионы Na + и анионы Cl − разрядятся, то есть станут нейтральными атомами. Разрядка происходит посредством приобретения электронов в случае ионов Na + и потери электронов в случае ионов Cl − . То есть на катоде протекает процесс:
Поскольку каждый атом хлора имеет по неспаренному электрону, одиночное существование их невыгодно и атомы хлора объединяются в молекулу из двух атомов хлора:
Таким образом, суммарно, процесс, протекающий на аноде, правильнее записать так:
То есть мы имеем:
Катод: Na + + 1e − = Na 0
Анод: 2Cl − − 2e − = Cl2
Подведем электронный баланс:
Na + + 1e − = Na 0 |∙2
2Cl − − 2e − = Cl2 |∙1 + + 2e − + 2Cl − − 2e − = 2Na 0 + Cl2
Сократим два электрона аналогично тому, как это делается в алгебре получим ионное уравнение электролиза:
2Na + + 2Cl − = 2Na 0 + Cl2
далее, объединив ионы Na + и Cl − получим, уравнение электролиза расплава хлорида натрия:
Рассмотренный выше случай является с теоретической точки зрения наиболее простым, поскольку в расплаве хлорида натрия из положительно заряженных ионов были только ионы натрия, а из отрицательных – только анионы хлора.
Другими словами, ни у катионов Na + , ни у анионов Cl − не было «конкурентов» за катод и анод.
А, что будет, например, если вместо расплава хлорида натрия ток пропустить через его водный раствор? Диссоциация хлорида натрия наблюдается и в этом случае, но становится невозможным образование металлического натрия в водном растворе. Ведь мы знаем, что натрий – представитель щелочных металлов – крайне активный металл, реагирующий с водой очень бурно. Если натрий не способен восстановиться в таких условиях, что же тогда будет восстанавливаться на катоде?
Давайте вспомним строение молекулы воды. Она представляет собой диполь, то есть у нее есть отрицательный и положительный полюсы:
Именно благодаря этому свойству, она способна «облеплять» как поверхность катода, так и поверхность анода:
При этом могут происходить процессы:
Таким образом, получается, что если мы рассмотрим раствор любого электролита, то мы увидим, что катионы и анионы, образующиеся при диссоциации электролита, конкурируют с молекулами воды за восстановление на катоде и окисление на аноде.
Так какие же процессы будут происходить на катоде и на аноде? Разрядка ионов, образовавшихся при диссоциации электролита или окисление/восстановление молекул воды? Или, возможно, будут происходить все указанные процессы одновременно?
В зависимости от типа электролита при электролизе его водного раствора возможны самые разные ситуации. Например, катионы щелочных, щелочноземельных металлов, алюминия и магния просто не способны восстановиться в водной среде, так как при их восстановлении должны были бы получаться соответственно щелочные, щелочноземельные металлы, алюминий или магний т.е. металлы, реагирующие с водой.
В таком случае является возможным только восстановление молекул воды на катоде.
Запомнить то, какой процесс будет протекать на катоде при электролизе раствора какого-либо электролита можно, следуя следующим принципам:
1) Если электролит состоит из катиона металла, который в свободном состоянии в обычных условиях реагирует с водой, на катоде идет процесс:
Это касается металлов, находящихся в начале ряда активности по Al включительно.
2) Если электролит состоит из катиона металла, который в свободном виде не реагирует с водой, но реагирует с кислотами неокислителями, идут сразу два процесса, как восстановления катионов металла, так и молекул воды:
К таким металлам относятся металлы, находящиеся между Al и Н в ряду активности.
3) Если электролит состоит из катионов водорода (кислота) или катионов металлов, не реагирующих с кислотами неокислителями — восстанавливаются только катионы электролита:
2Н + + 2е − = Н2 – в случае кислоты
Me n + + ne = Me 0 – в случае соли
На аноде тем временем ситуация следующая:
1) Если электролит содержит анионы бескислородных кислотных остатков (кроме F − ), то на аноде идет процесс их окисления, молекулы воды не окисляются. Например:
Фторид-ионы не окисляются на аноде поскольку фтор не способен образоваться в водном растворе (реагирует с водой)
2) Если в состав электролита входят гидроксид-ионы (щелочи) они окисляются вместо молекул воды:
3) В случае того, если электролит содержит кислородсодержащий кислотный остаток (кроме остатков органических кислот) или фторид-ион (F − ) на аноде идет процесс окисления молекул воды:
4) В случае кислотного остатка карбоновой кислоты на аноде идет процесс:
2RCOO − − 2e − = R-R + 2CO2
Давайте потренируемся записывать уравнения электролиза для различных ситуаций:
Пример №1
Напишите уравнения процессов протекающих на катоде и аноде при электролизе расплава хлорида цинка, а также общее уравнение электролиза.
При расплавлении хлорида цинка происходит его диссоциация:
Далее следует обратить внимание на то, что электролизу подвергается именно расплав хлорида цинка, а не водный раствор. Другими словами, без вариантов, на катоде может происходить только восстановление катионов цинка, а на аноде окисление хлорид-ионов т.к. отсутствуют молекулы воды:
Катод: Zn 2+ + 2e − = Zn 0 |∙1
Анод: 2Cl − − 2e − = Cl2 |∙1
Пример №2
Напишите уравнения процессов протекающих на катоде и аноде при электролизе водного раствора хлорида цинка, а также общее уравнение электролиза.
Так как в данном случае, электролизу подвергается водный раствор, то в электролизе, теоретически, могут принимать участие молекулы воды. Так как цинк расположен в ряду активности между Al и Н то это значит, что на катоде будет происходить как восстановление катионов цинка, так и молекул воды.
Zn 2+ + 2e − = Zn 0
Хлорид-ион является кислотным остатком бескислородной кислоты HCl, поэтому в конкуренции за окисление на аноде хлорид-ионы «выигрывают» у молекул воды:
В данном конкретном случае нельзя записать суммарное уравнение электролиза, поскольку неизвестно соотношение между выделяющимися на катоде водородом и цинком.
Пример №3
Напишите уравнения процессов протекающих на катоде и аноде при электролизе водного раствора нитрата меди, а также общее уравнение электролиза.
Нитрат меди в растворе находится в продиссоциированном состоянии:
Медь находится в ряду активности правее водорода, то есть на катоде восстанавливаться будут катионы меди:
Cu 2+ + 2e − = Cu 0
Нитрат-ион NO3 − — кислородсодержащий кислотный остаток, это значит, что в окислении на аноде нитрат ионы «проигрывают» в конкуренции молекулам воды:
Катод: Cu 2+ + 2e − = Cu 0 |∙2
2Cu 2+ + 2H2O = 2Cu 0 + O2 + 4H +
Полученное в результате сложения уравнение является ионным уравнением электролиза. Чтобы получить полное молекулярное уравнение электролиза нужно добавить по 4 нитрат иона в левую и правую часть полученного ионного уравнения в качестве противоионов. Тогда мы получим:
Пример №4
Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора ацетата калия, а также общее уравнение электролиза.
Решение:
Ацетат калия в водном растворе диссоциирует на катионы калия и ацетат-ионы:
Калий является щелочным металлом, т.е. находится в ряду электрохимическом ряду напряжений в самом начале. Это значит, что его катионы не способны разряжаться на катоде. Вместо них восстанавливаться будут молекулы воды:
Как уже было сказано выше, кислотные остатки карбоновых кислот «выигрывают» в конкуренции за окисление у молекул воды на аноде:
Таким образом, подведя электронный баланс и сложив два уравнения полуреакций на катоде и аноде получаем:
Катод: 2H2O + 2e − = 2OH − + H2 |∙1
Мы получили полное уравнение электролиза в ионном виде. Добавив по два иона калия в левую и правую часть уравнения и сложив с противоионами мы получаем полное уравнение электролиза в молекулярном виде:
Пример №5
Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора серной кислоты, а также общее уравнение электролиза.
Серная кислота диссоциирует на катионы водорода и сульфат-ионы:
На катоде будет происходить восстановление катионов водорода H + , а на аноде окисление молекул воды, поскольку сульфат-ионы являются кислородсодержащими кислотными остатками:
Катод: 2Н + + 2e − = H2 |∙2
Сократив ионы водорода в левой и правой и левой части уравнения получим уравнение электролиза водного раствора серной кислоты:
Как можно видеть, электролиз водного раствора серной кислоты сводится к электролизу воды.
Пример №6
Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора гидроксида натрия, а также общее уравнение электролиза.
Диссоциация гидроксида натрия:
На катоде будут восстанавливаться только молекулы воды, так как натрий – высокоактивный металл, на аноде только гидроксид-ионы:
Катод: 2H2O + 2e − = 2OH − + H2 |∙2
Сократим две молекулы воды слева и справа и 4 гидроксид-иона и приходим к тому, что, как и в случае серной кислоты электролиз водного раствора гидроксида натрия сводится к электролизу воды:
Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
По таблице 11.1 находим значение стандартных электродных потенциалов железа и цинка:


Так как 
 |
2Zn + 2H2O + O2 = 2Zn(OH)2 – суммарное молекулярное уравнение процесса коррозии.
б) Коррозия в кислой среде (H2SO4)
Составляем схему коррозионного ГЭ:
А (-) Zn │ H + │ Fe (+) K
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:


На К(+) 2H + + 2ē = H2 1
 |
Zn + 2H + = Zn 2+ + H2 — суммарное ионно-молекулярное уравнение процесса коррозии;
Zn + H2SO4 = ZnSO4 + H2 – суммарное молекулярное уравнение процесса коррозии.
в) Коррозия в кислой среде в присутствии кислорода (HCl+O2).
Составляем схему коррозионного ГЭ:
А (-) Zn │ HCl + O2 │ Fe (+) K
А (-) Zn │ H + + O2 │ Fe (+) K
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:


На A (-) Zn – 2ē = Zn 2+ 2

2Zn + 4H + + O2 = 2Zn 2+ + 2H2O – суммарное ионно-молекулярное уравнение процесса коррозии
2Zn + 4HCl + O2 = 2ZnCl2 + 2H2O – суммарное молекулярное уравнение процесса коррозии.
Во всех случаях коррозионному разрушению будет подвергаться более активный металл – цинк.
УРОВЕНЬ В
1. Составить схему гальванического элемента (ГЭ), образованного цинковым электродом, погруженным в 1М раствор хлорида цинка, и хромовым электродом, погруженным в 1·10 -3 М раствор хлорида хрома (III). Рассчитать напряжение ГЭ, написать уравнения электродных процессов и суммарной токообразующей реакции.

| РЕШЕНИЕ: Для составления схемы ГЭ необхо-димо знать величины электродных потенциалов металлов – цинка и хрома. По таблице 11.1 определяем стан-дартные электродные потенциалы металлов: |
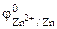
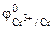
Хлорид цинка диссоциирует по уравнению:

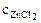

α = 1 (ZnCl2 – сильный электролит), 

Хлорид хрома (III) диссоциирует по уравнению:
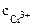
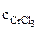
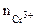
α = 1 (CrCl3 – сильный электролит), 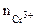
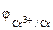
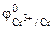
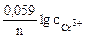

Так как 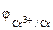
Составляем уравнения электродных процессов и суммарной токообразующей реакции:


На A(-)Cr – 3ē = Cr 3+ 2
На К(+)Zn 2+ + 2ē = Zn 3
2Cr + 3Zn 2+ = 2Cr 3+ + 3Zn — суммарное ионно-молекулярное уравнение токообразующей реакции
2Cr + 3ZnCl2 = 2CrCl3 + 3Zn — суммарное молекулярное уравнение токообразующей реакции.
Рассчитываем напряжение ГЭ:
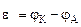


2. Составить схему ГЭ, в котором протекает химическая реакция Fe + Ni 2+ = Fe 2+ + Ni. Написать уравнения электродных процессов. На основании стандартных значений энергий Гиббса образования ионов ∆fG 0 (298К, Me n + ) рассчитать стандартное напряжение ГЭ и константу равновесия реакции при 298К.
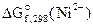

Дано: 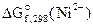 = -64,4 кДж/моль = -64,4 кДж/моль  = -84,94 кДж/моль Т = 298 К = -84,94 кДж/моль Т = 298 К  ε 0 — ? Кс — ? ε 0 — ? Кс — ? | РЕШЕНИЕ: На основании реакции, приведенной в условии задачи, составляем уравнения электродных процессов: |


На К(+)Ni 2+ + 2ē = Ni 1 — восстановление
Анодом ГЭ является электрод, на котором происходит процесс окисления. Катодом – электрод, на котором происходит процесс восстановления. Тогда в рассматриваемом ГЭ анодом будет являться железо, катодом – никель.
Составляем схему ГЭ:
А(-) Fe │ Fe 2+ ║ Ni 2+ │ Ni(+)K
Рассчитываем стандартное напряжение ГЭ:
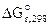
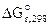

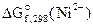
= -84,94-(-64,4) = -20,54 кДж,
ε 0 =
z = 2, F = 96500 Кл/моль.
Рассчитываем константу равновесия токообразующей реакции (Кc).
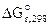
lgKс =
Ответ: ε 0 = 0,106В, Kс = 3981.
3. Составить схему коррозионного ГЭ, возникающего при контакте железной пластинки площадью 20 см 2 с никелевой в растворе соляной кислоты HCl. Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
а) Вычислить объемный и весовой показатели коррозии, если за 40 минут в процессе коррозии выделилось 0,5 см 3 газа (н.у.).
б) Вычислить весовой и глубинный показатели коррозии, если за 120 минут потеря массы железной пластинки составила 3,7∙10 -3 г. Плотность железа равна 7,9 г/см3 .
По таблице 11.1 находим значения стандартных электродных потенциалов железа и никеля:

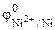
Так как 
Cоставляем уравнения электродных процессов и суммарной реакции процесса коррозии:
На A Fe – 2ē = Fe 2+

Fe + 2H + = Fe 2+ + H2 – суммарное ионно-молекулярное уравнение процесса коррозии.
Fe + 2HCl = FeCl2 + H2 – суммарное молекулярное уравнение процесса коррозии.

| Рассчитываем объемный показатель коррозии KV по формуле: KV =  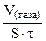 , см 3 /м 2 ∙час. При расчете KV принимаем: S – [м 2 ], τ — [час], V(газа) – [см 3 ]. , см 3 /м 2 ∙час. При расчете KV принимаем: S – [м 2 ], τ — [час], V(газа) – [см 3 ]. |
Из уравнения суммарной реакции процесса коррозии следует, что при коррозии выделяется водород.
Следовательно, V(газа) = 
Тогда, KV = 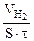
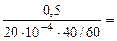
10 -4 – коэффициент пересчета, см 2 в м 2 .
Рассчитываем весовой показатель коррозии Km по формуле:
Km = 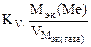
В процессе коррозии разрушению подвергается железо и выделяется водород.
Мэк(Ме) = Мэк(Fe) = 
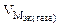

Km = 
Ответ: KV = 375 см 3 /м 2 ∙час, Km = 0,94 г/м 2 ∙час.

| Рассчитываем весовой показатель коррозии Km по формуле: Km =  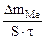 , г/м 2 ∙час. Коррозии подвергается железо. Тогда потеря массы металла , г/м 2 ∙час. Коррозии подвергается железо. Тогда потеря массы металла  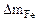 . . |
При расчете Km принимаем: 
Тогда: Km = 


Рассчитываем глубинный показатель коррозии по формуле:
П = 

Ответ: Km = 0,925 г/м 2 ∙час, П = 1,03 мм/год.
ЭЛЕКТРОЛИЗ РАСТВОРОВ
Таблица 11.1. Процессы протекающие на катоде при электролизе водных растворов
 В В | Катио-ны в вод- ном рас- творе | Зоны | Процессы на катоде |
| -3,02 -2,99 -2,93 -2,92 -2,90 -2,89 -2,87 -2,71 -2,34 -1,67 | Li + , Rb + , Cs + K + , Ba 2+ , Sr 2+ , Ca 2+ , Na + , Mg 2+ , Al 3+ | I | Катионы этих металлов на катоде не восстанавли-ваются, а концентри-руются в околокатодном пространстве (католите). На катоде восстанавливаются только молекулы воды: 2Н2О + 2ē = 2ОН — + Н2 |
| -1,05 -0,76 -0,74 -0,44 -0,40 -0,28 -0,26 -0,14 -0,13 | Mn 2+ , Zn 2+ , Cr 3+ , Fe 2+ , Cd 2+ , Co 2+ , Ni 2+ , Sn 2+ , Pb 2+ | II | 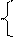 На катоде параллельно протекают два процесса: Ме n + + nē = Me 2Н2О + 2ē = 2ОН — + Н2 На катоде параллельно протекают два процесса: Ме n + + nē = Me 2Н2О + 2ē = 2ОН — + Н2 |
| 0,00 | Н + | При электролизе кислоты 2Н + + 2ē = Н2 | |
| +0,20 +0,23 +0,34 +0,80 +0,83 +0,85 +1,20 | Sb 3+ , Bi 3+ , Cu 2+ , Ag + , Pd 2+ , Hg 2+ , Pt 2+ | III | Восстанавливаются только ионы этих металлов Ме n + + nē = Me |
Таблица 11.2. Последовательность окисления анионов на инертном аноде в водном растворе.
| Очередность окисления анионов | Процессы окисления на аноде. |
| 1. | Окисляются анионы бескислородных кислот (Cl — , Br — , J — , S 2- , и др.) Например: 2Cl — -2ē = Cl2 |
| 2. | Окисляются ОН — ионы 4ОН — -4ē = О2 + 2Н2О |
Если в водном растворе присутствуют анионы кислородсодержащих кислот (  , ,  , , 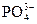 , и др.), то они на аноде не окисляются, а концентрируются в околоанодном пространстве (анолите). На аноде окиcляются только молекулы воды. 2H2O — 4е = О2+4H + , и др.), то они на аноде не окисляются, а концентрируются в околоанодном пространстве (анолите). На аноде окиcляются только молекулы воды. 2H2O — 4е = О2+4H + |
Примечание. Если анод изготовлен из металлов II или III зоны (растворимый анод), то при электролизе протекает только процесс его растворения Мe 0 – nē = Me n +
УРОВЕНЬ А
1. Составить схемы электролиза и написать уравнения электродных процессов водных растворов (анод инертный): а) хлорида меди (II), б) гидроксида натрия.
Какие продукты выделяются на катоде и аноде?
| РЕШЕНИЕ а) CuCl2 = Cu 2+ + 2Cl — , Схему электролиза составляем в соответствии с таблицами 11.1 и 11.2: K(-) A(+) инертный Cu 2+ + 2ē = Cu 2Cl — — 2ē = Cl2 H2O H2O |
На катоде выделяется Cu, на аноде выделяется Cl2.
б) NaОН = Na + + ОН —
Na + 4ОН 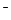
На катоде выделяется Н2, на аноде выделяется О2.
2.Составить схемы электролиза и написать уравнения электродных процессов водного раствора сульфата никеля (II) , если: а) анод инертный, б) анод никелевый. Какие продукты выделяются на катоде и аноде?

| РЕШЕНИЕ а) анод – инертный NiSO4 = Ni 2+ +  Схему электролиза составляем в соответствии с таблицами 11.1. и 11.2: Схему электролиза составляем в соответствии с таблицами 11.1. и 11.2: |
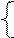
На катоде выделяется Ni и H2 , на аноде выделяется О2.
б) анод – никелевый:
NiSO4 = Ni 2+ +
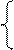

2H2O+2ē = H2+2OH — Ni — 2ē = Ni 2+
На катоде выделяется Ni и H2, на аноде растворяется Ni.
3.При электролизе растворов а) нитрата кальция, б) нитрата серебра на аноде выделяется 560 мл газа (н.у.). Составить схему электролиза и написать уравнения электродных процессов. Определить какое вещество и в каком количестве выделилось на катоде? Анод инертный.
|
 | РЕШЕНИЕ а) Ca(NO3)2 = Ca 2+ + 2  Схема электролиза: K(-) A(+) инертный Ca 2+ Схема электролиза: K(-) A(+) инертный Ca 2+  2H2O+2ē=H2+2OH — 2H2O — 4ē = О2+4H + На катоде выделяется Н2, на аноде выделяется О2 По закону эквивалентов: nэк (В1)(анод) = nэк (В2)(катод) 2H2O+2ē=H2+2OH — 2H2O — 4ē = О2+4H + На катоде выделяется Н2, на аноде выделяется О2 По закону эквивалентов: nэк (В1)(анод) = nэк (В2)(катод) |
В соответствии со схемой электролиза:
nэк (О2)(анод) = nэк (Н2)(катод) или 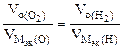


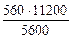
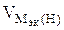
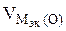
На катоде выделилось 1120 см 3 водорода.
Ответ: 1120 см 3 водорода.
б) AgNO3 = Ag + +
Ag + + ē = Ag
На катоде выделяется Ag, на аноде выделяется О2.
По закону эквивалентов: nэк(Ag)(катод) = nэк(О2)(анод) или 
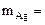


где
На катоде выделилось 10,8 г серебра.
Ответ: 10,8 г серебра.
УРОВЕНЬ В
Составить схему электролиза и написать уравнения электродных процессов водного раствора сульфата калия (анод инертный). Определить какие вещества и в каком количестве выделяются на катоде и аноде, если проводить электролиз в течение четырех часов при силе тока 2А. Температура 298К, давление 99 кПа.
Дано: Электролит: K2SO4 τ = 4 ч Т = 298 К I = 2 A Р = 99 кПа Анод инертный  1. Схема электролиза-? 2. 1. Схема электролиза-? 2.  (катод) — ? 3. (катод) — ? 3.  (анод) — ? (анод) — ? | РЕШЕНИЕ K2SO4 = 2K + + 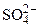 Схема электролиза: K(-) A(+) (инертный) K + Схема электролиза: K(-) A(+) (инертный) K +  2H2O + 2ē = 2H2O — 4ē = = H2 + 2OH — = О2 + 4H + На катоде выделяется H2, на аноде выделяется О2 По закону Фарадея объемы водорода и кислорода, выделившиеся при (н.у.): 2H2O + 2ē = 2H2O — 4ē = = H2 + 2OH — = О2 + 4H + На катоде выделяется H2, на аноде выделяется О2 По закону Фарадея объемы водорода и кислорода, выделившиеся при (н.у.): |


где 
F = 96500 Кл/моль, если τ – cек,
F = 26,8 А∙ч/моль, если τ – час.
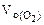

где 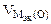

Объем водорода при заданных условиях отличных от нормальных определяем из уравнения:

откуда: 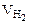

Объем кислорода при заданных условиях:

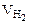
Ответ: 3,73 л водорода, 1,865 л кислорода.
2.Металлическую деталь, площадь поверхности которой равна 100 см 2 , необходимо покрыть слоем электролитически осажденной меди из раствора хлорида меди (II). Составить схему электролиза и написать уравнения электродных процессов, если анод медный. Сколько времени должно длиться осаждение при силе тока 8А и выходе по току 98%, если толщина покрытия 0,15 мм. Плотность меди – 8,9 г/см 3 .
  Дано: Электролит: CuCl2 S = 100 см 2 h = 0,15 мм I = 8 A BT = 98 % ρCu = 8,9 г/см 3 Дано: Электролит: CuCl2 S = 100 см 2 h = 0,15 мм I = 8 A BT = 98 % ρCu = 8,9 г/см 3  Анод медный Схема электролиза-? Анод медный Схема электролиза-?  Время электролиза, τ -? Время электролиза, τ -? |  РЕШЕНИЕ CuCl2 = Cu 2+ + 2Cl — Схема электролиза: K(-) A(+) (Cu) Cu 2+ + 2ē = Cu Cl — H2O H2O Cu – 2ē = Cu 2+ На катоде выделяется Cu, на аноде растворяется Cu. ВТ= РЕШЕНИЕ CuCl2 = Cu 2+ + 2Cl — Схема электролиза: K(-) A(+) (Cu) Cu 2+ + 2ē = Cu Cl — H2O H2O Cu – 2ē = Cu 2+ На катоде выделяется Cu, на аноде растворяется Cu. ВТ=  ; mCu(факт) = mCu(теор)·ВТ ; mCu(факт) = mCu(теор)·ВТ |
По закону Фарадея с учетом выхода по току (ВТ) масса меди, фактически выделившейся на катоде равна:
mCu(факт) = 
Масса меди, необходимая для получения медного покрытия:
mCu(факт) = S∙h∙ρ (г), где S – см 2 , h – см, ρ – г/см 3 .
S∙h∙ρCu = 
откуда
τ = 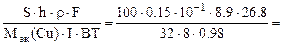
где Mэк(Cu) = 
10 -1 – коэффициент пересчета мм в см.
3.Определить молярную концентрацию эквивалента раствора нитрата серебра, если для выделения всего серебра из 75 см 3 этого раствора потребовалось пропустить ток силой 4А в течение 25 минут. Составить схему электролиза и написать уравнения электродных процессов. Анод инертный. Выход по току серебра 100%.
   Дано: Электролит: AgNO3 I = 4 A Дано: Электролит: AgNO3 I = 4 A  = 75 см 3 τ = 25 мин Анод инертный = 75 см 3 τ = 25 мин Анод инертный  Схема электролиза-? Схема электролиза-?  — ? — ? | РЕШЕНИЕ AgNO3 = Ag + +  Схема электролиза: K(-) A(+) инертный Ag + + ē= Ag Схема электролиза: K(-) A(+) инертный Ag + + ē= Ag  H2O 2H2O — 4ē = О2 + 4H + На катоде выделяется Ag, на аноде выделяется О2. H2O 2H2O — 4ē = О2 + 4H + На катоде выделяется Ag, на аноде выделяется О2. |
Молярная концентрация эквивалента раствора AgNO3:

nэк(Ag) = 
где mAg – масса серебра, выделившегося при электролизе с учетом 100 % выхода по току.
mAg = 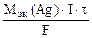

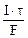
Молярная концентрация эквивалента раствора AgNO3:


где τ – c, F – 96500 Кл/моль, Vр-ра – л.
60 – коэффициент пересчета мин. в сек.
10 -3 – коэффициент пересчета см 3 в л.
Ответ: 
http://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/jelektroliz-rasplavov-i-rastvorov
http://lektsii.org/9-43917.html

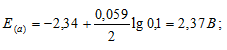
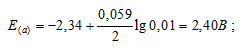
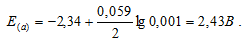

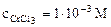 ε — ?
ε — ?


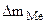 = 3,7·10 -3 г. S = 20 см 2 ρFe = 7,9 г/см 3 Km — ? П -?
= 3,7·10 -3 г. S = 20 см 2 ρFe = 7,9 г/см 3 Km — ? П -?
 = 560 см 3 Анод инертный 1. Схема электролиза-? 2.
= 560 см 3 Анод инертный 1. Схема электролиза-? 2.  -? 3.
-? 3.  -? 4.
-? 4.  -?
-?

