Качественные реакции
О чем эта статья:
Что такое качественная реакция
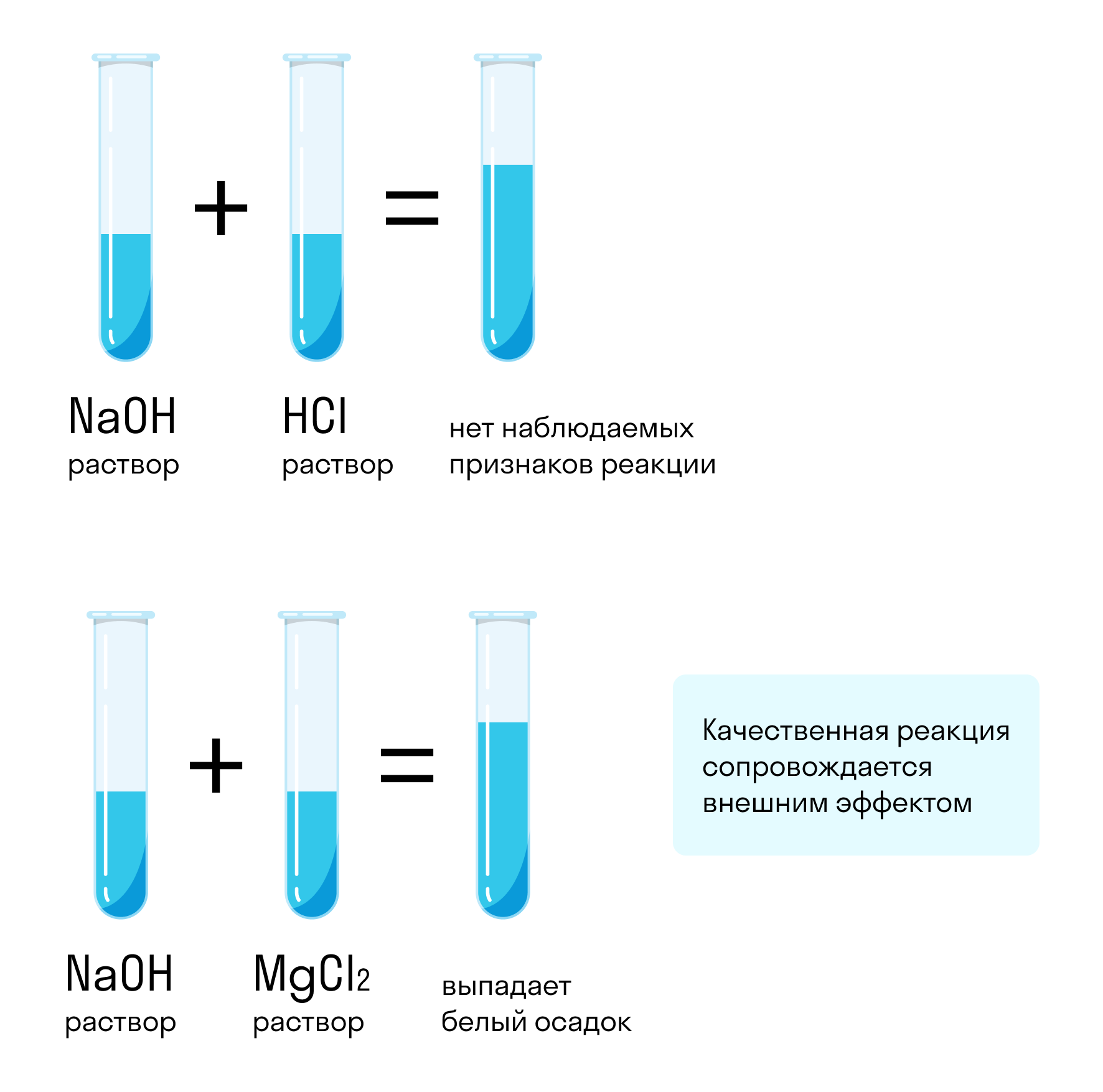
Предположим, у нас есть две пробирки — с водой и с гидроксидом натрия (каустической содой). Можно ли отличить один раствор от другого? Можно, если подобрать правильный реагент, с которым один раствор будет реагировать, а другой нет, или на который эти вещества будут реагировать по-разному.
Для таких целей подойдут не все реагенты. Например, если смешать гидроксид натрия с соляной кислотой, реакция произойдет: NaOH + HCl = NaCl + H2O. Но внешне она никак не проявится — два прозрачных раствора образуют такой же прозрачный третий. Такой реагент не подходит.
Если же смешать гидроксид натрия с хлоридом магния, результат химической реакции будет заметен невооруженным глазом. Характерным признаком станет образование белого осадка: 2NaOH + MgCl2 = Mg(OH)2 + 2NaCl. При смешивании хлорида магния с водой белый осадок не образуется. Значит, этот реагент позволяет отличить один раствор от другого.
Качественными называются реакции, позволяющие идентифицировать в исследуемом объекте определенные атомы, молекулы, функциональные группы и т. д. Идентификация происходит по внешним проявлениям, которые сопровождают реакцию: выделение газа, изменение цвета раствора, образование осадка, появление специфического запаха и др.
Качественные реакции — это простой и быстрый способ узнать качественный состав раствора или другого сложного вещества.
Качественный анализ
Определение состава того или иного вещества с помощью качественной реакции называют качественным анализом. В химии он часто используется перед количественным анализом, а также для того, чтобы понять, как можно разделить смесь.
Исследуемые объекты могут представлять собой твердые, жидкие или газообразные вещества, и в зависимости от этого качественный анализ проводится разными методами:
сухим способом — например, если внести пробу вещества в пламя горелки и отследить, как изменился цвет пламени;
мокрым способом — путем преобразования вещества в раствор.
Русский химик Ф. М. Флавицкий также предложил сухой метод растирания твердого исследуемого объекта с реактивом. Если реакция будет качественной, появятся характерные признаки: изменение цвета смеси, выделение газа и т. д.
Правила растворимости химических соединений
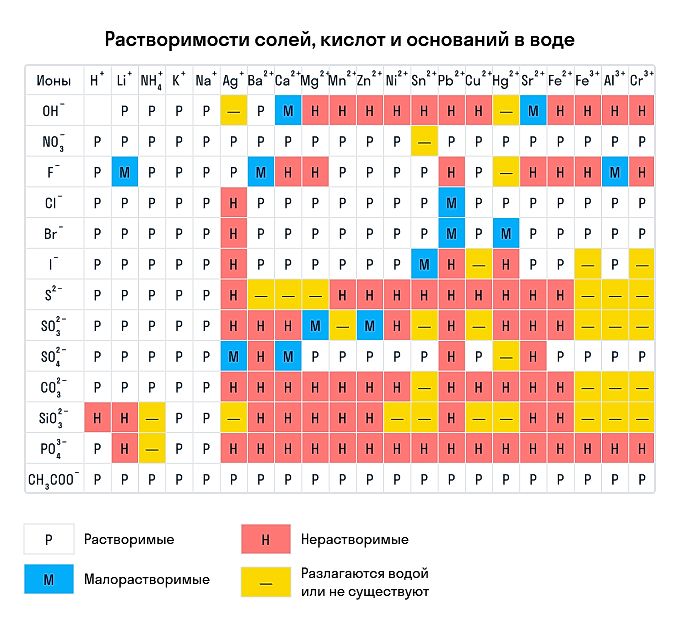
Сухим способом обычно проводят анализ в полевых условиях, а в лабораториях чаще использую растворы. Поэтому для изучения качественных реакций в химии (неорганической и органической) желательно знать правила растворимости сложных веществ. Наизусть учить, конечно, их не стоит — можно воспользоваться таблицей растворимости, которая приведена ниже.
Растворимы:
абсолютно все нитраты;
большинство солей аммония, натрия, калия (но есть исключения, например — гексанитритокобальтат (III) калия K3[Co(NO2)6]);
соли йодидной, хлороводородной и бромоводородной кислоты (но галогениды свинца (II), ртути (I) и серебра обладают умеренной растворимостью);
почти все сульфаты, кроме BaSO4, SrSO4, PbSO4 (при этом CaSO4 и Ag2SO4 умеренно растворимы).
Нерастворимы:
любые сульфиды, кроме сульфидов щелочных и щелочноземельных металлов, а также (NH4)2S;
любые гидроксиды, кроме гидроксидов щелочных металлов (умеренной растворимостью отличаются Sr(OH)2, Ca(OH)2, Ba(OH)2);
Качественные реакции органических веществ
В органической химии качественные реакции позволяют за считанные минуты определить класс соединения — узнать, относится ли исследуемый объект к спиртам, углеводам, альдегидам и т. д. По внешним эффектам судят о присутствии функциональных групп органических соединений в смеси или в растворе.
Белковые соединения при горении издают запах жженой шерсти. При добавлении концентрированной азотной кислоты они окрашивают раствор в ярко-желтый цвет, также характерно образование желтого осадка (ксантопротеиновая реакция). А если соединить в растворе белки со свежеосажденным гидроксидом меди (II), получится сине-фиолетовая смесь.
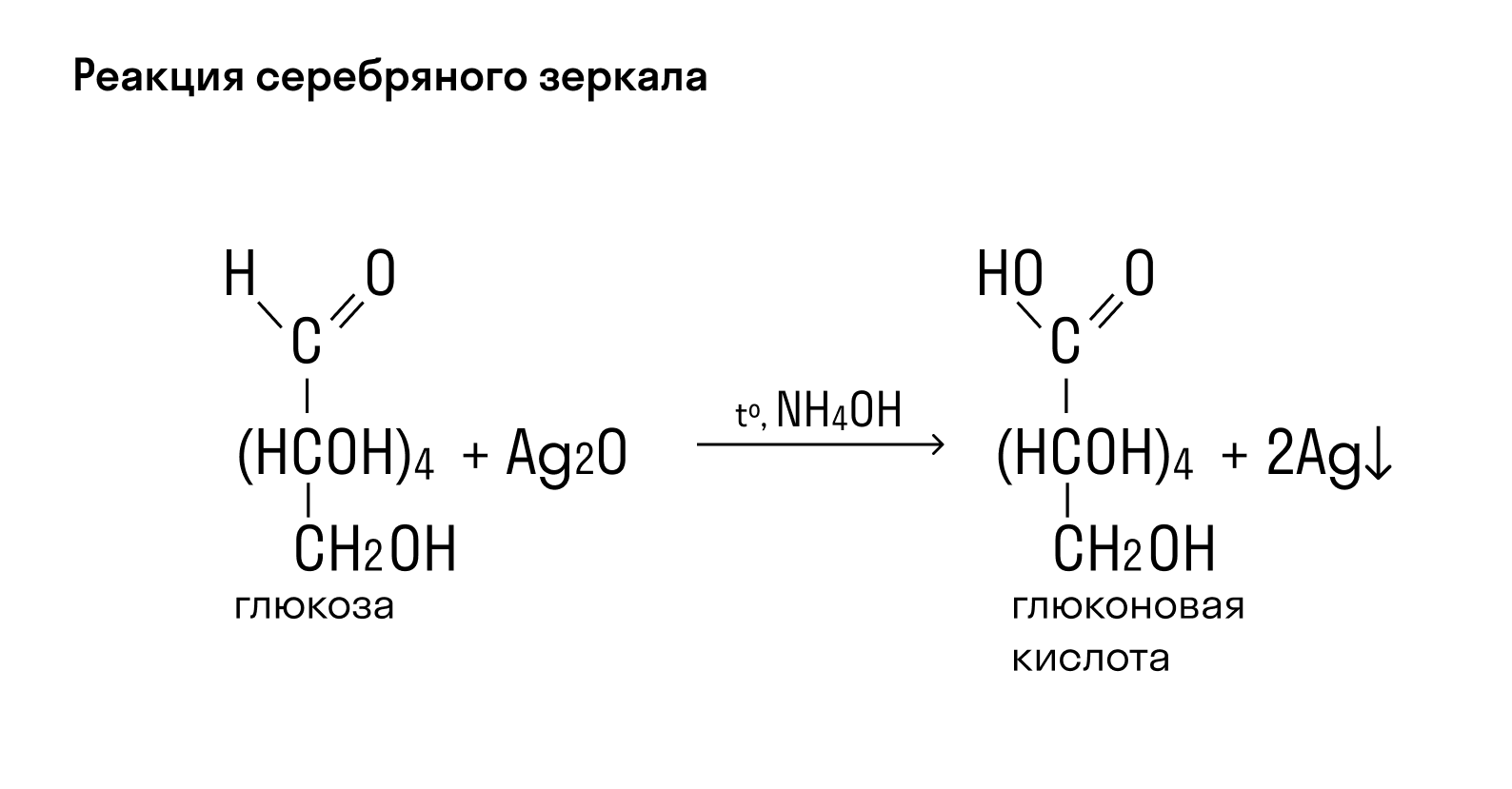
Глюкоза благодаря содержанию альдегидной группы в реакции с аммиачным раствором оксида серебра образует на стенках пробирки «серебряное зеркало». Вместе со свежеосажденным гидроксидом меди (II) она окрашивает раствор в синий цвет, а если данный раствор нагреть — происходит образование красно-оранжевого осадка.
СН2ОН — (СНОН)4 — СОН + Ag2O = СН2ОН — (СНОН)4 — СООН + 2Ag↓ — реакция «серебряного зеркала».
HOСН2 — (СНOH)4 — СН = O + 2Cu(OH)2 ⇒ HOСН2 — (СНOH)4 — СOOH + Cu2O + 2H2O — реакция глюкозы с гидроксидом меди (II).
Фенол с бромной водой образует белый осадок. Также он вступает в качественную реакцию с раствором соли трехвалентного железа — окрашивает его в фиолетовый цвет.
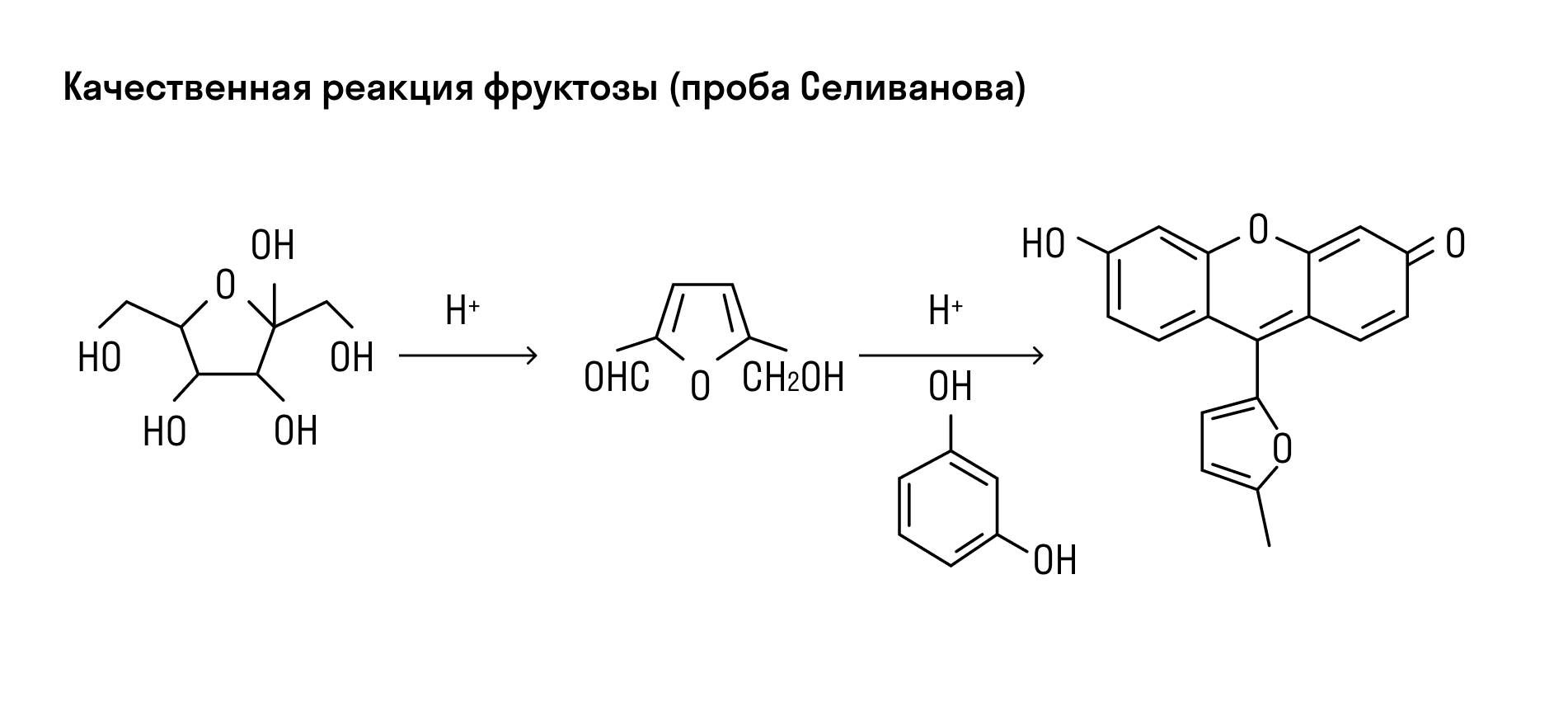
Углеводы с содержанием крахмала можно узнать по синему цвету раствора при добавлении йода. После нагревания такой раствор теряет цвет, но при охлаждении снова становится синим. Фруктозу можно идентифицировать по реакции с резорцином в растворе c соляной кислотой — смесь приобретает вишневый цвет (проба Селиванова).
Все качественные реакции с органическими соединениями в рамках статьи описать невозможно, но в таблице ниже указаны самые важные из них.
Справочные материалы «Признаки химических реакций» для подготовки к ОГЭ по химии
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Признаки химических реакций
Для выполнения заданий № 6, 18, 22 в ОГЭ необходимо точно описывать признаки химических реакций. Как правило, эти реакции являются реакциями ионного обмена. При реакциях ионного обмена чаще всего признаком реакции является выпадение осадка. Определяем это с помощью таблицы растворимости (данные вещества обозначены н)
Осадки бывают разных цветов и разной консистенции. Все это является частью описания признака реакции.
Не менее распространенным признаком реакции является выделение газа.
Газы без цвета с резким запахом, ядовитые — NH 3 (запах нашатырного спирта), H 2 S (запах тухлых яиц), SO 2 (резкий кислый запах). Остальные описываем как газы с неприятным запахом — NO, N 2 О
Газы окрашенные, с неприятным запахом, ядовитые — NO 2 (бурый газ), Cl 2 (желто – зеленый газ с запахом хлорки), О 3 ( газ синего цвета с резким запахом)
Газ без цвета и запаха, ядовитый – CO (угарный газ)
Газ, поддерживающий горение (вспыхивает тлеющая лучинка) — О 2
Газ, вызывающий помутнение известковой или баритовой воды, выделяется с характерным шипением — CO 2
Признаком реакции также является образование воды .
При сливании двух бесцветных растворов появление воды зрительно зафиксировать невозможно, поэтому в заданиях, описывающих признаки реакций, обычно значится: нет видимых признаков реакции.
Капельки воды обычно фиксируют при нагревании нерастворимых гидроксидов металлов.
Необходимо также знать реакции, идущие с изменением цвета. Это превращение гидроксида железа ( II ) в гидроксид железа ( III ) (цвет меняется с зеленого на бурый);
оксида меди ( II ) в растворимые соли меди ( II ) (цвет меняется с черного на голубой, хлорид меди зеленого цвета!);
гидроксида меди ( II ) в оксид меди ( II ) (цвет меняется с голубого на черный).
Если для реакции берут твердые вещества (оксиды, гидроксиды металлов, некоторые нерастворимые соли), а получают в результате реакции растворы, то признаком реакции значится : растворение вещества.
Краткое описание документа:
Данный материал представляет собой полное описание признаков химических реакций, упоминаемых в контрольно — измерительных материалах ОГЭ по химии. Содержание материала может быть использованы учителем для организации повторения раздела «Химические реакции», использоваться для проведения практических работ по химии в курсе основной школы.
Цвета осадков и газов в неорганической химии
Для сдачи ОГЭ необходимо знать и предсказывать по формуле цвет осадка или газа, а также характерные запахи, которыми обладают газы. В данном документе собраны необходимые данные по этому вопросу.
Осадки бывают разных цветов и разной консистенции. Все это является частью описания признака реакции.
Задание 13 ОГЭ по химии.

Автор: Фрундина Дарья Андреевна, учитель химии.
http://infourok.ru/spravochnie-materiali-priznaki-himicheskih-reakciy-dlya-podgotovki-k-oge-po-himii-3329402.html
http://4ege.ru/gia-po-himii/60744-cveta-osadkov-i-gazov-v-neorganicheskoj-himii.html