1.4.6. Реакции ионного обмена.
Реакции ионного обмена — реакции в водных растворах между электролитами, протекающие без изменений степеней окисления образующих их элементов.
Необходимым условием протекания реакции между электролитами (солями, кислотами и основаниями) является образование малодиссоциирующего вещества (вода, слабая кислота, гидроксид аммония), осадка или газа.
Расcмотрим реакцию, в результате которой образуется вода. К таким реакциям относятся все реакции между любой кислотой и любым основанием. Например, взаимодействие азотной кислоты с гидроксидом калия:
Исходные вещества, т.е. азотная кислота и гидроксид калия, а также один из продуктов, а именно нитрат калия, являются сильными электролитами, т.е. в водном растворе они существуют практически только в виде ионов. Образовавшаяся вода относится к слабым электролитам, т.е. практически не распадается на ионы. Таким образом, более точно переписать уравнение выше можно, указав реальное состояние веществ в водном растворе, т.е. в виде ионов:
Как можно заметить из уравнения (2), что до реакции, что после в растворе находятся ионы NO3 − и K + . Другими словами, по сути, нитрат-ионы и ионы калия никак не участвовали в реакции. Реакция произошла только благодаря объединению частиц H + и OH − в молекулы воды. Таким образом, произведя алгебраически сокращение одинаковых ионов в уравнении (2):
Уравнения вида (3) называют сокращенными ионными уравнениями, вида (2) — полными ионными уравнениями, а вида (1) — молекулярными уравнениями реакций.
Фактически ионное уравнение реакции максимально отражает ее суть, именно то, благодаря чему становится возможным ее протекание. Следует отметить, что одному сокращенному ионному уравнению могут соответствовать множество различных реакций. Действительно, если взять, к примеру, не азотную кислоту, а соляную, а вместо гидроксида калия использовать, скажем, гидроксид бария, мы имеем следующее молекулярное уравнение реакции:
Соляная кислота, гидроксид бария и хлорид бария являются сильными электролитами, то есть существуют в растворе преимущественно в виде ионов. Вода, как уже обсуждалось выше, – слабый электролит, то есть существует в растворе практически только в виде молекул. Таким образом, полное ионное уравнение данной реакции будет выглядеть следующим образом:
2H + + 2Cl − + Ba 2+ + 2OH − = Ba 2+ + 2Cl − + 2H2O
Сократим одинаковые ионы слева и справа и получим:
Разделив и левую и правую часть на 2, получим:
Полученное сокращенное ионное уравнение полностью совпадает с сокращенными ионным уравнением взаимодействия азотной кислоты и гидроксида калия.
При составлении ионных уравнений в виде ионов записывают только формулы:
1) сильных кислот (HCl, HBr, HI, H2SO4, HNO3, HClO4 ) (список сильных кислот надо выучить!)
2) сильных оснований (гидроксиды щелочных (ЩМ) и щелочно-земельных металлов(ЩЗМ))
3) растворимых солей
В молекулярном виде записывают формулы:
1) Воды H2O
2) Слабых кислот (H2S, H2CO3, HF, HCN, CH3COOH (и др. практически все органические)).
3) Слабых оcнований («NH4OH» и практически все гидроксиды металлов кроме ЩМ и ЩЗМ.
4) Малорастворимых солей (↓) («М» или «Н» в таблице растворимости).
5) Оксидов (и др. веществ, не являющихся электролитами).
Попробуем записать уравнение между гидроксидом железа (III) и серной кислотой. В молекулярном виде уравнение их взаимодействия записывается следующим образом:
Гидроксиду железа (III) соответствует в таблице растворимости обозначение «Н», что говорит нам о его нерастворимости, т.е. в ионном уравнении его надо записывать целиком, т.е. как Fe(OH)3 . Серная кислота растворима и относится к сильным электролитам, то есть существует в растворе преимущественно в продиссоциированном состоянии. Сульфат железа (III), как и практически все другие соли, относится к сильным электролитам, и, поскольку он растворим в воде, в ионном уравнении его нужно писать в виде ионов. Учитывая все вышесказанное, получаем полное ионное уравнение следующего вида:
Сократив сульфат-ионы слева и справа, получаем:
разделив обе части уравнения на 2 получаем сокращенное ионное уравнение:
Теперь давайте рассмотрим реакцию ионного обмена, в результате которой образуется осадок. Например, взаимодействие двух растворимых солей :
Все три соли – карбонат натрия, хлорид кальция, хлорид натрия и карбонат кальция (да-да, и он тоже) – относятся к сильным электролитам и все, кроме карбоната кальция, растворимы в воде, т.е. есть участвуют в данной реакции в виде ионов:
2Na + + CO3 2- + Ca 2+ + 2Cl − = CaCO3↓+ 2Na + + 2Cl −
Сократив одинаковые ионы слева и справа в данном уравнении, получим сокращенное ионное:
Последнее уравнение отображает причину взаимодействия растворов карбоната натрия и хлорида кальция. Ионы кальция и карбонат-ионы объединяются в нейтральные молекулы карбоната кальция, которые, соединяясь друг с другом, порождают мелкие кристаллы осадка CaCO3 ионного строения.
Примечание важное для сдачи ЕГЭ по химии
Чтобы реакция соли1 с солью2 протекала, помимо базовых требований к протеканиям ионных реакций (газ, осадок или вода в продуктах реакции), на такие реакции накладывается еще одно требование – исходные соли должны быть растворимы. То есть, например,
реакция не идет, хотя FeS – потенциально мог бы дать осадок, т.к. нерастворим. Причина того что реакция не идет – нерастворимость одной из исходных солей (CuS).
протекает, так как карбонат кальция нерастворим и исходные соли растворимы.
То же самое касается взаимодействия солей с основаниями. Помимо базовых требований к протеканию реакций ионного обмена, для того чтобы соль с основанием реагировали необходима растворимость их обоих. Таким образом:
т.к. Cu(OH)2 нерастворим, хотя потенциальный продукт CuS был бы осадком.
А вот реакция между NaOH и Cu(NO3)2 протекает, так оба исходных вещества растворимы и дают осадок Cu(OH)2:
Внимание! Ни в коем случае не распространяйте требование растворимости исходных веществ дальше реакций соль1+ соль2 и соль + основание.
Например, с кислотами выполнение этого требования не обязательно. В частности, все растворимые кислоты прекрасно реагируют со всеми карбонатами, в том числе нерастворимыми.
1) Соль1+ соль2 — реакция идет если исходные соли растворимы, а в продуктах есть осадок
2) Соль + гидроксид металла – реакция идет, если в исходные вещества растворимы и в продуктах есть осадок или гидроксид аммония.
Рассмотрим третье условие протекания реакций ионного обмена – образование газа. Строго говоря, только в результате ионного обмена образование газа возможно лишь в редких случаях, например, при образовании газообразного сероводорода:
В большинстве же остальных случаев газ образуется в результате разложения одного из продуктов реакции ионного обмена. Например, нужно точно знать в рамках ЕГЭ, что с образованием газа в виду неустойчивости разлагаются такие продукты, как H2CO3, «NH4OH» и H2SO3:
(«NH4OH» — такая запись формулы в кавычках подразумевает, что в реальности вещества с такой формулой не существует. Формула используется для большей простоты промежуточных записей. В реальности вместо «гидроксида аммония» правильнее писать формулу гидрата аммиака NH3·H2O).
Другими словами, если в результате ионного обмена образуются угольная кислота, гидроксид аммония или сернистая кислота, реакция ионного обмена протекает благодаря образованию газообразного продукта:
Запишем ионные уравнения для всех указанных выше реакций, приводящих к образованию газов. 1) Для реакции:
В ионном виде будут записываться сульфид калия и бромид калия, т.к. являются растворимыми солями, а также бромоводородная кислота, т.к. относится к сильным кислотам. Сероводород же, являясь малорастворимым и плохо диссоциирцющим на ионы газом, запишется в молекулярном виде:
2K + + S 2- + 2H + + 2Br — = 2K + + 2Br — + H2S↑
Сократив одинаковые ионы получаем:
2) Для уравнения:
В ионном виде запишутся Na2CO3, Na2SO4 как хорошо растворимые соли и H2SO4 как сильная кислота. Вода является малодиссоциирующим веществом, а CO2 и вовсе неэлектролит, поэтому их формулы будут записываться в молекулярном виде:
3) для уравнения:
Молекулы воды и аммиака запишутся целиком, а NH4NO3, KNO3 и KOH запишутся в ионном виде , т.к. все нитраты являются хорошо растворимыми солями, а KOH является гидроксидом щелочного металла, т.е. сильным основанием:
Полное и сокращенное уравнение будут иметь вид:
Уравнения состояния природных газов
СОСТАВ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ПРИРОДНЫХ ГАЗОВ
Природные газы – это вещества, которые при нормальных (н.у.) и стандартных (с.у.) условиях являются газообразными. В зависимости от условий газы могут находиться в свободном, адсорбированном или растворённом состояниях.
В пластовых условиях газы в зависимости от их состава, давления и температуры (термобарического режима в пласте) могут находиться в различных агрегатных состояниях – газообразном, жидком, в виде газожидкостных смесей.
Свободный газ обычно расположен в повышенной части пласта и находится в газовой шапке. Если газовая шапка в нефтяной залежи отсутствует, то весь газ залежи растворён в нефти.
Давление, при котором имеющийся в залежи газ начинает выделяться из нефти, называется давлением насыщения. Давление насыщения нефти газом в пластовых условиях определяется составами, количеством нефти и газа, пластовой температурой.
Растворённый газ, по мере снижения давления при добыче, выделяется из нефти. Он называться попутным газом. В пластовых условиях все нефти содержат растворённый газ. Чем выше давление в пласте, тем больше газа может быть растворено в нефти. В 1 м 3 нефти содержание растворённого газа может достигать 1000 м 3 .
Состав природных газов
Природные газы, добываемые из газовых, газоконденсатных и нефтяных месторождений, состоят из углеводородов (УВ) метанового ряда СН4–С4Н10: метана, этана, пропана, изобутана и н-бутана, а также неуглеводородных компонентов: H2S, N2, CO, CO2, H2, Ar, He, Kr, Xe и других.
При нормальных и стандартных условиях термодинамически в газообразном состоянии существуют только УВ состава С1–С4. Углеводороды алканового ряда, начиная с пентана и выше, при этих условиях находятся в жидком состоянии, температуры кипения для изо-С5 равна 28 о С, а для н-С5 → 36 о С. Однако, в попутных газах иногда наблюдаются углеводороды С5 за счёт термобарических условий, фазовых переходов и других явлений.
Качественный состав газов нефтяного происхождения всегда одинаков (что нельзя сказать о газах вулканических извержений). Количественное распределение компонентов практически всегда различно.
Состав газовых смесей выражается в виде массовойилиобъемной концентрации компонентовв процентахи мольных долях.

где Wi — масса i-го компонента; ΣWi — суммарная масса смеси.

где Vi — объем i-го компонента в смеси; Σ Vi — суммарный объем газа.

где ni — число молей i-го компонента в смеси; Σпi — суммарное число молей газа в системе.
Зависимость между объемной и мольной концентрациями компонентов вытекает из закона Авогадро. Так как равные объемы любых газов при одинаковых температуре и давлении содержат одинаковое число молекул, то объем i-го компонента смеси будет пропорционален числу молей i-го компонента:

где К — коэффициент пропорциональности. Следовательно

т. е. концентрация компонента в процентах по молям (% мол.) в смеси газов при атмосферном давлении практически совпадает с объемной концентрацией этого компонента в процентах (% об.).
При высоких давлениях жидкие углеводороды растворяются в газовой фазе (газовые растворы, газоконденсаты). Поэтому при высоких давлениях плотность газа может приближаться к плотности легких углеводородных жидкостей.
В зависимости от преобладания в нефтяных газах легких (метан, этан) или тяжелых (пропан и выше) углеводородов газы разделяются на сухие и жирные.
Сухимгазом называют природный газ, который не содержит тяжелых углеводородов или содержит их в незначительных количествах.
Жирным газом называют газ, содержащий тяжелые углеводороды в таких количествах, когда из него целесообразно получать сжиженные газы или газовые бензины.
На практике принято считать жирным газом такой, в 1 м 3 которого содержится более 60г газового бензина.
Газы, добываемые из чисто газовых месторождений, содержат более 95 % метана (табл. 2.2) и представляют собой, так называемые, сухие газы.
| Месторождение | СН4 | С2Н6 | С3Н8 | С4Н10 | N2 | СО2 | Относит. плотность |
| Северо-Ставропольское | 98,9 | 0,29 | 0,16 | 0,05 | 0,4 | 0,2 | 0,56 |
| Уренгойское | 98,84 | 0,1 | 0,03 | 0,03 | 1,7 | 0,3 | 0,56 |
| Шатлыкское | 95,58 | 1,99 | 0,35 | 0,15 | 0,78 | 1,15 | 0,58 |
| Медвежье | 98,78 | 0,1 | 0,02 | – | 1,0 | 0,1 | 0,56 |
| Заполярное | 98,6 | 0,17 | 0,02 | 0,013 | 1,1 | 0,18 | 0,56 |
Тяжёлым нефтям свойственны сухиепопутные газы с преобладанием метана в их составе. Например, содержание метана в составе попутного газа Русского месторождения Западной Сибири (плотность нефти более 920 кг/м 3 ) аналогично содержанию метана в составе газа газового Уренгойского месторождения и составляет около 98,8 об. %.
Содержание метана в газах газоконденсатных месторождений колеблется в интервале 75–95 % (табл. 2.3). Попутный газ газоконденсатных месторождений и лёгких нефтей достаточно жирный.
| Месторождение | СН4 | С2Н6 | С3Н8 | С4Н10 | С5Н12 | N2 | СО2 | Отност. плотность |
| Вуктыльское | 74,80 | 8,70 | 3,90 | 1,80 | 6,40 | 4,30 | 0,10 | 0,882 |
| Оренбургское | 84,00 | 5,00 | 1,60 | 0,70 | 1,80 | 3,5 | 0,5 | 0,680 |
| Ямбургское | 89,67 | 4,39 | 1,64 | 0,74 | 2,36 | 0,26 | 0,94 | 0,713 |
| Уренгойское (БУ–8, БУ–14) | 88,28 | 5,29 | 2,42 | 1,00 | 2,52 | 0,48 | 0,01 | 0,707 |
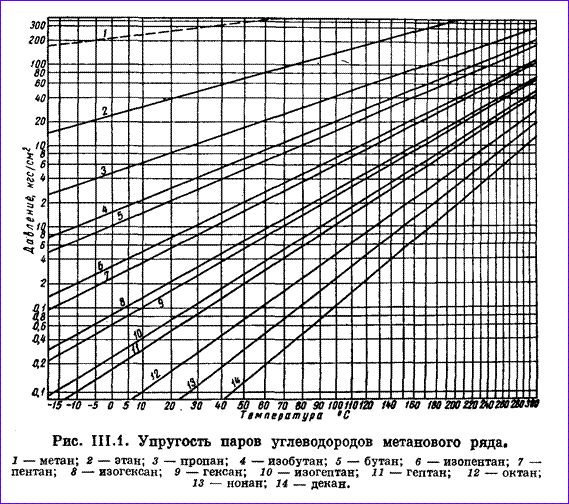
Газы, добываемые вместе с нефтью из нефтяных месторождений (попутные газы) представляют собой смесь метана, этана, пропан-бутановой фракции, газового бензина. При повышенном давлении углеводороды состава С3, С4 легко сжижаются. В пластовых условиях в газообразном состоянии находится практически один метан. При нормальных условиях углеводороды от метана СН4 до бутана С4Н10 находятся в газообразном состоянии. Остальные углеводороды при этих условиях — жидкости. Пропан и бутан при повышении давления легко переходят в жидкое состояние. Упругость насыщенных паров углеводородов, т. е. то давление, при котором газ начинает конденсироваться и переходить в жидкое состояние, повышается с ростом температуры и она тем выше, чем ниже плотность углеводорода. Упругость пара — нелинейная функция температуры. Графики на рис. 2.9 построены так, чтобы получить линейную зависимость между упругостью паров углеводородов и температурой: шкала упругости пара принята логарифмической, а температурная шкала (в °С) принята произвольной.
Удобство таких графиков заключается в том, что они позволяют легко и быстро определять по известной упругости пара при некоторой температуре упругость его паров при других температурах. Для этого проводят прямую линию через, известную точку и общую точку пересечения прямых упругостей паров (находящуюся вне графика на продолжении правой верхней части диаграммы).
Из рис. 2.9 следует, что давление паров метана наибольшее; при нормальных условиях его нельзя превратить в жидкость (пунктирная линия 1 давления ненасыщенного пара метана), так как его критическая температура t = -82,95° С. Давление насыщенных паров других углеводородов намного ниже. Например, бутан при t = — 20° С имеет упругость паров, равную 0,22 Мн/м 2 (2,2 кГ/см 2 ).
К расчёту физико-химических свойств газа как многокомпонентной смеси можно применять принцип аддитивности.
Аддитивный подход к расчёту физико-химических и технологических параметров означает, что каждый компонент газа в смеси ведёт себя так, как если бы он в данной смеси был один.
Следовательно, для оценки макроскопических свойств нефтяного газа (при н.у. и с.у.) применимы аддитивные методы расчётов физико-химических и технологических параметров (Псмеси):

где где Ni – мольная доля; gi – весовая доля; Vi – объёмная доля; Пi – физико-химическое свойство i-го компонента.
Для идеальных газов общее давление в системе (смеси газов) равно сумме парциальных давлений компонентов (закон Дальтона):

где Р – общее давление смеси газов; рi – парциальное давление i-го компонента в смеси. Откуда


То есть, парциальное давление компонента в газовой смеси равно произведению его молярной доли на общее давление смеси газов.
Аддитивность парциальных объёмов (Vi) компонентов газовой смеси выражается законом Амага:

где V – общий объём смеси газов; Vi – мольный объём i-го компонента газа в смеси.
По аналогии с уравнениями (2.22–2.23) мольный объём компонента в газе можно оценить:

Как аддитивные величины рассчитывают все физико-химические свойства газа, например, плотность смеси газов:

где ρi – плотность i–го компонента; Ni – мольная доля i–го компонента.
Уравнения состояния природных газов
Наука о веществе основывается на современных знаниях об атомах – мельчайших частицах элементов и молекулах – мельчайших частицах химических соединений. Атомы имеют размер порядка 10
8 см (одного ангстрема). Крупные молекулы, содержащие тысячи атомов, имеют размер около 10
6 см. Характер движения молекул и атомов, их взаимодействие определяют, в каком агрегатном состоянии находится вещество – в твердом, жидком или газообразном.
Молекулы могут совершать поступательное, вращательное и колебательное движение. Если вещество находится в газообразном или жидком состоянии, то возможны все три вида этих движений. Если же вещество затвердевает, преобладающей формой движения молекул и атомов становятся колебания.
При изучении состояния вещества стремятся найти взаимосвязь между давлением, при котором находится вещество, его плотностью и температурой. Если обозначить давление p, плотность ρ, а обратную ей величину – удельный объем вещества V и температуру Т, то состояние вещества будет характеризоваться соотношением р, V и Т или, как принято в термодинамике, 


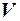



Газовая постоянная численно равна работе расширения 1 кг идеального газа в изобарическом процессе при увеличении температуры газа на 1 К.
При высоком сжатии газа его параметры уже не будут описываться уравнением состояния идеального газа. Ван-дер-Ваальсом были введены в уравнение состояния идеального газа (2.27) поправки: величина b, учитывающая объем самих молекул, и величина a/v 2 , учитывающая взаимодействие между молекулами. В результате было получено уравнение состояния «реального газа» (уравнение Ван-дер-Ваальса) в следующем виде:

Сложность применения уравнения (2.28) для практических расчетов заключается в том, что в газонефтепромысловом деле встречаются, как правило, смеси газов, для которых уравнение Ван-дер-Ваальса применимо с трудом.
Хорошее согласование с экспериментальными данными для газов, плотность которых не превышает двух третей от плотности газа при критических условиях, получают по уравнению Битти-Бриджмена
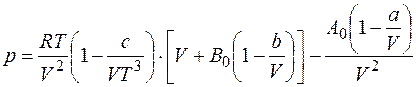
где а, Ь, с, Ао и Во — постоянные для данных компонентов природного газа, которые вычисляются на основании экспериментальных данных.
Коэффициент сверхсжимаемости. При большом числе компонентов расчеты по приведенным формулам становятся трудоемкими. Поэтому для расчета состояния реальных газов обычно пользуются обобщенным газовым законом в виде уравнения Клапейрона, в которое вводится поправка (коэффициент сверхсжимаемости), учитывающая отклонение реальных газов от законов сжатия и расширения идеальных газов.

где z – коэффициент сверхсжимаемости; 
Характер изменения коэффициента сверхсжимаемости z, который показывает отношение объема реального газа к объему идеального при одних и тех же условиях, с изменением температуры и давления можно установить, учитывая отличия реальных газов от идеальных. В последних молекулы занимают незначительный объем (по сравнению с объемом газа) и не испытывают сил притяжения друг к другу. Молекулы же реальных газов обладают определенными размерами, массой и взаимодействуют друг с другом. Поэтому реальный газ приближается к идеальным при низких давлениях, когда число молекул в единице объема невелико. Следовательно, при низких давлениях величина коэффициента сжимаемости должна быть близка к единице. С повышением давления молекулы газа сближаются и силы притяжения между молекулами начинают помогать внешним силам, сжимающим газ. Вследствие этого реальные газы должны сжиматься сильнее, чем при тех же условиях сжимаются идеальные газы. Следовательно, с ростом давления коэффициент сжимаемости z должен вначале уменьшаться. Когда углеводородный газ сжат до такой степени, что он приближается по свойствам к жидкостям, межмолекулярные расстояния уменьшаются настолько, что начинают проявляться взаимоотталкивающие силы между молекулами, препятствующие дальнейшему уменьшению объема газа. В этих условиях углеводородный газ должен сжиматься меньше, чем при малых давлениях, т. е. значения z вновь возрастают при увеличении давления.
С приближением давления и температуры к их критическим значениям свойства газовой и жидких фаз становятся одинаковыми, поверхность раздела между ними исчезает и плотности их уравниваются.
Критическая температура (Ткр) – максимальная температура, при которой газ и жидкость могут ещё сосуществовать в равновесии (табл. 2.4).
Критическое давление – давление паров вещества при критической температуре (табл. 2.3), а объём вещества при данных Ткр и pкр, отнесённый к 1 молю или к единице массы вещества, называется критическим удельным объёмом.
Упругость насыщенных паров углеводородов, это давление, при котором газ начинает конденсироваться и переходить в жидкое состояние, повышается с ростом температуры и она тем выше, чем ниже плотность углеводорода.
Таблица 2.4 Критические давления и температуры компонентов нефтяных газов
| № п./п. | Компонент | Относит. моляр. масса | РКРi, МПа | ТКРi, К |
| Метан, СН4 | 16,04 | 4,63 | 190,55 | |
| Этан, С2Н6 | 30,07 | 4,87 | 305,45 | |
| Пропан, С3Н8 | 44,09 | 4,26 | 369,82 | |
| изо-Бутан, i-С4Н10 | 58,12 | 3,65 | 408,13 | |
| н-Бутан, n-С4Н10 | 58,12 | 3,797 | 425,16 | |
| изо-Пентан, i-С5Н12 | 72,15 | 3,381 | 460,4 | |
| н-Пентан, n-С5Н12 | 72,15 | 3,369 | 469,6 | |
| н-Гексан, С6Н14 | 86,17 | 3,031 | 507,4 | |
| н-Гептан, С7Н16 | 100,20 | 2,736 | 640,61 | |
| Азот, N2 | 28,02 | 3,399 | 126,25 | |
| Двуокись углерода, СО2 | 44,01 | 7,387 | 304,15 | |
| Сероводород, Н2S | 34,08 | 9,01 | 373,55 |
Приведенные параметры газов.Коэффициент сжимаемости газов z, обычно определяют по экспериментальным графикам. Чтобы избежать построения графиков для каждого газа или их смесей, на основе экспериментальных данных составлен график изменения коэффициента z в зависимости от приведенной температуры и приведенного давления для метана (рис.2.2), который на основании закона соответственных состояний с достаточной точностью может быть использован для определения z, всех газов, состоящих на 95—96% из метана. Коэффициенты сжимаемости на этом графике поставлены в зависимость от приведенного давления p пр и приведенной температуры Tпр, которые определяются по формулам
 |  |
где р и Т — давление и температура газа; рКрi и Tкрi — критические давление и абсолютная температура i-го компонента; 


Таким образом, рпр и Tпр выражают давление и абсолютную температуру в долях от соответствующих критических величин.
Как образуется газ в уравнении
Урок посвящен изучению темы «Реакции ионного обмена». На нём вы рассмотрите сущность реакций, протекающих между растворами кислот, солей и щелочей. На уроке будет дано определение новому понятию реакции ионного обмена.
Также будут рассмотрены условия протекания реакций ионного обмена до конца. Чтобы лучше понять, какие необходимо соблюдать условия протекания реакций ионного обмена до конца, будет проведено повторение, что собой представляют эти реакции, их сущность. Приводятся примеры на закрепление этих понятий.
Урок поможет закрепить умение составлять уравнения реакций ионного обмена в молекулярной и ионной формах, научит составлять по сокращенному ионному уравнению молекулярные.
I. Сущность реакций ионного обмена
Реакциями ионного обмена называют реакции между растворами электролитов, в результате которых они обмениваются своими ионами.
Реакции ионного обмена протекают до конца (являются практически необратимыми) в тех случаях, если образуются слабый электролит, осадок (нерастворимое или малорастворимое вещество), газ.
AgNO3 + HCl = AgCl
Реакция протекает до конца, так как выпадает осадок хлорида серебра
Сu(OH)2 + 2HCl = CuCl2 + 2H2O
Реакция идет до конца, так как образуется слабый электролит вода
Na2CO3 + 2H2SO4 = Na2SO4 + CO2
Реакция протекает до конца, так как образуется углекислый газ
Правила написания уравнений реакций в ионном виде
1. Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты.
2. Пользуясь таблицей растворимости, записывают в ионном виде формулы веществ (солей, кислот, оснований), обозначенных в таблице растворимости буквой «Р» (хорошо растворимые в воде), исключение – гидроксид кальция, который, хотя и обозначен буквой «М», все же в водном растворе хорошо диссоциирует на ионы.
3. Нужно помнить, что на ионы не разлагаются металлы, оксиды металлов и неметаллов, вода, газообразные вещества, нерастворимые в воде соединения, обозначенные в таблице растворимости буквой «Н». Формулы этих веществ записывают в молекулярном виде. Получают полное ионное уравнение.
4. Сокращают одинаковые ионы до знака «равно» и после него в уравнении. Получают сокращенное ионное уравнение.
На ионы диссоциируют
Реагенты (исходные вещества)
Растворимые (P) в воде (см. ТР):
(включая Ca(OH)2 – M)
Растворимые (P) в воде (см. ТР):
Исключения – неустойчивые вещества не диссоциируют, а разлагаются на газ и воду:
Р — растворимое вещество;
М — малорастворимое вещество;
ТР — таблица растворимости.
Алгоритм составления реакций ионного обмена (РИО)
в молекулярном, полном и кратком ионном виде
1) Записываем уравнение РИО в молекулярном виде:
Взаимодействие сульфата меди (II) и гидроксида натрия:
2) Используя ТР указываем растворимость веществ воде:
— Если продукт является М или Н – оно выпадает в осадок, справа от химической формулы ставим знак ↓
— Если продукт является газом, справа от химической формулы ставим знак ↑
3) Записываем уравнение РИО в полном ионном виде. Какие вещества диссоциируют см. в таблице — ПАМЯТКЕ
Cu 2 + + SO4 2- + 2Na + + 2OH — = 2Na + + 2SO4 + Cu(OH)2↓
Полный ионный вид
4) Записываем уравнение реакции в кратком ионном виде. Сокращаем одинаковые ионы, вычёркивая их из уравнения реакции.
Помните! РИО необратима и практически осуществима, если в продуктах образуются:
Краткий ионный вид
Вывод – данная реакция необратима, т.е. идёт до конца, т.к. образовался осадок Cu(OH)2↓
Заишем еще несколько примеров РИО, идущих с образованием осадка:
Пример №1
а) Молекулярное уравнение реакции двух растворимых солей:
б) Полное ионное уравнение реакции:
2Al 3+ + 3SO4 2- + 3Ba 2+ + 6Cl — = 3BaSO4↓ + 2Al 3+ + 6Cl —
в) Cокращенное ионное уравнение реакции:
Пример №2
а) Молекулярное уравнение реакции нерастворимого основания с кислотой:
б) Полное ионное уравнение реакции:
В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
Полное ионное уравнение реакции:
2Na + + CO3 2- + 2H + + 2Cl — = 2Na + + CO2↑ + H2O + 2Cl —
Cокращенное ионное уравнение реакции:
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода (IV).
Заишем еще несколько примеров РИО, идущих с образованием газа:
Пример №1
Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой:
Полное ионное уравнение реакции:
2K + + S 2– + 2H + + 2Cl – = 2K + + 2Cl – + H2S↑
Cокращенное ионное уравнение реакции:
Пример №2
Молекулярное уравнение реакции нерастворимой соли (карбоната) с кислотой:
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.
Посмотрите видео-опыт: “Реакция нейтрализации”
Пример №1
Молекулярное уравнение реакции щелочи с кислотой:
KOH (р) + HCl (р) = KCl(р) + H2O (мд)
Полное ионное уравнение реакции:
K + + OH – + H + + Cl – = K + + Cl – + H2O
Cокращенное ионное уравнение реакции:
Пример №2
Молекулярное уравнение реакции основного оксида с кислотой:
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
CaO + 2H+ = Ca 2+ + H2O.
Пример №3
Молекулярное уравнение реакции нерастворимого основания с кислотой:
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.
V. Выполнение заданий
Задание №1. Определите, может ли осуществляться взаимодействие между растворами гидроксида калия и хлорида аммония, записать реакциив молекулярном, полном, кратком ионном виде.
— Составляем химические формулы веществ по их названиям, используя валентности и записываем РИО в молекулярном виде (проверяем растворимость веществ по ТР):
так как NH4OH неустойчивое вещество и разлагается на воду и газ NH3уравнение РИО примет окончательный вид
— Cоставляем полное ионное уравнение РИО, используя ТР (не забывайте в правом верхнем углу записывать заряд иона):
K + + OH — + NH4 + + Cl — = K + + Cl — + NH3 ↑+ H2O
— Cоставляем краткое ионное уравнение РИО, вычёркивая одинаковые ионы до и после реакции:
Взаимодействие между растворами следующих веществ может осуществляться, так как продуктами данной РИО являются газ (NH3 ↑) и малодиссоциирующее вещество вода (H2O).
Подберите вещества, взаимодействие между которыми в водных растворах выражается следующими сокращёнными уравнениями. Составьте соответствующие молекулярное и полное ионное уравнения.
— Используя ТР подбираем реагенты — растворимые в воде вещества, содержащие ионы 2H + и CO3 2- .
— Составляем молекулярное уравнение РИО:
так как угольная кислота – неустойчивое вещества, она разлагается на углекислый газ CO2 ↑ и воду H2O, уравнение примет окончательный вид:
— Составляем полное ионное уравнение РИО:
6H + +2 PO4 3- + 6 K + + 3CO3 2- -> 6 K + + 2 PO4 3- + 3CO2 ↑ + 3H2O
— Составляем краткое ионное уравнение РИО:
Сокращаем коэффициенты на три и получаем:
В конечном итоге мы получили искомое сокращённое ионное уравнение, следовательно, задание выполнено верно.
Задание №3. Запишите реакцию обмена между оксидом натрия и фосфорной кислотой в молекулярном, полном и кратком ионном виде.
1. Составляем молекулярное уравнение, при составлении формул учитываем валентности (см. ТР)
3Na2O (нэ) + 2H3PO4 (р) -> 2Na3PO4 (р) + 3H2O (мд), где нэ — неэлектролит, на ионы не диссоциирует,
мд — малодиссоциирующее вещество, на ионы не раскладываем, вода — признак необратимости реакции
2. Составляем полное ионное уравнение:
3. Сокращаем одинаковые ионы и получаем краткое ионное уравнение:
3Na2O + 6H + -> 6Na + + 3H2O
Сокращаем коэффициенты на три и получаем:
Na2O + 2H + -> 2Na + + H2O
Данная реакция необратима, т.е. идёт до конца, так как в продуктах образуется малодиссоциирующее вещество вода.
VI. Задания для самостоятельной работы
Задание №1. Посмотрите следующий эксперимент:
Составьте уравнение реакции ионного обмена карбоната натрия с серной кислотой в молекулярном, полном и кратком ионном виде.
Задание №2. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
Задание №3. Посмотрите следующий эксперимент:
Составьте уравнение реакции ионного обмена хлорида бария с сульфатом магния в молекулярном, полном и кратком ионном виде.
Задание №4. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
http://poisk-ru.ru/s32782t11.html
http://kardaeva.ru/89-dlya-uchenika/9-klass/140-reaktsii-ionnogo-obmena-i-usloviya-ikh-protekaniya