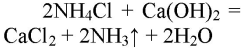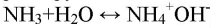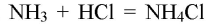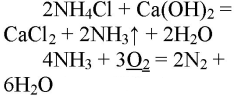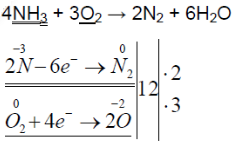Вопросы к параграфу 25 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
§ 25. Получение аммиака и изучение его свойств
1. Получение аммиака и растворение его в воде. 1) В фарфоровой ступке хорошо перемешайте приблизительно равные объемы кристаллического хлорида аммония МН4Сl и порошка гидроксида кальция Са(ОН)2 (опыт удаётся лучше, если известь слегка влажная). Приготовленную смесь насыпьте в пробирку на 1/3 её объёма. Закройте пробирку пробкой с газоотводной трубкой, конец которой опущен в другую сухую пробирку, закрепленную в штативе открытым концом вниз (рис. 22). Нагрейте смесь в пробирке. 2) Как только почувствуете острый запах (нюхать осторожно!), пробирку с газом, не переворачивая, закройте пробкой, погрузите её в сосуд с водой и откройте пробку. 3) После заполнения пробирки водой закройте её отверстие пробкой и выньте пробирку из воды. Половину полученного раствора перелейте в другую пробирку. В одну пробирку поместите красную лакмусовую бумагу. В другую пробирку добавьте несколько капель раствора фенолфталеина, а затем немного разбавленной соляной кислоты. О каких свойствах водного раствора аммиака свидетельствует его действие на индикаторы? Как это можно объяснить с позиций теории электролитической диcсоциации? Что происходит при действии кислоты на водный раствор аммиака? Составьте уравнение соответствующей химической реакции.
1) В фарфоровой ступке перемешали равные объемы кристаллического хлорида аммония МН4Сl и порошка гидроксида кальция Са(ОН)2.
Приготовленную смесь насыпали в пробирку на 1/3 её объёма. Закрыли пробирку пробкой с газоотводной трубкой, конец которой опущен в другую сухую пробирку, закрепленную в штативе открытым концом вниз. Нагрели смесь в пробирке.
Как только почувствовали запах, закрыли пробирку и пробкой и погрузили в сосуд с водой. Открыли пробирку. Полученный раствор разделили на две части: в одну помещают лакмус, в другую — несколько капель фенолфталеина и разбавленную кислоту.
При реакции хлорида аммония с гидроксидом кальция выделяется бесцветный газ с запахом нашатырного спирта
Газ хорошо растворяется в воде и немного в с ней взаимодействует:
Лакмусовая бумажка в этом растворе окрашивается в синий цвет. Фенолфталеин окрашивает раствор в малиновый цвет, при добавлении соляной кислоты в раствор фенолфталеин обесцветится:
Получили аммиак. При его растворении образовывается водный раствор аммиака, обладающий основными свойствами (окрашивает индикаторы в цвет щелочной среды).
С позиции теории электролитической диссоциации аммиак — это основание (в растворе находятся
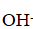
ионы).
Аммиак и соляная кислота образуют аммиачную соль. имеющую кислую среду (хлорид аммония — соль, образованная слабым основанием и сильной кислотой).
2. Горение аммиака в кислороде. Снова слегка нагрейте пробирку со смесью хлорида аммония и гидроксида кальция. Газоотводную трубку введите в стеклянный цилиндр с кислородом и при помощи лучинки подожгите газ (рис. 23). Какие вещества образуются в процессе горения аммиака? Напишите уравнение соответствующей реакции. Подчеркните в уравнении одной чертой окислитель, а двумя — восстановитель.
Нагрели пробирку со смесью хлорида аммония и гидроксида кальция. Газоотводную трубку ввели в стеклянный цилиндр с кислородом и при помощи лучинки подожгли газ.
В результате реакции хлорида аммония и гидроксида кальция выделяется бесцветный газ с запахом нашатырного спирта:
При горящей лучинке аммиак горит жёлто-зелёным пламенем:
При горении аммиака образуются вода и азот. аммиак горит в чистом кислороде, но не в воздухе. при горении аммиак окисляется до азота, проявляет восстановительные свойства.
3. Взаимодействие аммиака с кислотами. В приборе для получения газов замените пробирку с использованной смесью хлорида аммония и гидроксида кальция на пробирку со свежей порцией смеси. Пробирку слегка нагрейте. Газоотводную трубку последовательно введите в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки должен находиться на расстоянии 5—6 мм от поверхности кислоты. Как объяснить появление белого дыма? Напишите уравнения соответствующих реакций. Почему конец газоотводной трубки нельзя погружать в кислоту, а можно лишь приближать к ней?
В приборе для получения газов заменили пробирку с использованной смесью хлорида аммония и гидроксида кальция на пробирку со свежей порцией смеси. Пробирку слегка нагрели. Газоотводную трубку последовательно ввели в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки вывели на расстояние 5—6 мм от поверхности кислоты.
Наблюдается появление белого дыма, характерного для соли аммония:
Конец газоотводной трубки можно только приближать к кислоте, а не погружать в неё, чтобы кислоту не засосало в смесь.
При взаимодействии аммиака с концентрированными кислотами образуются соли аммония.
Лабораторный практикум по химии в 9 классе
учебно-методический материал по химии (9 класс)
В данной работе представлены инструкции к проведению практических работ в 9 классе химико-биологической направленности.
Скачать:
| Вложение | Размер |
|---|---|
| Инструкции для проведения практических работ в 9 классе химико-биологической направленности | 98.5 КБ |
Предварительный просмотр:
Практическая работа № 1
Тема: Получение аммиака и изучение его свойств.
Оборудование и реактивы: пробирки, пробиркодержатель, спиртовка, спички, универсальная индикаторная бумага, эксикатор, пробка с газоотводной трубкой, ступка с пестиком, раствор хлорида железа (III), концентрированные кислоты: азотная и соляная, кристаллический хлорид аммония, гашеная известь.
Опыт № 1. Получение аммиака из солей аммония.
Хлорид аммония и гашеную известь приблизительно в одинаковых количествах тщательно перемешивают в фарфоровой чашечке. Происходит ли образование аммиак в этих условиях? Полученную смесь высыпьте в сухую пробирку, которую закройте пробкой с газоотводной трубкой и закрепите в штативе, так, чтобы дно ее было немного выше отверстия (почему?). Смесь нагрейте. Как доказать, что выделился аммиак? Напишите уравнения реакции.
Опыт № 2. Растворение аммиака в воде.
Соберите, полученный аммиак в чистую пробирку. Пробирку, содержащую аммиак, закройте пробкой, погрузите ее в кристаллизатор и откройте пробку. Образуется фонтан. Испытайте полученный раствор индикаторной бумажкой. Небольшое количество полученного раствора нагрейте. Изменяется ли интенсивность запаха? Прокипятите раствор 2-3 минуты, испытайте его реакцию индикаторной бумажкой. Как изменилась окраска бумажки? Напишите уравнения реакции.
Опыт № 3. Взаимодействие аммиака с кислотами.
Налейте в пробирки по 1-2 мл концентрированных растворов соляной и азотной кислот. Газоотводную трубку последовательно введите в пробирки с кислотами. Конец газоотводной трубки должен находится на расстоянии 5-6 мм от поверхности кислот. Что вы наблюдаете? Как объяснить появление «белого дыма»? Напишите уравнения соответствующих реакций.
Опыт № 4. Свойства водного раствора аммиака.
В две пробирки налейте водный раствор аммиака. В одну из них испытайте индикатором. В другую пробирку добавьте несколько капель раствора фенолфталеина, а затем немного раствора соляной кислоты. Что происходит при действии на водный раствор аммиака кислотой? Напишите уравнения соответствующих реакций.
Опыт № 5. Взаимодействие с солями.
В пробирку с аммиаком добавьте раствор добавьте раствор хлорида железа (III). Что наблюдаете? Составьте уравнение реакции в ионном виде.
Вопросы для защиты работы
- Какие свойства проявляют соли аммония? Покажите на примере сульфата аммония. Запишите уравнения реакций в молекулярном и ионном виде.
- Осуществите превращение: NH 3 → NH 4 Cl → NH 4 NO 3 → NH 3
- Какой объем аммиак (н.у.) необходимо для получения сульфата аммония массой 26,4 г, если 20% аммиака теряется в ходе реакции?
- При взаимодействии 50 л аммиака с серной кислотой образовался сульфат аммония массой 126 г. Какой выход составляет эта масса от теоретически возможного?
Практическая работа № 2
Тема: Получение оксида углерода (IV) и изучение его свойств. Распознавание карбонатов.
Оборудование и реактивы: пробирки, пробиркодержатель, универсальная индикаторная бумага, пробка с газоотводной трубкой, соляная кислота, мел или мрамор, известковая вода, дистиллированная вода, лакмус, раствор гидроксида натрия, фенолфталеин, сульфат натрия, хлорид цинка, карбонат калия, хлорид или нитрат бария, нитрат серебра.
Опыт № 1. Получение и свойства оксида углерода (IV)
- Поместите в пробирку кусочек мрамора (мела) и налейте соляной кислоты. Наблюдайте выделения газа. Напишите уравнения реакции получения углекислого газа.
- Выделяющийся газ из пробирки пропустите в стаканчик с известковой водой. Что наблюдаете? Продолжайте пропускать газ после образования осадка? Какие изменения произошли? Напишите уравнения всех химических реакций в молекулярном и ионном виде.
- Конец газоотводной трубки выньте из раствора, сполосните и опустите в стаканчик с дистиллированной водой, подкрашенный лакмусом, и пропустите через нее газ. Что наблюдаете? Напишите уравнения реакции растворения углекислого газа в воде.
- В пробирку с гидроксидом натрия добавьте каплю фенолфталеина и пропустите СО 2 до исчезновения окраски. Объясните наблюдаемое явление, составьте молекулярные и ионные уравнения реакций.
Опыт 2. Распознавание карбонатов.
В трех пробирках даны кристаллические вещества: сульфат натрия, хлорид цинка, карбонат калия. Определите в какой пробирке какое вещество.
Вопросы для защиты работы
- Определите массу карбоната кальция.
- При действии избытка соляной кислоты на образец доломита MgCO 3 × CaCO 3 массой 50 г выделяется унлекислый газ объемом 11,7 л (н.у.) определите массовую долю примесей в данном образце.
- Допишите уравнения реакций:
K 2 O + SiO 2 → CaSiO 3 + HCl →
Ba(OH) 2 + СO 2 → KNO 3 + CO 2 →
Al 2 O 3 + CO 2 + H 2 O → Na 2 SiO 3 + HCl →
Практическая работа № 3
Тема: Решение экспериментальных задач по теме «Сера и ее соединения».
Реактивы и оборудование: набор пробирок, пробиркодержатель, растворы сульфид натрия, сульфат натрия, нитрат свинца (II), хлорид бария, серная кислота, сульфит натрия.
Задание: путем попарного сливания определить вещества в пронумерованных пробирках.
Перед выполнением работы, пользуясь таблицей растворимости, составьте молекулярные и ионные уравнения реакций и заполните опорную таблицу. В каждое пересечение строки и столбца занесите ожидаемый эффект реакции (выпадение осадка, выделение газа и т.д.), если видимых изменений в процессе реакции не происходит, то в таблице поставьте прочерк.
Дайте ответы на следующие вопросы в форме сложноподчинённых предложений с придаточным причины. При выполнении задания
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,296
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,211
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
http://nsportal.ru/shkola/khimiya/library/2019/11/15/laboratornyy-praktikum-po-himii-v-9-klasse
http://www.soloby.ru/784427/%D1%81%D0%BB%D0%B5%D0%B4%D1%83%D1%8E%D1%89%D0%B8%D0%B5-%D1%81%D0%BB%D0%BE%D0%B6%D0%BD%D0%BE%D0%BF%D0%BE%D0%B4%D1%87%D0%B8%D0%BD%D1%91%D0%BD%D0%BD%D1%8B%D1%85-%D0%BF%D1%80%D0%B5%D0%B4%D0%BB%D0%BE%D0%B6%D0%B5%D0%BD%D0%B8%D0%B9-%D0%BF%D1%80%D0%B8%D0%B4%D0%B0%D1%82%D0%BE%D1%87%D0%BD%D1%8B%D0%BC-%D0%B2%D1%8B%D0%BF%D0%BE%D0%BB%D0%BD%D0%B5%D0%BD%D0%B8%D0%B8