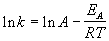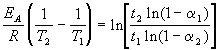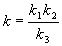Как определить энергию активации по уравнению
Из качественных соображений понятно, что скорость реакций должна увеличиваться с ростом температуры, т.к. при этом возрастает энергия сталкивающихся частиц и повышается вероятность того, что при столкновении произойдет химическое превращение. Для количественного описания температурных эффектов в химической кинетике используют два основных соотношения — правило Вант-Гоффа и уравнение Аррениуса.
Правило Вант-Гоффа заключается в том, что при нагревании на 10 о С скорость большинства химических реакций увеличивается в 2 
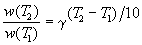
где 


Гораздо более точным является уравнение Аррениуса, описывающее температурную зависимость константы скорости:
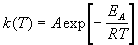
где R — универсальная газовая постоянная; A — предэкспоненциальный множитель, который не зависит от температуры, а определяется только видом реакции; EA — энергия активации, которую можно охарактеризовать как некоторую пороговую энергию: грубо говоря, если энергия сталкивающихся частиц меньше EA, то при столкновении реакция не произойдет, если энергия превышает EA, реакция произойдет. Энергия активации не зависит от температуры.
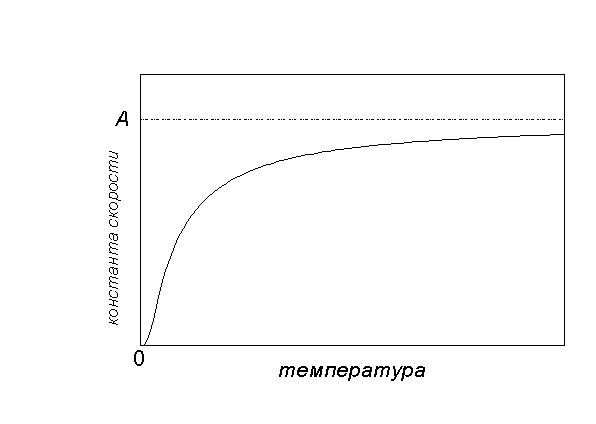
Графически зависимость k(T) выглядит следующим образом:
При низких температурах химические реакции почти не протекают: k(T) 

Энергию активации можно определить, измерив константу скорости при двух температурах. Из уравнения (4.2) следует:
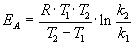
Более точно энергию активации определяют по значениям константы скорости при нескольких температурах. Для этого уравнение Аррениуса (4.2) записывают в логарифмической форме
и записывают экспериментальные данные в координатах ln k — 1/T. Тангенс угла наклона полученной прямой равен —EA / R.
Для некоторых реакций предэкспоненциальный множитель слабо зависит от температуры. В этом случае определяют так называемую опытную энергию активации:
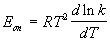
Если предэкспоненциальный множитель — постоянный, то опытная энергия активации равна аррениусовской энергии активации: Eоп = EA.
Пример 4-1. Пользуясь уравнением Аррениуса, оцените, при каких температурах и энергиях активации справедливо правило Вант-Гоффа.
Решение. Представим правило Вант-Гоффа (4.1) как степенную зависимость константы скорости:
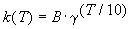
где B — постоянная величина. Сравним это выражение с уравнением Аррениуса (4.2), приняв для температурного коэффициента скорости значение
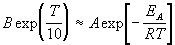
Возьмем натуральный логарифм обеих частей этого приближенного равенства:
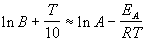
Продифференцировав полученное соотношение по температуре, найдем искомую связь связь между энергией активации и температурой:
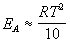
Если энергия активации и температура примерно удовлетворяют этому соотношению, то правилом Вант-Гоффа для оценки влияния температуры на скорость реакции пользоваться можно.
Пример 4-2. Реакция первого порядка при температуре 70 о С завершается на 40% за 60 мин. При какой температуре реакция завершится на 80% за 120 мин, если энергия активации равна 60 кДж/моль?
Решение. Для реакции первого порядка константа скорости выражается через степень превращения следующим образом:
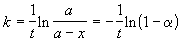
где a = x/a — степень превращения. Запишем это уравнение при двух температурах с учетом уравнения Аррениуса:
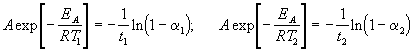
где EA = 60 кДж/моль, T1 = 343 K, t1 = 60 мин, a 1 = 0.4, t2 = 120 мин, a 2 = 0.8. Поделим одно уравнение на другое и прологарифмируем:
Подставляя в это выражение приведенные выше величины, находим T2 = 333 К = 60 о С.
Пример 4-3. Скорость бактериального гидролиза мышц рыб удваивается при переходе от температуры -1.1 о С к температуре +2.2 о С. Оцените энергию активации этой реакции.
Решение. Увеличение скорости гидролиза в 2 раза обусловлено увеличением константы скорости: k2 = 2k1. Энергию активации по отношению констант скорости при двух температурах можно определить из уравнения (4.3) с T1 = t1 + 273.15 = 272.05 K, T2 = t2 + 273.15 = 275.35 K:
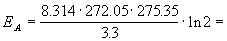
4-1. При помощи правила Вант-Гоффа вычислите, при какой температуре реакция закончится через 15 мин, если при 20 о С на это требуется 2 ч. Температурный коэффициент скорости равен 3.(ответ)
4-2. Время полураспада вещества при 323 К равно 100 мин, а при 353 К — 15 мин. Определите температурный коэффициент скорости.(ответ)
4-3. Какой должна быть энергия активации, чтобы скорость реакции увеличивалась в 3 раза при возрастании температуры на 10 0 С а) при 300 К; б) при 1000 К?(ответ)
4-4. Реакция первого порядка имеет энергию активации 25 ккал/моль и предэкспоненциальный множитель 5 . 10 13 сек -1 . При какой температуре время полураспада для данной реакции составит: а) 1 мин; б) 30 дней?(ответ)
4-5. В каком из двух случаев константа скорости реакции увеличивается в большее число раз: при нагревании от 0 о С до 10 о С или при нагревании от 10 о С до 20 о С? Ответ обоснуйте с помощью уравнения Аррениуса.(ответ)
4-6. Энергия активации некоторой реакции в 1.5 раза больше, чем энергия активации другой реакции. При нагревании от T1 до T2 константа скорости второй реакции увеличилась в a раз. Во сколько раз увеличилась константа скорости первой реакции при нагревании от T1 до T2?(ответ)
4-7. Константа скорости сложной реакции выражается через константы скорости элементарных стадий следующим образом:
Выразите энергию активации и предэкспоненциальный множитель сложной реакции через соответствующие величины, относящиеся к элементарным стадиям.(ответ)
4-8. В необратимой реакции 1-го порядка за 20 мин при 125 о С степень превращения исходного вещества составила 60%, а при 145 o C такая же степень превращения была достигнута за 5.5 мин. Найдите константы скорости и энергию активации данной реакции .(ответ)
4-9. Реакция 1-го порядка при температуре 25 о С завершается на 30% за 30 мин. При какой температуре реакция завершится на 60% за 40 мин, если энергия активации равна 30 кДж/моль?(ответ)
4-10. Реакция 1-го порядка при температуре 25 о С завершается на 70% за 15 мин. При какой температуре реакция завершится на 50% за 15 мин, если энергия активации равна 50 кДж/моль?(ответ)
4-11. Константа скорости реакции первого порядка равна 4.02 . 10 -4 с -1 при 393 К и 1.98 . 10 -3 с -1 при 413 К. Рассчитайте предэкспоненциальный множитель для этой реакции.(ответ)
4-12. Для реакции H2 + I2 
4-13. Для реакции 2N2O 
4-14. Трихлорацетат-ион в ионизирующих растворителях, содержащих H + , разлагается по уравнению
H + + CCl3COO — 
Стадией, определяющей скорость реакции, является мономолекулярный разрыв связи C- C в трихлорацетат-ионе. Реакция протекает по первому порядку, и константы скорости имеют следующие значения: k = 3.11 . 10 -4 с -1 при 90 о С, k = 7.62 . 10 -5 с -1 при 80 о С. Рассчитайте а) энергию активации, б) константу скорости при 60 о С.(ответ)
4-15. Для реакции CH3COOC2H5 + NaOH ѕ 
4-16. Для реакции C12H22O11 + H2O 
4-17. Вещество разлагается двумя параллельными путями с константами скорости k1 и k2. Какова разность энергий активации этих двух реакций, если при 10 o C k1/k2 = 10, а при 40 o C k1/k2 = 0.1?(ответ)
4-18. В двух реакциях одинакового порядка разница энергий активации составляет E2 — E1 = 40 кДж/моль. При температуре 293 К отношение констант скорости равно k1/k2 = 2. При какой температуре константы скорости сравняются?(ответ)
4-19. Разложение ацетондикарбоновой кислоты в водном растворе — реакция первого порядка. Измерены константы скорости этой реакции при разных температурах:
T, о С
k. 10 5 , с -1
Рассчитайте энергию активации и предэкспоненциальный множитель. Чему равен период полураспада при 25 о С? (ответ)


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Уравнение Аррениуса. Энергия активации химической реакции





Уравнение Аррениуса. Энергия активации химической реакции
- Уравнение Аррениуса. Энергия химической активации Вы. Формулы (V.19) и (V.20) являются только приблизительными Зависимости u = f (T) и k = f (T). Зависит от функции Константа скорости химической реакции k от температуры Обновлено шведским ученым С. Аррениусом (1889): * = (V. 2 1) Где А — предэкспоненциальный фактор. EA-acty energy.
- Реакция реакции; Т — абсолютная температура К. В химической кинетике часто используется уравнение Арре. Хорошая логарифмическая форма; в * = -E>, / RT + \ nA. (V.22) Из уравнения (V.22) зависимость постоянной равна Температура роста химической реакции встроена в кору Создайте чернила / T, линейные (рисунок V.3). Эта зависимость Энергию активации реакции Ea можно определить по тангенсу угла.
Наклон линии вдоль разреза и предэкспоненциальный множитель А Если ku, 1/7 = 0, обрезать вертикальную ось. Людмила Фирмаль
Исследование советских химиков (В. И. Гольданский и др.) Ультранизкая температура (ниже точки кипения азота -77 К) показала Закон Аррениуса для серии взаимодействий при очень низких температурах Остановите поведение, потому что 1 р / г зависит от 1 / т. Рис, v.u. Зависит от Химическая скорость Температура реакции Рига V.4. ^ Постоянная зависимость Скорость реакции от темпа Отклонение от Ирати: Аркениус (Рисунок V L) нелинейный.
Скорость таких реакций низкая Температура (Т ^ 10К) составляет Уравнение Аррениуса. Уравнение Аррениуса имеет две [величины; £ a и A Некоторые характеристики каждой реакции. Их фи Логический смысл получается по следующим причинам: Неплохо Предпосылки для инициирования химических взаимодействий между Две молекулы должны столкнуться.
Но не все Молекулярные столкновения заканчиваются действием химических взаимодействий Действия, то есть не все коллизии действительны. Также процент Как правило, общее количество эффективных столкновений Незначительный, большинство столкновений между молекулами Не вызывает реакции. Это можно легко проверить, рассчитав Возможное число на основе газовой кинетики.
Молекулярные столкновения и соответствующие скорости Сравните реакцию, затем ожидание (с расчетом 100% Эффективность) фактическая скорость; первое во мне Последние несколько раз. Аррениус предположил, что химический Действия выполняются только между этими конфликтами Молекулы, которые достигли определенной энергии.
Характерный уровень этой реакции, ее энергия Барьеры. Если такая молекула считается активной, эффект Столкновения происходят только между активами Pattern. Все молекулы в системе с низким накоплением энергии Энергетический барьер реакции находится в особом состоянии, Обычно это называется переходным состоянием или активным состоянием.
Комплекс, можно предположить, что система настроена Институт Активации комплекса характеризуется тем, что он в нем Уже нет исходного материала, но нет продукта реакции [1; Исходный материал передается продукту реакции. Принципиальная схема Переход лыж от исходных материалов A и B к продукту реакции C А через активированный комплекс А …
В состояние Иллюстрация льна. D.5 *. R. При взятии среднего уровня энергии исходной молекулы Вещество в системе равно £ |, а средняя энергия перехода Разность состояний E’-E \ представляет энергию Активация этой реакции, системная энергия (рисунок U.5) Переходное состояние максимально. Это значит Купальные сооружения очень нестабильны.
В процессе реакции он Расширяется до произведения взаимодействий C и O. На рассмотрении В этом примере средний уровень энергии молекул продукта реакции Е 2 ниже среднего уровня энергии исходной молекулы Вещество E . Это означает, что процесс будет продолжен с назначением Энергия (экзотермическая реакция). Средняя энергия молекул продукта реакции £ 2.
Может быть выше, чем средний энергетический уровень молекулы источника Детали E 1 (рисунок U.b). Процесс переходит к поглощению энергии. Гии (эндотермическая реакция) из окружающей среды. разница £ 2-¿ 1 равно тепловому эффекту процесса АЭ. Энергия активации является одним из основных параметров. ry характеризует скорость химического взаимодействия. стабилитрон Активация Процесс активации зависит от характера реакции Висячие.
- Чем выше энергия активации, тем меньше Равное условие) скорость реакции. Энергия активации Необходим в основном для ослабления химических связей Преодоление отталкивания с исходным материалом Электроны, генерируемые, когда молекулы и атомы объединяются Предотвращает взаимодействие веществ и их столкновения. Реакция между веществами, которые обычно имеют сильные ковалентные связи Облигации £ Медленно.
Это относится ко многим взаимодействиям Взаимодействие с органическим веществом Н2 + У2 0 2 = П20 и л и Н 2 + ЗЫ2 = 2НХ², скорость равна Стандартное условие практически нулевое. небольшой „„ И очень высокая скорость характеризуется ионами Взаимодействие в электролите (например: + 5 0 4 ’= $ 04 или Ag при * * + SG ‘= AgCl).
Это В связи с тем, что противоположно заряженные ионы притягиваются друг к другу. Людмила Фирмаль
Будьте друзьями и не нужно тратить энергию на преодоление силы Отталкивание взаимодействующих частиц. Простой расчет энергии активации химической реакции Согласно уравнению Аррениуса (U.22) значение известно Константы скорости k / -и k-1 при разных температурах: кг: I—, / I 1 (D.23) • nramot () и [) обрабатывают координаты реакции. Ход реакции. Axhibiro Bunny. С комплексом … LN 0 Координаты реакции Рис, д.5.
Диаметр энергии Граммы лихорадки Акии Координаты реакции Рисунок D.6. Диаметр энергии Грамм для эндотермы реакция Дает энергию активации нескольких химических реакций После: N20, -2N02, Hg + 12 ^ 2H1 C2H4 + I2 — CrNb, 2H1-Hg + b. C2H5Br ^ C2H4 + HBr. C H 4 C + 2H, Е д = 54,4 кДж / моль, £ = 165,5 кДж / моль, EV = 180,5 кДж / моль L ‘= 186,4 кДж / моль, £ = 218,0 кДж / мл £ = 334,7 кДж / моль, Обычно реакция ->! При 50 кДж / моль, Не протекать при комнатной температуре.
Замечательная энергия активации Это расстройство движения, Многие химические взаимодействия не остывают Рассмотрено с точки зрения химической термодинамики (DO •




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Энергия химической активации: из чего состоит, расчет
Энергия химической активации: из чего состоит, расчет — Наука
Содержание:
Вэнергия химической активации (с точки зрения кинетических исследований) означает минимально возможное количество энергии, необходимое для начала химической реакции. Согласно теории столкновений в химической кинетике, считается, что все движущиеся молекулы обладают определенной кинетической энергией.
Это означает, что чем больше скорость его движения, тем больше величина его кинетической энергии. В этом смысле молекула, которая совершает быстрое движение, не может быть разделена на фрагменты сама по себе, поэтому должно произойти столкновение между ней и другой молекулой, чтобы произошла химическая реакция.
Когда это происходит — когда происходит столкновение между молекулами — часть их кинетической энергии преобразуется в энергию колебаний. Аналогичным образом, если в начале процесса кинетическая энергия высока, молекулы, которые участвуют в столкновении, будут представлять такую сильную вибрацию, что некоторые из имеющихся химических связей будут разорваны.
Этот разрыв связей составляет первый шаг в превращении реагентов в продукты; то есть в их образовании. Напротив, если в начале этого процесса кинетическая энергия будет небольшой, произойдет явление «отскока» молекул, благодаря которому они разделятся практически целыми.
Из чего он состоит?
Исходя из концепции столкновений между молекулами для инициирования ранее описанных химических реакций, можно сказать, что для возникновения столкновения требуется минимальное количество энергии.
Таким образом, если значение энергии меньше этого необходимого минимума, просто не будет никаких изменений между молекулами после столкновения, а это означает, что, когда эта энергия отсутствует, участвующие частицы остаются практически нетронутыми, и этого не произойдет. любые изменения из-за этого сбоя.
В этом порядке идей минимальная энергия, необходимая для того, чтобы изменение произошло после столкновения между молекулами, называется энергией активации.
Другими словами, молекулы, участвующие в столкновении, должны иметь общую кинетическую энергию, равную или превышающую энергию активации, чтобы произошла химическая реакция.
Точно так же во многих случаях молекулы сталкиваются и порождают новый вид, называемый активированным комплексом, структуру, которую также называют «переходным состоянием», потому что она существует только временно.
Это вызвано реагентами из-за столкновения и до образования продуктов реакции.
Активированный комплекс
Вышеупомянутый активированный комплекс образует разновидность, которая имеет очень низкую стабильность, но, в свою очередь, имеет большую величину потенциальной энергии.
На следующей диаграмме показано превращение реагентов в продукты, выраженное в единицах энергии, с учетом того, что величина энергии образованного активированного комплекса значительно больше, чем у реагентов и продуктов.
Если в конце реакции продукты обладают большей стабильностью, чем реагирующие вещества, высвобождение энергии происходит в виде тепла, вызывая экзотермическую реакцию.
Напротив, если реагенты приводят к большей стабильности, чем продукты, это означает, что реакционная смесь проявляет поглощение энергии в виде тепла из окружающей среды, что приводит к эндотермической реакции.
Точно так же, если случается тот или иной случай, следует построить диаграмму, подобную показанной ранее, на которой отображается потенциальная энергия системы, которая реагирует против продвижения или прогресса реакции.
Таким образом, получаются изменения потенциальной энергии, которые происходят по мере протекания реакции и превращения реагентов в продукты.
Как рассчитывается?
Энергия активации химической реакции тесно связана с константой скорости указанной реакции, и зависимость этой константы от температуры представлена уравнением Аррениуса:
В этом выражении k представляет собой константу скорости реакции (которая зависит от температуры) и параметр К это называется частотным фактором, и это мера частоты столкновений между молекулами.
В свою очередь,а также выражает основание ряда натуральных логарифмов. Он возведен в степень, равную отрицательному отношению энергии активации (Ea) между произведением газовой постоянной (р) и абсолютной температуры (Т) рассматриваемой системы.
Следует отметить, что частотный фактор можно рассматривать как постоянный в некоторых реакционных системах в широком диапазоне температур.
Это математическое выражение было первоначально предложено голландским химиком Якобусом Хенрикусом вант Хоффом в 1884 году, но тем, кто придал ему научную ценность и интерпретировал его предпосылку, был шведский химик Сванте Аррениус в 1889 году.
Расчет энергии активации химической реакции
Уравнение Аррениуса определяет прямую пропорциональность, которая существует между константой скорости реакции и частотой столкновений между молекулами.
Точно так же это уравнение можно представить более удобным способом, применив свойство натурального логарифма к каждой стороне уравнения, получив:
ln k = ln A — Ea / RT
Когда члены переставляют, чтобы получить уравнение прямой (y = mx + b), получается следующее выражение:
ln k = (- Ea / R) (1 / T) + ln A
Итак, при построении графика зависимости ln k от 1 / T получается прямая линия, где ln k представляет собой координату, а (-Ea / R) представляет собой наклон линии (m), (1 / T) представляет координату x, а ln A представляет точку пересечения с осью ординат (b).
Как видно, крутизна, полученная в результате этого расчета, равна значению –Ea / R. Это означает, что если вы хотите получить значение энергии активации с помощью этого выражения, вы должны выполнить простое уточнение, в результате чего:
Здесь значение m известно, а R — постоянная величина, равная 8,314 Дж / К · моль.
Как энергия активации влияет на скорость реакции?
При попытке получить картину энергии активации ее можно рассматривать как барьер, который не позволяет реакции происходить между молекулами с более низкой энергией.
Как и в обычной реакции, количество молекул, которые могут реагировать, довольно велико, скорость — и, что эквивалентно, кинетическая энергия этих молекул — может быть очень переменной.
Обычно бывает, что только небольшое количество всех молекул, которые испытывают столкновение — те, которые имеют большую скорость движения — имеют достаточно кинетической энергии, чтобы быть в состоянии превысить величину энергии активации. Итак, эти молекулы подходят и могут участвовать в реакции.
Согласно уравнению Аррениуса, отрицательный знак, предшествующий частному между энергией активации и произведением газовой постоянной и абсолютной температуры, означает, что константа скорости уменьшается по мере увеличения энергии активации, а также рост при повышении температуры.
Примеры расчета энергии активации
Для расчета энергии активации путем построения графика в соответствии с уравнением Аррениуса константы скорости реакции разложения ацетальдегида были измерены при пяти различных температурах, и желательно определить энергию активации для реакции, которая выражается как:
Данные для пяти измерений следующие:
к (1 / М 1/2 S): 0,011 — 0,035 — 0,105 — 0,343 — 0,789
Т (К): 700 — 730 — 760 — 790 — 810
Прежде всего, чтобы решить эту неизвестную и определить энергию активации, необходимо построить график ln k vs 1 / T (y vs x), чтобы получить прямую линию и отсюда взять наклон и найти значение Ea, как объяснено.
Преобразуя данные измерений, согласно уравнению Аррениуса [ln k = (- Ea / R) (1 / T) + ln A], находятся следующие значения для y и x соответственно:
ln k: (-4,51) — (-3,35) — (-2,254) — (-1,070) — (-0,237)
1 / Т (К -1 ): 1,43*10 -3 – 1,37*10 -3 – 1,32*10 -3 – 1,27*10 -3 – 1,23*10 -3
Из этих значений и с помощью математического расчета наклона — либо в компьютере, либо в калькуляторе, с помощью выражения m = (Y2-Y1) / (ИКС2-ИКС1) или методом линейной регрессии — получаем m = -Ea / R = -2,09 * 10 4 К. Таким образом:
Ea = (8,314 Дж / К моль) (2,09 * 10 4 K)
= 1,74*10 5 = 1,74*10 2 кДж / моль
Для определения других энергий активации графически выполняется аналогичная процедура.
Ссылки
- Википедия. (н.д.). Энергия активации. Восстановлено с en.wikipedia.org
- Чанг, Р. (2007). Химия, Девятое издание. Мексика: Макгроу-Хилл.
- Britannica, E. (s.f.). Энергия активации. Получено с britannica.com
- Мур, Дж. У. и Пирсон, Р. Г. (1961). Кинетика и механизм. Восстановлено с books.google.co.ve
- Кэше, Х. (2003). Коррозия металлов: физико-химические основы и современные проблемы. Получено с books.google.co.ve
Ganoderma lucidum: характеристики, среда обитания и польза
Почему я боюсь и ничего не решаюсь сделать?
http://lfirmal.com/uravnenie-arreniusa-energiya-aktivacii-himicheskoj-reakcii/
http://ru1.warbletoncouncil.org/energia-activacion-quimica-15325