Химия. Как определить в продуктах реакции газ.
как определить газ. Осадок это когда на пересечение стоит НЕ РАСТВОРЯЕТСЯ. А вот газ? Ведь уравнение будет проходить если образуется газ или осадок. Вот осадок я знаю как определить. А вот как газ?
Нужно выучить основные газы . и смотреть, когда они получаются в реакции
Таблица растворимости показывает какие вещества могут растворятся у воде а какие нет. Реакция идёт с выделением 1 воды. 2 выделяется осадок. 3 выделяется газ. Там у таблице растворимости есть сероводород он растворяется у воде но если его много то он выйдет у виде газа. Смотрите какое вещество получается и узнайте его свойства это может быть жидкая кислота или газ или другое соединение. Газообразные вещества там не указаны. Пример из амиаком да он газ но растворимый у воде надо большие концентрации реагентов чтобы реакция (забулькала) . Также слабая угольная кислота она растворима у воде но большая её часть сразу же распадается на воду и газ получаем много (бульканья, или вспенивание) как гашение уксуса карбонатом натрия.
появление запаха, дыма, пузыпения или вспенивания (закипания)
Как решать химические уравнения — схемы и примеры решения для разных реакций
Основные термины и понятия
Составление уравнений химических реакций невозможно без знания определённых обозначений, показывающих, как проходит реакция. Объединение атомов, имеющих одинаковый ядерный заряд, называют химическим элементом. Ядро атома состоит из протонов и нейтронов. Первые совпадают с числом атомного номера элемента, а значение вторых может варьироваться. Простейшими веществами называют элементы, состоящие из однотипных атомов.
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
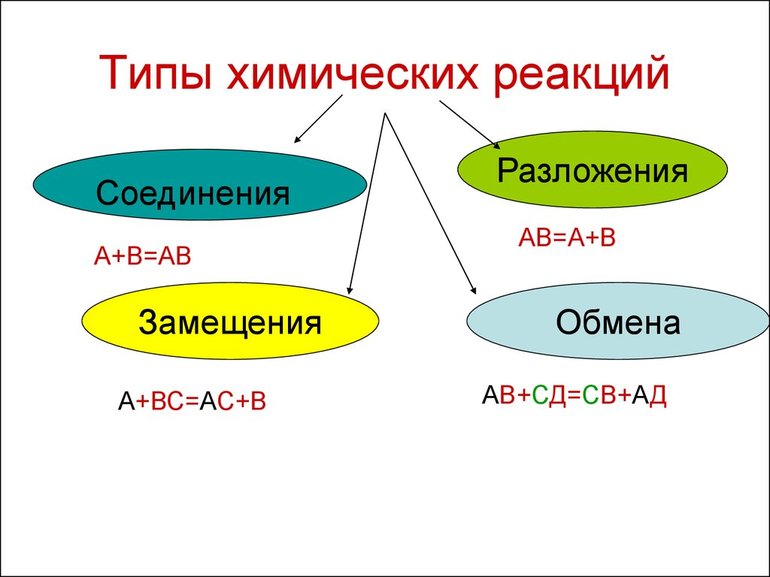
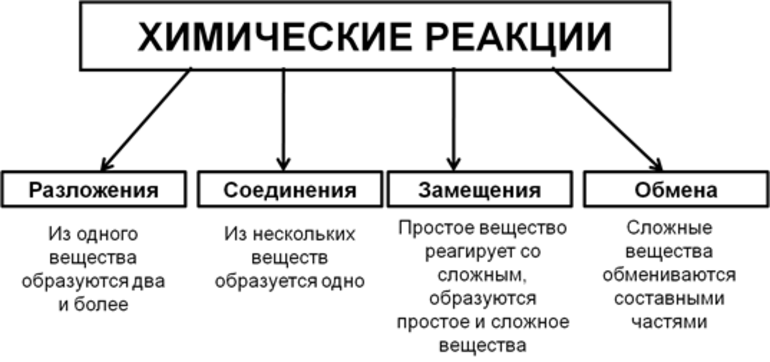
Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
Всего существует 4 типа химического взаимодействия веществ:
- Соединение. В реакцию могут вступать 2 простых вещества: металл и неметалл или неметалл и неметалл. Например, алюминий с серой образуют сульфид алюминия. Кислород, взаимодействуя с водородом, превращается в воду. Объединятся могут 2 оксида с растворимым основанием, как оксид кальция с водой: CaO + H2O = Ca (OH)2 или основной оксид с кислотным: CaO + SO3 = CaSO4.
- Разложение. Это процесс обратный реакции соединения: было одно вещество, а стало несколько. Например, при пропускании электрического тока через воду получается водород и кислород, а при нагревании известняка 2 оксида: CaCO3 = CaO + CO2.
- Замещение. В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + H2. Величину активности можно узнать из таблицы ряда электрохимических напряжений.
- Обмен. В этом случае между собой реагируют 2 сложных элемента, обменивающиеся своими составными частями. Условием осуществления такого типа реакции является обязательное образование воды, газа или осадка. Например, CuO + 2HCl = CuCl2 + H2O. Чтобы узнать, смогут ли вещества прореагировать, используют таблицу растворимости.
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Окислительно-восстановительный процесс
Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
- Написания формул элементов, вступающих в реакцию с левой стороны.
- Указания справа формулы образующихся веществ.
- Уравнивания числа атомов с добавлением коэффициентов.
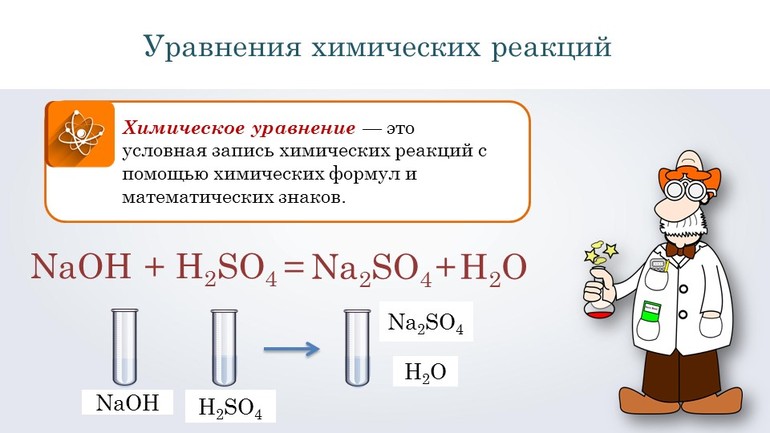
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.
Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + H2SO 4 → Na 2SO4 + H2O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + H2SO 4 → Na2 SO4 +2H2O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + H2O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + H2O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле NH3 валентность атома азота равна 3, а водорода 1.
Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:
- Определить продукты реакции. Так как кислота является сильным окислителем, сера получит максимальную степень оксидации S6+, а железо Fe3+. HNO3 может восстановиться до одного из двух состояний NO2 или NO.
- Исходя из состава ионов и правила, что вещества, переходящие в газовую форму или плохо растворимые, записываются в молекулярном виде, верным будет записать: FeS2 — Fe3+ + 2SO2−4. Гидролизом можно пренебречь.
- В записи уравнивают кислород. Для этого в левую часть добавляют 8 молекул воды, а в правую 16 ионов водорода: FeS2 + 8H20 — Fe3+ + 2SO2−4 + 16H+. Так как заряда в левой части нет, а в правой он равный +15, то серное железо должно будет отдать 15 электронов. Значит, уравнение примет вид: FeS2 + 8H20 — 15e → Fe3+ + 2SO2−4 + 16H+.
- Теперь переходят к реакции восстановления нитрата иона: NO-3 →NO. Для её составления нужно отнять у оксида азота 2 атома кислорода. Делают это путём прибавления к левой части 4 ионов водорода, а правой — 2 молекул воды. В итоге получится: NO-3 + 4H+ → NO + 2H2O.
- Полученную формулу уравнивают добавлением к левой части 3 электронов: NO-3 + 4H+ 3e → NO + 2H2O.
- Объединяют найденные выражения и записывают результат: FeS2 + 8H20 + 5NO-3 + 20H+ → Fe3+ + 2SO2−4 + 16H+ + 5NO + 10H2O.
Уравнение можно сократить на 16H + и 8H2O. В итоге получится сокращённое выражение окислительно-восстановительной реакции: FeS2 + 5NO — 3 + 4 H + = Fe3 + + 2SO 2- 4 + 5NO + 2H2O.
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Использование онлайн-расчёта
Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
зМБЧБ 1. пУОПЧОЩЕ ЪБЛПОЩ ИЙНЙЙ

1.2 зБЪПЧЩЕ ЪБЛПОЩ ИЙНЙЙ
1.2.1 ъБЛПО бЧПЗБДТП Й УМЕДУФЧЙЕ ЙЪ ОЕЗП
уТЕДЙ ЧЕЭЕУФЧ У ТБЪМЙЮОЩН БЗТЕЗБФОЩН УПУФПСОЙЕН ОЕПВИПДЙНП ЧЩДЕМЙФШ ЗБЪЩ, ЛПФПТЩЕ ЙЗТБАФ ПЗТПНОХА ТПМШ ОЕ ФПМШЛП Ч ОБЫЕК ЦЙЪОЙ, ОП Ч ТБЪМЙЮОЩИ ФЕИОПМПЗЙЮЕУЛЙИ РТПГЕУУБИ. оЕПВИПДЙНП РПНОЙФШ, ЮФП ДМС ЛПМЙЮЕУФЧЕООПК ИБТБЛФЕТЙУФЙЛЙ МАВПЗП ЗБЪБ ЙУРПМШЪХАФ ДБЧМЕОЙЕ, ФЕНРЕТБФХТХ Й ЪБОЙНБЕНЩК ПВЯЕН. оБЙВПМЕЕ ЮБУФП РТЙНЕОСАФ ФБЛ ОБЪЩЧБЕНЩЕ ОПТНБМШОЩЕ ХУМПЧЙС (О.Х.), ЛПФПТЩЕ УППФЧЕФУФЧХАФ ДБЧМЕОЙА т=10 5 рБ Й ФЕНРЕТБФХТЕ ф=273 л.
уПЗМБУОП ЪБЛПОХ бЧПЗБДТП: ПДЙОБЛПЧЩЕ ПВЯЕНЩ ТБЪМЙЮОЩИ ЗБЪПЧ РТЙ ПДЙОБЛПЧЩИ ХУМПЧЙСИ (ДБЧМЕОЙЙ Й ФЕНРЕТБФХТЕ) УПДЕТЦБФ ПДЙОБЛПЧПЕ ЮЙУМП НПМЕЛХМ.
вПМШЫПЕ РТБЛФЙЮЕУЛПЕ ЪОБЮЕОЙЕ ЙНЕЕФ УМЕДУФЧЙЕ ЙЪ ЪБЛПОБ бЧПЗБДТП: РТЙ ОПТНБМШОЩИ ХУМПЧЙСИ (О.Х.) ПДЙО НПМШ МАВПЗП ЗБЪБ ЪБОЙНБЕФ ПВЯЕН, ТБЧОЩК 22,4 М.
пВЯЕН 22,4 М ОБЪЩЧБАФ НПМСТОЩН (НПМШОЩН) ПВЯЕНПН ЗБЪБ Й ПВПЪОБЮБАФ УППФЧЕФУФЧЕООП VM = 22,4 М/НПМШ.
рТЙНЕТ: ХЗМЕЛЙУМЩК ЗБЪ CO2. йНЕЕН н(CO2) = 44 З/НПМШ. ъОБЮЙФ, ПДЙО НПМШ CO2 ЙНЕЕФ НБУУХ 44 З Й ЪБОЙНБЕФ ПВЯЕН (РТЙ О.Х.), ТБЧОЩК 22,4 М, Б ФБЛЦЕ УПДЕТЦЙФ Ч ЬФПН ПВЯЕНЕ 6,02·10 23 НПМЕЛХМ ЗБЪБ.
оЕФТХДОП РПЛБЪБФШ, ЮФП УЧСЪШ НЕЦДХ НБУУПК m Й ПВЯЕНПН V ЛПОЛТЕФОПЗП ЗБЪБ РТЙ О.Х. ПРТЕДЕМСЕФУС ЖПТНХМПК:
 | (1.3) |
еУМЙ ХУМПЧЙС, Ч ЛПФПТЩИ ОБИПДЙФУС ЗБЪ ПФМЙЮБЕФУС ПФ ОПТНБМШОЩИ, ФП ЙУРПМШЪХАФ ХТБЧОЕОЙЕ нЕОДЕМЕЕЧБ-лМБРЕКТПОБ, ЛПФПТПЕ УЧСЪЩЧБЕФ ЧУЕ ПУОПЧОЩЕ РБТБНЕФТЩ ЙДЕБМШОПЗП ЗБЪБ:
 | (1.4) |
ЗДЕ: P — ДБЧМЕОЙЕ ЗБЪБ, рБ;
V — ПВЯЕН ЗБЪБ, Н 3 ;
m — НБУУБ ЗБЪБ, З;
M — НПМШОБС НБУУБ ЗБЪБ, З/НПМШ;
R — ХОЙЧЕТУБМШОБС ЗБЪПЧБС РПУФПСООБС, R = 8,31 дЦ/(НПМШ·л);
T — ФЕНРЕТБФХТБ ЗБЪБ, л.
1.2.2 ъБЛПО дБМШФПОБ
еУМЙ НЩ ЧЕТОЕНУС Л ХТБЧОЕОЙА ИЙНЙЮЕУЛПК ТЕБЛГЙЙ, ТБУУНБФТЙЧБЕНПК Ч ТБЪДЕМЕ 1.1.1, ФП, У ХЮЕФПН НПМСТОЩИ ПВЯЕНПЧ ЗБЪПЧ, ЕЗП НПЦОП РТЕДУФБЧЙФШ Ч УМЕДХАЭЕН ЧЙДЕ
йЪ РТЙЧЕДЕООПЗП РТЙНЕТБ ЧЙДОП, ЮФП НБУУЩ ЗБЪПЧ ЪБНЕОЕОЩ ОБ НПМШОЩЕ ПВЯЕНЩ. пФУАДБ УМЕДХЕФ ЖПТНХМЙТПЧЛБ ЪБЛПОБ дБМШФПОБ: ПВЯЕНЩ ТЕБЗЙТХАЭЙИ ЗБЪПЧ Й РТПДХЛФПЧ ЙИ ТЕБЛГЙК ПФОПУСФУС ДТХЗ Л ДТХЗХ ЛБЛ ОЕВПМШЫЙЕ ГЕМЩЕ ЮЙУМБ (ЛПЬЖЖЙГЙЕОФЩ ХТБЧОЕОЙС ТЕБЛГЙЙ).
1.2.3 ъБЛПО РБТГЙБМШОЩИ ДБЧМЕОЙК
оБ РТБЛФЙЛЕ ЮБУФП РТЙИПДЙФУС ЧУФТЕЮБФШУС УП УНЕУША ТБЪМЙЮОЩИ ЗБЪПЧ (ОБРТЙНЕТ, ЧПЪДХИ), ч ЬФПН УМХЮБЕ ОЕПВИПДЙНП РТЙНЕОСФШ ЧЩЫЕТБУУНПФТЕООЩЕ ЗБЪПЧЩЕ ЪБЛПОЩ ДМС ЛБЦДПЗП ЗБЪБ Ч ПФДЕМШОПУФЙ Й ЪБФЕН УХННЙТПЧБФШ РПМХЮЕООЩЕ ЧЕМЙЮЙОЩ. рТЙ ЬФПН РПМШЪХАФУС ФБЛЦЕ ЪБЛПОПН РБТГЙБМШОЩИ ДБЧМЕОЙК: ПВЭЕЕ ДБЧМЕОЙЕ ЗБЪПЧПК УНЕУЙ ТБЧОП УХННЕ РБТГЙБМШОЩИ ДБЧМЕОЙК ПФДЕМШОЩИ ЗБЪПЧ, УПУФБЧМСАЭЙИ ДБООХА УНЕУШ, ФП ЕУФШ
| тПВЭ = т1 + т2 + .. + тР | (1.5) |
йЪ ЖПТНХМЙТПЧЛЙ ЪБЛПОБ УМЕДХЕФ, ЮФП РБТГЙБМШОПЕ ДБЧМЕОЙЕ РТЕДУФБЧМСЕФ УПВПК ЮБУФЙЮОПЕ ДБЧМЕОЙЕ, УПЪДБЧБЕНПЕ ПФДЕМШОЩН ЗБЪПН. й ДЕКУФЧЙФЕМШОП, РБТГЙБМШОПЕ ДБЧМЕОЙЕ — ЬФП ФБЛПЕ ДБЧМЕОЙЕ, ЛПФПТПЕ ВЩ УПЪДБЧБМ ДБООЩК ЗБЪ, ЕУМЙ ВЩ ПО ПДЙО ЪБОЙНБМ ЧЕУШ ПВЯЕН.
рТЙНЕТ: ПРТЕДЕМЙФШ ДБЧМЕОЙЕ ЗБЪПЧПК УНЕУЙ, ЕУМЙ Ч ПВЯЕНЕ 11,2 М РТЙ О.Х. УПДЕТЦЙФУС 4 З о2, 14 З уп Й 56 З N2 .
пРТЕДЕМЙН У РПНПЭША ХТБЧОЕОЙС нЕОДЕМЕЕЧБ-лМБРЕКТПОБ РБТГЙБМШОЩЕ ДБЧМЕОЙС ЛБЦДПЗП ЙЪ ЗБЪПЧ, УПУФБЧМСАЭЙИ ДБООХА ЗБЪПЧХА УНЕУШ:
т(о2) = (m/M)RT/V = (4З/2З/НПМШ)·8,31·273л/0,0112Н Ъ = 4·105 рБ,
т(уп) = (14З/28З/НПМШ)·8,31·273л/0,0112Н Ъ = 10 5 рБ,
т(N2) = (56З/28З/НПМШ)·8,31·273л/0,0112Н Ъ = 4·10 5 рБ.
пВЭЕЕ ДБЧМЕОЙЕ ЗБЪПЧПК УНЕУЙ ТБЧОП:
чЕМЙЮЙОБ РБТГЙБМШОПЗП ДБЧМЕОЙС ПРТЕДЕМСЕФУС ОЕУЛПМШЛЙНЙ УРПУПВБНЙ, ОП ОБЙВПМЕЕ ЮБУФП ЧУФТЕЮБАЭЙКУС РТБЛФЙЮЕУЛЙ УРПУПВ ПУОПЧБО ОБ ЙУРПМШЪПЧБОЙЙ ЖПТНХМЩ
 | (1.6) |
ЗДЕ б — УПДЕТЦБОЙЕ ДБООПЗП ЗБЪБ Ч ЗБЪПЧПК УНЕУЙ Ч ПВЯЕНОЩИ %.
рТЙНЕТ: ПРТЕДЕМЙФШ НБУУХ ЛЙУМПТПДБ п2, УПДЕТЦБЭЕЗПУС Ч 1 Н Ъ ЧПЪДХИБ РТЙ ОПТНБМШОЩИ ХУМПЧЙСИ, ЕУМЙ РТПГЕОФОПЕ УПДЕТЦБОЙЕ ЛЙУМПТПДБ Ч ЧПЪДХИЕ УПУФБЧМСЕФ 21ПВ.%
рБТГЙБМШОПЕ ДБЧМЕОЙЕ п2 Ч ЧПЪДХИЕ ПРТЕДЕМСЕН РП ЖПТНХМЕ
т(п2) = 10 5 рБ·21%/100% = 0,21·10 5 рБ
пФУАДБ, УПЗМБУОП ХТБЧОЕОЙС нЕОДЕМЕЕЧБ-лМБРЕКТПОБ
m(O2) = PVM/RT = (0,21·10 5 рБ·1Н Ъ ·32З/НПМШ)/8,31·273л = 297 З
тБУУНПФТЙН ЧПЪНПЦОПУФШ ХЮЕФБ ЙЪНЕОЕОЙС ПВЯЕНБ ЙМЙ ДБЧМЕОЙС РТЙ РТПФЕЛБОЙЙ ИЙНЙЮЕУЛПК ТЕБЛГЙЙ, Ч ЛПФПТПК ХЮБУФЧХАФ ЙМЙ ПВТБЪХАФУС ЗБЪППВТБЪОЩЕ РТПДХЛФЩ. дМС ХЮЕФБ ЬФПЗП ОЕПВИПДЙНП ЧУРПНОЙФШ, ЮФП ЛПЬЖЖЙГЙЕОФЩ Ч ХТБЧОЕОЙЙ ИЙНЙЮЕУЛПК ТЕБЛГЙЙ РТСНП РТПРПТГЙПОБМШОЩ ЮЙУМХ НПМЕК ТЕБЗЙТХАЭЙИ Й ПВТБЪХАЭЙИУС ЧЕЭЕУФЧ. рТЙНЕОЙФЕМШОП Л ЗБЪБН ОЕПВИПДЙНП ХЮЕУФШ ФБЛЦЕ, ЮФП:
фБЛЙН ПВТБЪПН, УТБЧОЙЧБС ЛПЬЖЖЙГЙЕОФЩ ЙУИПДОЩИ ЧЕЭЕУФЧ Й РТПДХЛФПЧ ТЕБЛГЙЙ, НПЦОП УДЕМБФШ ЧЩЧПД ПВ ЙЪНЕОЕОЙЙ ПВЯЕНБ (ДБЧМЕОЙС) Ч ИПДЕ ИЙНЙЮЕУЛПК ТЕБЛГЙЙ.
оБРТЙНЕТ, Ч ИЙНЙЮЕУЛПК ТЕБЛГЙЙ
ЧУЕ ЧЕЭЕУФЧБ СЧМСАФУС ЗБЪБНЙ, чЙДОП, ЮФП ДП ТЕБЛГЙЙ ЙНЕМПУШ 3 НПМС ЗБЪБ (2 НПМС уп Й 1 НПМШ п2), Б РПУМЕ ТЕБЛГЙЙ ПУФБМПУШ 2 НПМС уп2. сУОП, ЮФП ПВЯЕН 3 НПМЕК ЗБЪБ (22,4·3=67,2М) ВПМШЫЕ ПВЯЕНБ 2 НПМЕК (22,4·2=44,8М), ФП ЕУФШ VОБЮ> VЛПО. ъОБЮЙФ, ДБООБС ТЕБЛГЙС РТПФЕЛБЕФ МЙВП У ХНЕОШЫЕОЙЕН ПВЯЕНБ (ЙЪПВБТОЩК РТПГЕУУ), МЙВП У ХНЕОШЫЕОЙЕ ДБЧМЕОЙС (ЙЪПИПТОЩК РТПГЕУУ).
ч УМХЮБЕ ИЙНЙЮЕУЛПК ТЕБЛГЙЙ
ЙНЕЕН ЗБЪППВТБЪОЩЕ ЧЕЭЕУФЧБ уп2 Й уп Й ФЧЕТДПЕ ЧЕЭЕУФЧП у. уТБЧОЙЧБЕН ЛПЬЖЖЙГЙЕОФЩ ФПМШЛП ДМС ЗБЪППВТБЪОЩИ ЧЕЭЕУФЧ Й ЙНЕЕН ДМС ЙУИПДОЩИ ЧЕЭЕУФЧ 1 Й ЛПОЕЮОЩИ ЧЕЭЕУФЧ 2. фБЛ ЛБЛ 1 

http://nauka.club/khimiya/khimicheskie-uravneniya.html
http://cde.osu.ru/demoversion/course93/g1_2.html