Гидролиз
Гидролиз (греч. hydor — вода и lysis — разрушение) — процесс расщепления молекул сложных химических веществ за счет реакции с молекулами воды.
В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз (вода) разрушает «слабое» — это правило вам очень пригодится.
Любая соль состоит из остатка основания и кислоты. Абсолютно любая:
- NaCl — производное основания NaOH и кислоты HCl
- KNO3 — производное основания KOH и кислоты HNO3
- CuSO4 — производное основания Cu(OH)2 и кислоты H2SO4
- Al3PO4 — производное основания Al(OH)3 и кислоты H3PO4
- Ca(NO2)2 — производное основания Ca(OH)2 и кислоты HNO2
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются слабыми, а какие — сильными.
При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести нужный опыт — она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем интеллектуальном составляющем 😉
По катиону, по аниону или нет гидролиза?
Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты — гидролиза не происходит. Примеры: NaCl, KBr, CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4, FeSO3, CaSO3.
Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз разрушает слабое, в данном случае — катион. Примеры: AlCl3, MgBr2, Cr2SO4, NH4NO3.
Катион NH4 + и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2 не происходит.
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4, NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4.
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора.
Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда раствора — нейтральная.
Если гидролиз идет по катиону (разрушается остаток основания) среда — кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда раствора будет щелочная. Изучите примеры.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.
Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.
С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH 7.
Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl3 — кислой (pH
Cреда водных растворов веществ. Индикаторы
Материалы портала onx.distant.ru
Определение характера среды водных растворов веществ. Индикаторы.
Среда водных растворов
Вода и водные растворы окружают нас повсюду. В воде и в водных растворах присутствуют ионы Н + и ОН — . Избыток или недостаток этих ионов определяет среду раствора.
В нейтральном растворе количество ионов водорода Н + равно количеству гидроксид-ионов ОН – .
[ Н + ] = [ ОН – ]
Если количество ионов водорода Н + больше количества гидроксид-ионов ОН – , то среда раствора кислая:
[ Н + ] > [ ОН – ]
Если количество ионов водорода Н + меньше количества гидроксид-ионов ОН – , то среда раствора щелочная:
[ Н + ] ОН – ]
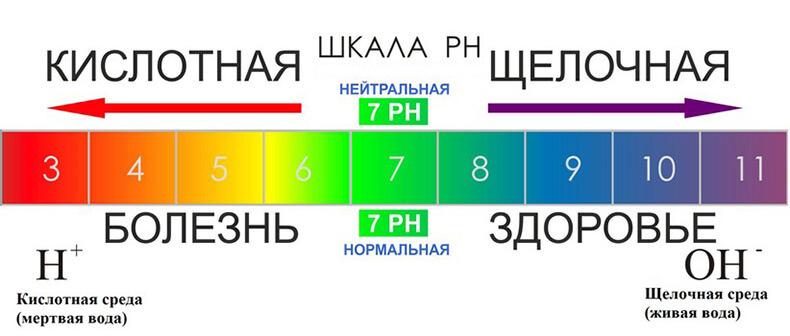
Для характеристики кислотности среды используют водородный показатель рН. Он определяется, как отрицательный десятичный логарифм концентрации ионов водорода. В нейтральной среде рН равен 7, в кислой — меньше 7, в щелочной — больше 7.
| Кислая среда | Нейтральная среда | Щелочная среда |
| [Н + ] > [ОН – ] | [Н + ] = [ОН – ] | [Н + ] – ] |
| pH | pH = 7 | pH > 7 |
Индикаторы
Для определения среды раствора используют специальные вещества, которые изменяют цвет в зависимости от среды раствора: индикаторы. В зависимости от среды эти вещества могут переходить в разные формы с различной окраской.
Чаще всего используют следующие индикаторы: лакмус, метилоранж, фенолфталеин.
Окраска индикаторов в различных средах:
| Индикатор/среда | Кислая | Нейтральная | Щелочная |
| Лакмус | Красный | Фиолетовый | Синий |
| Метилоранж | Красный | Оранжевый | Желтый |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
Растворы кислот и оснований
Характер среды определяется процессами, которые происходят с веществами в растворе. Кислот, основания и соли в воде диссоциируют на ионы. Кислоты диссоциируют на катионы водорода H + и анионы кислотных остатков:
HA = H + + A –
При этом в растворе возникает избыток катионов водорода Н + , поэтому среда водных растворов кислот — кислая (что вполне логично).
Сильные кислоты диссоциируют в разбавленных растворах практически полностью, поэтому среда разбавленных растворов сильных кислот, как правило, сильно кислотная. Некоторые кислоты (слабые) диссоциируют частично, поэтому среда водных растворов слабых кислот — слабо кислая.
Основания диссоциируют на катионы металлов и гидроксид-анионы ОН – :
МеОH = Ме + + ОН –
При этом в растворе возникает избыток катионов гидроксид-анионов ОН – , поэтому среда водных растворов оснований — щелочная. Сильные основания (щелочи) хорошо растворимы в воде, поэтому среда их водных растворов — сильно щелочная. Нерастворимые основания в воде практически не растворяются, поэтому в водном растворе оказывается лишь небольшое количество ионов ОН – . Среда водного раствора аммиака слабо щелочная.
Растворы солей
Среда водных растворов солей определяется не только диссоциацией, но и особенностями взаимодействия катионов металлов и анионов кислотных остатков с водой — гидролизом солей .
Попадая в воду, соли диссоциируют на катионы металлов (или ион аммония NH4 + ) и анионы кислотных остатков.
Катионы металлов, которым соответствуют слабые основания, притягивают из воды ионы ОН – , при этом в воде образуются избыточные катионы водорода Н + . Протекает гидролиз по катиону. Катионы металлов, которым соответствуют сильные основания, с водой таким образом не взаимодействуют.
Например , катионы Fe 3+ подвергаются гидролизу:
Fe 3+ + HOH ↔ FeOH 2+ + H +
Анионы кислотных остатков, которым соответствуют слабые кислоты, притягивают из воды катионы Н + , при этом в воде остаются гидроксид-анионы ОН – . Протекает гидролиз по аниону. Анионы кислотных остатков сильных кислот таким образом с водой не взаимодействуют.
Например , ацетат-ионы (остаток уксусной кислоты CH3COOH) подвергаются гидролизу:
CH3COO — + HOH ↔ CH3COOH + OH —
В зависимости от состава соли водные растворы солей могут иметь кислую, нейтральную или щелочную среду.
Типы гидролиза солей в водных растворах:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Гидролиз не идет | Гидролиз по катиону |
| Анион слабой кислоты | Гидролиз по аниону | Гидролиз по катиону и аниону |
Среда водных растворов солей:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Нейтральная | Кислая |
| Анион слабой кислоты | Щелочна я | Нейтральная* |
* на практике среда водных растворов солей, образованных слабым основанием и слабой кислотой, определяется силой кислоты и основания
Тип гидролиза и среда водных растворов некоторых солей:
| Катио н/анион | Na + | NH4 + |
| Cl – | NаCl, гидролиз не идет, среда нейтральная | (NH4)2CO3 гидролиз по катиону, среда щелочная |
| CO3 2 – | Na2CO3, гидролиз по аниону, среда щелочна я | Na2CO3, гидролиз по катиону и аниону, среда определяется силой кислоты и основания |
Индикаторы будут по-разному окрашиваться в водных растворах таких солей, в зависимости от среды. Таким образом, с помощью индикаторов можно различить водные растворы некоторых солей.
Окраска лакмуса в водных растворах солей, в зависимости от строения соли:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Лакмус фиолетовый | Лакмус красный |
| Анион слабой кислоты | Лакмус синий | Окраска лакмуса зависит от силы кислоты и основания |
Окраска лакмуса в водных растворах некоторых солей:
| Катио н/анион | Na + | NH4 + |
| Cl – | NаCl, лакмус фиолетовый | (NH4)2CO3 лакмус красный |
| CO3 2 – | Na2CO3, лакмус синий | Na2CO3, окраска лакмуса зависит от силы кислоты и основания |
Добавить комментарий
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Кислая среда и щелочная среда: определение и свойства. Ph-тест
Кислоты и щелочи — два крайних положения одной шкалы: их свойства (совершенно противоположные) обусловливает одна и та же величина — концентрация ионов водорода (H+). Однако само по себе это число очень неудобное: даже в кислых средах, где концентрация ионов водорода выше, это число составляет сотые, тысячные доли единицы. Поэтому для удобства пользуются десятичным логарифмом этого значения, умноженным на минус один. Принято говорить, что это pH (potentia Hydrogen), или же водородный показатель.
Возникновение понятия

Вообще тот факт, что кислая среда и щелочная среда определяются концентрацией ионов водорода H+ и что чем выше их концентрация, тем раствор более кислый (и наоборот, чем ниже концентрация H+, тем более щелочная среда и выше концентрация противоположных ионов OH-), был известен науке достаточно давно. Однако лишь в 1909 году датский химик Серенсен впервые опубликовал исследования, в которых пользовался понятием водородного показателя — PH, впоследствии замененным на pH.
Расчет кислотности
При расчете водородного показателя исходят из того, что молекулы воды в растворе, хоть и в очень малых количествах, все же диссоциируют на ионы. Эта реакция называется автопротолизом воды:

Реакция обратима, поэтому для нее определена константа равновесия (показывающая, какие в среднем устанавливаются концентрации каждого компонента). Здесь дано значение константы для стандартных условий — температуры 22 °С.
Внизу в квадратных скобках — молярные концентрации указанных компонентов. Молярная концентрация воды в воде — приблизительно 55 моль/литр, то есть величина второго порядка. Следовательно, произведение концентраций ионов H+ и OH- — около 10-14. Эта величина называется ионным произведением воды.
В чистой воде концентрации ионов водорода и гидроксид-ионов равны 10-7. Соответственно, водородный показатель воды будет приблизительно 7. Это значение pH принимают за нейтральную среду.
Далее нужно отвлечься от воды и рассмотреть раствор какой-нибудь кислоты или щелочи. Возьмем, например, уксусную кислоту. Ионное произведение воды останется прежним, однако баланс между ионами H+ и OH- сместится в сторону первых: ионы водорода придут от частично продиссоциировавшей уксусной кислоты, а «лишние» гидроксид-ионы уйдут в недиссоциировавшие молекулы воды. Таким образом, концентрация ионов водорода будет выше, и pH будет меньше (не надо забывать, что логарифм берется со знаком «минус»). Соответственно, кислая среда и щелочная среда связаны с pH. И связаны следующим образом. Чем меньше значение водородного показателя, тем более кислая среда.
Свойства кислой среды
Кислая среда — это растворы с pH меньше 7. Следует оговориться, что, хотя значение ионного произведения воды на первый взгляд ограничивает значения водородного показателя в пределах от 1 до 14, на самом деле растворы с pH меньше единицы (и даже меньше нуля) и больше 14 существуют. Например, в концентрированных растворах сильных кислот (серной, соляной) pH может достигать -2.
От того, имеем ли мы кислую среду или среду щелочную, может зависеть растворимость некоторых веществ. Например, возьмем гидроксиды металлов. Растворимость определяется величиной произведения растворимости, которое по структуре есть то же, что и ионное произведение воды: перемноженные концентрации. В случае с гидроксидом в произведение растворимости входит концентрация иона металла и концентрация гидроксид-ионов. В случае избытка ионов водорода (в кислой среде) они будут активнее «вырывать» гидроксид-ионы из осадка, тем самым смещая равновесие в сторону растворенной формы, повышая растворимость осадка.
Также стоит упомянуть, что весь пищеварительный тракт человека имеет кислую среду: pH желудочного сока колеблется от 1 до 2. Отклонение от этих значений в меньшую или большую сторону может являться признаком различных заболеваний.
Свойства щелочной среды
В щелочной среде водородный показатель принимает значения, превышающие 7. Для удобства в средах с высокой концентрацией гидроксид-ионов вместо водородного показателя кислотности pH пользуются показателем основности pOH. Нетрудно догадаться, что он обозначает величину, равную -lg[OH-] (отрицательный десятичный логарифм концентрации гидроксид-ионов). Непосредственно из ионного произведения воды следует равенство pH + pOH =14. Поэтому pOH = 14 — pH. Таким образом, у всех утверждений, верных для показателя кислотности pH, верны обратные утверждения для показателя основности pOH. Если pH щелочной среды большой по определению, то ее pOH, очевидно, маленький, и чем сильнее раствор щелочи, тем меньше показатель pOH.
В этом предложении только что появился логический парадокс, вносящий путаницу во многие рассуждения о кислотности: маленький показатель кислотности обозначает высокую кислотность среды, и наоборот: большие значения pH соответствуют низкой кислотности. Этот парадокс появляется потому, что логарифм берется со знаком минус, и шкала кислотности как бы инвертируется.
Практическое определение кислотности
Для определения кислотности среды применяются так называемые индикаторы. Обычно это достаточно сложно устроенные органические молекулы, которые меняют свой цвет в зависимости от pH среды. Индикатор меняет свой цвет в очень узком интервале pH: это используется в кислотно-основном титровании, чтобы добиться точных результатов: титрование прекращают, как только индикатор меняет цвет.
Наиболее известные индикаторы — метиловый оранжевый (интервал перехода в области с маленьким pH), фенолфталеин (интервал перехода в области с большим pH), лакмус, тимоловый голубой и другие. В кислых средах и щелочных средах применяются разные индикаторы в зависимости от того, в какой области лежит их интервал перехода.
Существуют также универсальные индикаторы — они меняют свой цвет постепенно с красного на глубоко фиолетовый при переходе из сильно кислотных сред в сильно щелочные. На самом деле универсальные индикаторы представляют собой смесь из обычных.
Для более точного определения кислотности используют прибор — pH-метр (потенциометр, метод, соответственно, называется потенциометрия). Его принцип работы основан на измерении ЭДС в цепи, элементом которой является раствор с измеряемым pH. Потенциал электрода, погруженного в раствор, чувствителен к концентрации ионов водорода в растворе — отсюда изменение ЭДС, на основании которого рассчитывается реальный pH.
Кислотность различных сред в быту
Показатель кислотности имеет большое значение в повседневной жизни. Например, слабые кислоты — уксусная, яблочная — используются в качестве консервантов. Щелочные растворы являются моющими средствами, в том числе и мыло. Самое простое мыло представляет собой натриевые соли жирных кислот. В воде они диссоциируют: остаток жирной кислоты — очень длинный — с одной стороны имеет отрицательный заряд, а с другой своей стороны — длинную неполярную цепочку атомов углерода. Тот конец молекулы, на котором заряд участвует в гидратации, собирает вокруг себя молекулы воды. Второй конец присоединяется к другим неполярным вещам, например, молекулам жира. В результате образуются мицеллы — шарики, у которых наружу торчат «хвосты» с отрицательным зарядом, а внутри спрятаны «хвосты» и частички жира и грязи. Поверхность отмывается от жира и грязи за счет того, что моющее средство связывает весь жир и грязь в такие мицеллы.
Кислотность и здоровье
Уже было упомянуто, что pH имеет большое значение для человеческого организма. Кроме пищеварительного тракта, показатель кислотности важно контролировать и в других частях организма: кровь, слюна, кожа — для многих биологических процессов имеют большое значение кислая среда и щелочная среда. Их определение позволяет оценить состояние организма.
Сейчас набирают популярность pH-тесты — так называемые экспресс-тесты для проверки кислотности. Они представляют собой обычные полоски универсальной индикаторной бумаги.
http://chemege.ru/sreda-rastvorov-indikatory/
http://1ku.ru/obrazovanie/67689-kislaja-sreda-i-shhelochnaja-sreda-opredelenie-i-svojstva-ph-test/