Расчёты по уравнениям химических реакций.
Стехиометрия – количественные соотношения между вступающими в реакцию веществами.
Если реагенты вступают в химическое взаимодействие в строго определенных количествах, а в результате реакции образуются вещества, количество которых можно расчитать, то такие реакции называются стехиометрическими.
Законы стехиометрии:
Коэффициенты в химических уравнениях перед формулами химических соединений называются стехиометрическими.
Все расчёты по химическим уравнениям основаны на использовании стехиометрических коэффициентов и связаны с нахождением количеств вещества (чисел молей).
Количество вещества в уравнении реакции (число молей) = коэффициенту перед соответствующей молекулой.
Моль – это такое количество вещества, в котором содержится определённое число частиц (молекул, атомов, ионов), равное постоянной Авогадро:
Выход реакции η – отношение реальной массы продукта mp к теоретически возможной mт, выраженное в долях единицы или в процентах.
Если в условии выход продуктов реакции не указан, то в расчетах его принимают равным 100% (количественный выход).
Схема расчёта по уравнениям химических реакций:
- Составить уравнение химической реакции.
- Над химическими формулами веществ написать известные и неизвестные величины с единицами измерения.
- Под химическими формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
- Составить и решить пропорцию.
Пример. Вычислить массу и количество вещества оксида магния, образовавшегося при полном сгорании 24 г магния.
1. Составим уравнение химической реакции:
2. Под формулами веществ укажем количество вещества (число молей), которое соответствует стехиометрическим коэффициентам:
3. Определим молярную массу магния:
Относительная атомная масса магния Ar(Mg) = 24.
Т.к. значение молярной массы равно относительной атомной или молекулярной массе, то M(Mg) = 24 г/моль.
4. По массе вещества, заданной в условии, вычислим количество вещества:
5. Над химической формулой оксида магния MgO, масса которого неизвестна, ставим x моль, над формулой магния Mg пишем его молярную массу:
6. Составим пропорцию:
По правилам решения пропорции:
Количество оксида магния ν(MgO) = 1 моль.
Моль и молярная масса: простое объяснение с примерами
Химия — наука, изучающая взаимодействие веществ на атомном и молекулярном уровнях. Эти процессы значительно отличаются от привычного нам макроуровня и поэтому требуют специфических подходов, в том числе к «подсчету» и «взвешиванию». Школьный курс химии включает понятия «моль» и «молярная масса». Они кажутся сложными, но если разобраться, то вы без труда поймете сущность этих понятий и научитесь ими пользоваться при решении задач.
Моль
Понятие «моль» попытаемся разобрать и, самое главное, понять на примере всем знакомой реакции взаимодействия кислорода и водорода. Когда одна молекула O2 соединяется с двумя молекулами H2, получается две молекулы H2O:
То есть, чтобы максимально полно провести химическую реакцию, мы должны взять на каждую молекулу кислорода две молекулы водорода. Итак, у нас есть 100 г кислорода. Сколько понадобится водорода для протекания процесса? И тут возникает первый вопрос: сколько молекул в 100 г кислорода? Наверное, миллиарды или даже миллиарды миллиардов? И сколько их в 100 г водорода? Уж точно в не в 2 раза меньше. Как вообще подсчитать молекулы, ведь они бывают совершенно разными, «тяжелыми» и «легкими». Этими вопросами задавались и люди, закладывавшие основу современной химической науки.
Был найден простой выход, который помогает легко и изящно решить проблему. Химики решили взять за единицу измерения не одну молекулу, а определенное их количество, причем очень большое. Таким образом эта единица измерения приводит микроуровень к макроуровню. Она называется «моль».
Моль — это количество вещества из 6,02214076⋅10 23 атомов или молекул. Оно не имеет физического смысла и изначально было привязано к массе определенного количества (12 граммов) углерода-12, но позже переопределено, как и многие другие единицы системы СИ. В школьных расчетах количество структурных единиц в моле, которое также называется постоянной Авогадро, обычно округляют до 6,022⋅10 23 и обозначают NA.
С этой величиной связано другое химическое понятие — «количество вещества», то есть количество структурных единиц в определенной его порции. Оно обозначается буквой ν (ню).
Примеры
В стакане содержится 2 моль воды. Сколько молекул воды находится в стакане?
N = ν⋅ NA =2 ⋅ 6,022⋅10 23 = 12,044⋅10 23 молекул воды.
Также можно решить обратную задачу. Сколько молей вещества составляют 24,088⋅10 23 молекул воды?
ν⋅ = N / NA = 24,088⋅10 23 / 6,022⋅10 23 = 4 моля.
Моль и молярная масса: простое объяснение с примерами
Молярная масса
Итак, мы поняли, что моль — условное количество вещества, выбранное для удобства химиков. Это даже не миллиарды миллиардов, как мы предположили ранее, а миллиарды триллионов, что никак не облегчает задачу подсчета этих структурных единиц. Как же все-таки узнать, сколько атомов или молекул в 100 граммах того или иного вещества? Теперь хорошо бы связать количество вещества и его массу, ведь это не одно и то же. Нам поможет «молярная масса» — то есть масса 1 моль вещества или масса 6,022⋅10 23 структурных единиц этого вещества.
Итак, молярная масса равна массе порции вещества m к количеству молекул ν в его порции:
Вооружившись этим знанием, мы можем переводить граммы в число молекул и наоборот. При этом следует учесть, что молярная масса численно идентична молекулярной массе (то есть массе молекулы), выраженной в атомных единицах массы, и относительной молекулярной массе.
Пример
Найдем массу 5 моль воды.
Чтобы решить эту задачу, обратимся к формуле молярной массы и выразим из нее массу:
В этой формуле мы знаем количество вещества ν = 5 моль, а молярную массу сложной молекулы нужно определить, как сумму молярных масс составляющих ее химических элементов:
Моль и молярная масса: простое объяснение с примерами
Где взять молярные массы кислорода и водорода (в соединение входит два атома водорода, поэтому его молярную массу умножаем на 2)?
Для этого нам понадобится таблица Менделеева и значение «относительной атомной массы», которая, как мы уже знаем, идентична молекулярной. Это значение приведено для каждого химического элемента и для водорода равно 1,00797 (то есть близко к 1), для углерода — близко к 6, для кислорода — около 16. Подставим соответствующие значения в исходную формулу и получим:
M (H2O) = 2 ⋅M (H) + M (O) = 2 ⋅ 1 + 16 = 18 г/моль.
То есть масса 1 моль воды составляет 18 граммов. Теперь можем подсчитать массу 5 моль воды:
m = М ⋅ ν = 18 ⋅ 5 = 90 г.
Аналогичным образом мы можем подсчитать количество вещества, которое содержится в определенном образце заданной массы. Для примера возьмем оксид алюминия Al2O3 и узнаем, сколько моль в 400 граммах этого вещества. Для этого выразим количество вещества через молярную массу и подставим исходные данные:
ν = m / М = 400 / (2 ⋅ М (Al) + 3 ⋅ (O)) = 400 / (2 ⋅ 75 + 3 ⋅ 16) = 400 / (150 + 48) = 400 / 198 ≈ 2,02 моль.
Урок 14. Расчеты по уравнениям химических реакций
В уроке 14 «Расчеты по уравнениям химических реакций» из курса «Химия для чайников» мы научимся решать задачи, используя уравнения химических реакций.
Вещества вступают в химические реакции в определенных массовых и количественных соотношениях. Следовательно, при проведении реакций в лабораториях и на химических заводах расходуются определенные массы исходных веществ для получения заданной массы продуктов реакции.
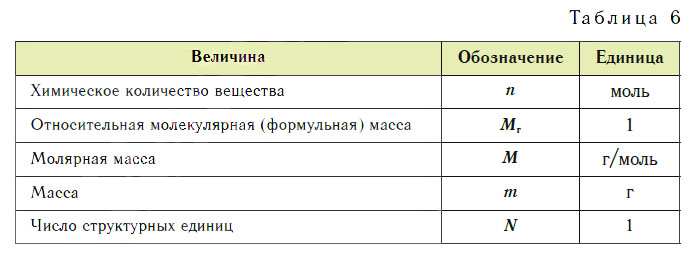
Эти расчеты проводят по уравнениям реакций. Единицы величин, которыми пользуются в химии, представлены в таблице 6.
При проведении любого вычисления по уравнению реакции нужно внимательно прочитать условие задачи. Особое в нимание обратите на расстановку коэффициентов, так как соотношение числа структурных единиц реагирующих веществ и получающихся продуктов реакции выражается в уравнениях коэффициентами так же, как и мольные отношения.
Для решения расчетной задачи необходим определенный порядок действий. Рассмотрим его на нескольких примерах.
Пример 1. Железо масс о й 224 г полностью прореагировало с хлором. Рассчитайте массу образовавшегося вещества FeCl3.
http://egevpare.ru/mol-i-moljarnaja-massa/
http://himi4ka.ru/arhiv-urokov/urok-14-raschety-po-uravnenijam-himicheskih-reakcij.html