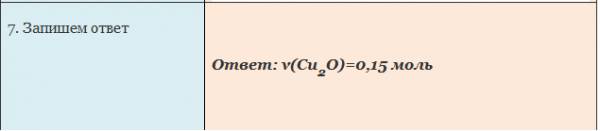Молярная масса
О чем эта статья:
Что такое моль
Прежде чем говорить о том, как найти молярную массу вещества, определимся с понятием «моль». Его ввели как искусственную величину для упрощения расчетов. Это количество вещества, в котором содержится столько же мельчайших частиц, сколько в 12 г одного из изотопов углерода — C12.
Для всех химических веществ это количество одинаково и представляет собой число Авогадро 6,02 · 10 23 . Постоянная Авогадро обозначается NA, а измеряется в моль -1 .
Число Авогадро — это количество молекул, ионов или других мельчайших частиц в 1 моле вещества.
NA = 6,02 · 10 23 моль -1 .
Историческая справка
В 1811 году химик Амедео Авогадро предположил, что если взять два равных объема газов в равных значимых условиях (при одинаковой температуре и давлении), то количество молекул в этих объемах тоже будет одинаковым. Опираясь на свою гипотезу, он определил атомные и молекулярные массы многих веществ, а также рассчитал количество атомов в молекулах воды, оксидов азота и т. д. Однако в научных кругах гипотеза Авогадро долго не находила понимания. Общепринятой она стала только в 1860 году.
Что такое молярная масса
Молярная масса — это масса одного моля вещества, она измеряется в граммах деленных на моль (г/моль). Данная величина представляет собой отношение массы вещества к его количеству, которое измеряется в молях.
Как обозначается молярная масса: М.
, где — это масса вещества, а — количество вещества.
Единица измерения молярной массы: г/моль.
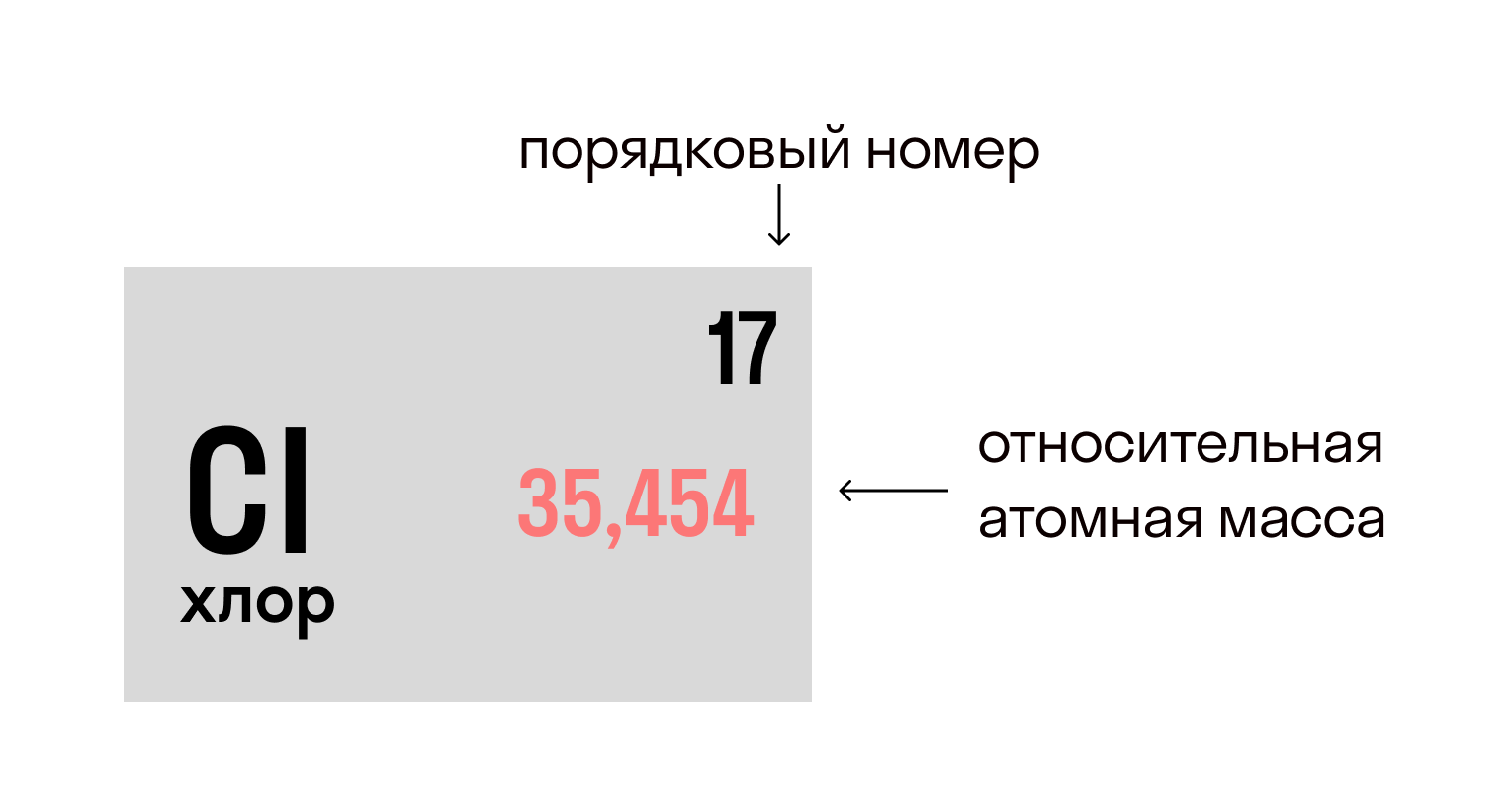
Несмотря на то, что в 1 моле любого химического вещества содержится одинаковое количество молекул (и оно равно числу Авогадро), молярные массы разных веществ отличаются. Все потому, что отличаются атомы, которые входят в состав этих молекул. В частности, разница между ними заключается в относительной атомной массе (Ar) — например, Ar(Mg) = 24, а Ar(Hg) = 200. Сейчас станет ясно, какое это имеет значение.
Как определить молярную массу
Данная величина тесно связана с такими понятиями, как относительные атомная и молекулярная массы. Именно относительные, потому что абсолютную массу молекулы или атома вещества в химии не используют для решения задач — это слишком малые величины.
Относительная атомная масса вещества (Ar) показывает, во сколько раз его атом больше 1/12 атома углерода. Это значение для каждого химического элемента можно увидеть в таблице Менделеева.
Относительная молекулярная масса (Mr) складывается из Ar каждого атома в молекуле вещества с учетом индексов. Она показывает, на сколько масса молекулы больше 1/12 атома углерода.
, где — это количество атомов.
Разберемся на примерах.
В молекуле хлорида натрия NaCl есть 1 атом натрия и 1 атом хлора, при этом Ar(Na) = 23, Ar (Cl) = 35,5.
Mr(NaCl) = 23 + 35,5 = 58,5.
В молекуле NaNO2 есть 1 атом натрия, 1 атом азота и 2 атома кислорода.
Собственно, для вычисления молярной массы больше ничего и не требуется.
Количество вещества
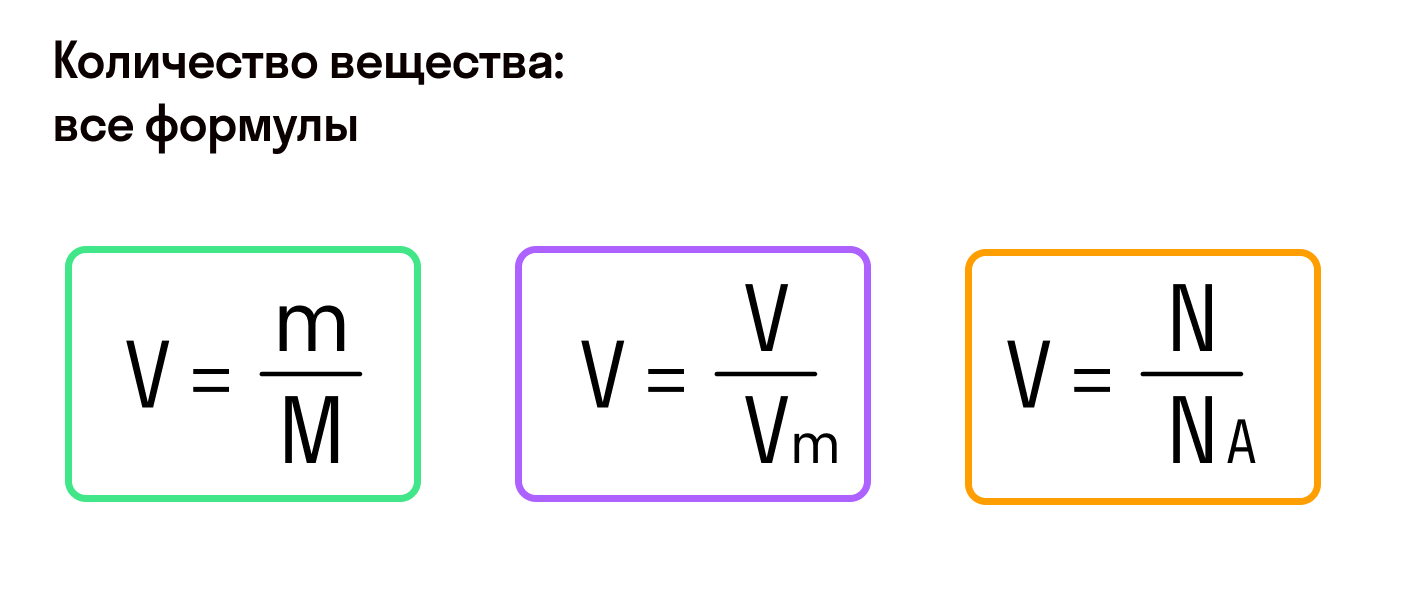
Из предыдущих формул понятно, что молярная масса и количество вещества тесно связаны. Рассмотрим эту связь подробнее. Начнем с того, что количество вещества может обозначаться как латинской буквой , так и греческой буквой (ню). Международное обозначение — , но не стоит удивляться, встретив в формулах любую из этих букв.
В формуле нахождения молярной массы мы обозначили количество вещества через :
Пользуясь этим, можно найти количество вещества (в молях), если нам известны его абсолютная и молярная масса.
Пример 1
Как определить, какое количество вещества включают 350 г сульфата бария BaSO4?
Мы помним, что M = Mr (значение молярной массы равно значению относительной молекулярной).
Подставим значение молярной массы в формулу:
Есть и еще одна формула количества вещества, которая позволяет найти его, если известно число молекул или других структурных единиц.
, где — число структурных единиц, — число Авогадро.
Пример 2
Допустим, некий объем CaCO3 содержит 3,01 · 10 23 молекул. Как найти количество вещества, соответствующее данному объему?
Воспользуемся формулой моль.
Молярный объем
Выше мы находили количество вещества через молярную массу, но для газов это можно сделать и через молярный объем. Согласно закону Авогадро количество любого газа, равное 1 моль, будет занимать один и тот же объем, если газы рассматриваются при одинаковой температуре и давлении.
При стандартных физических условиях — температуре 0°С и давлении 1 атм или 760 мм ртутного столба, 1 моль газа занимает объем 22,4 л.
Молярный объем — это объем газа, взятого в количестве 1 моль. Он обозначается Vm.
При нормальных условиях Vm = 22,4 л/моль.
Значения молярного и фактического объема газа помогают найти количество вещества.
, где — фактический объем газа, а — молярный объем.
Пример 1
Сколько молей содержится в 120 литрах газа при нормальных условиях?
Рассчитаем по формуле моль.
Ответ: 120 литров любого газа при стандартных условиях содержат 5,36 моль.
Относительная плотность одного газа по другому
Иногда для решения задачи нужно знать, как найти молярную массу газа, о котором сообщается лишь его плотность по воздуху или по другому газу. Это возможно, если знать формулу относительной плотности, которая обозначается буквой D.
, где и — некие газы.
Пример 1
Как определить, во сколько раз угарный газ плотнее водорода?
Для начала найдем молярную массу CO и H2:
Ответ: угарный газ в 14 раз плотнее водорода.
Пример 2
Как посчитать молярную массу газа х, о котором известно, что он в 10 раз плотнее углекислого газа CO2?
Подсчитаем для начала молярную массу углекислого газа:
Ориентируясь на формулу относительной плотности, произведем расчет молярной массы искомого газа х.
М(х) = D(х/CO2) · M(CO2) = 10 · 44 = 440 г/моль.
Ответ: у данного газа молярная масса 440 г/моль.
Примеры задач
Итак, мы разобрались, как находить молярную массу жидкости, газа или твердого тела и как это понятие связано с количеством вещества, а также с относительной плотностью одного газа по другому. Чтобы закрепить знания, посмотрите, как эти сведения применяются в решении задач.
Задача 1
Известно, что 300 г неустановленного вещества содержат 12,04 · 10 23 молекул. Чему равна молярная масса данного вещества?
N(х) = 12,04 · 10 23 .
Найдем количество вещества моль.
Подставим количество вещества в формулу :
Ответ: молярная масса данного вещества 150 г/моль.
Задача 2
Какой объем займет водород в количестве 0,7 моль?
По формуле мы можем найти объем .
Зная, что молярный объем при обычных условиях составляет 22,4 л/моль, вычислим фактический объем водорода:
Ответ: объем водорода составляет 15,68 литров.
Задача 3
В порции оксида серы SO3 содержится 8,356 · 10 23 атомов кислорода. Какова масса этой порции?
N(O) = 8,356 · 10 23 .
Для решения задачи нам подходит формула , т. е. . Но для начала нужно найти количество вещества.
Мы знаем, что в одной молекуле SO3 есть 3 атома кислорода, исходя из этого можно вычислить количество молекул в порции оксида:
Зная количество молекул, рассчитаем количество вещества:
Теперь можно узнать молярную массу SO3:
M(SO3) = 32 + 16 · 3 = 80 г/моль.
Рассчитаем фактическую массу через молярную массу:
Ответ: абсолютная масса порции оксида серы 36,8 грамм.
Задача 4
Как рассчитать молярную массу простого вещества, о котором известно, что в порции 100 г содержится 15,05 · 10 23 молекул? Назовите это вещество.
N(x) = 15,05 · 10 23 .
В данном случае поможет вычислить молярную массу NA, с помощью которого мы сначала узнаем количество вещества:
Исходя из этого, рассчитаем молярную массу:
Ответ: согласно таблице Менделеева можно предположить, что это кальций Ca.
Задача 5
Определите, насколько сероводород H2S плотнее водорода H2?
Нам требуется вычислить относительную плотность сероводорода по водороду:
Для этого вычислим молярные массы H2S и H2:
М(H2S) = 1 · 2 + 32 = 34 г/моль.
М(H2) = 1 · 2 = 2 г/моль.
Подставим значения в формулу:
Ответ: сероводород в 17 раз плотнее водорода.
Вопросы для самопроверки
Что такое число Авогадро и чему оно равно?
В чем измеряется молярная масса?
Напишите формулу молярной массы вещества.
Какая формула связывает количество вещества и его объем?
Как узнать количество вещества, если известно число молекул в порции?
Расчёты по уравнениям химических реакций.
Стехиометрия – количественные соотношения между вступающими в реакцию веществами.
Если реагенты вступают в химическое взаимодействие в строго определенных количествах, а в результате реакции образуются вещества, количество которых можно расчитать, то такие реакции называются стехиометрическими.
Законы стехиометрии:
Коэффициенты в химических уравнениях перед формулами химических соединений называются стехиометрическими.
Все расчёты по химическим уравнениям основаны на использовании стехиометрических коэффициентов и связаны с нахождением количеств вещества (чисел молей).
Количество вещества в уравнении реакции (число молей) = коэффициенту перед соответствующей молекулой.
Моль – это такое количество вещества, в котором содержится определённое число частиц (молекул, атомов, ионов), равное постоянной Авогадро:
Выход реакции η – отношение реальной массы продукта mp к теоретически возможной mт, выраженное в долях единицы или в процентах.
Если в условии выход продуктов реакции не указан, то в расчетах его принимают равным 100% (количественный выход).
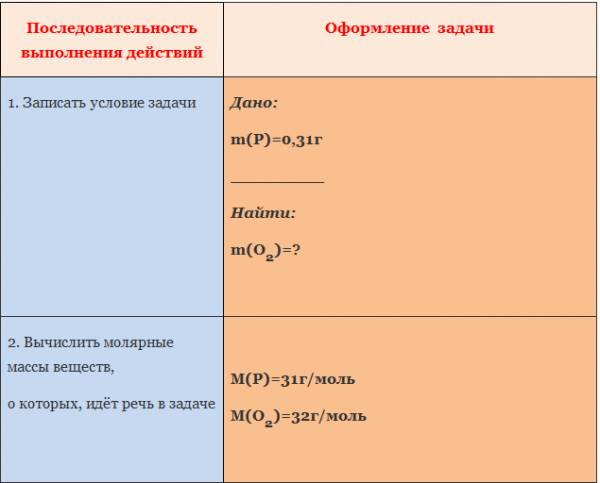
Схема расчёта по уравнениям химических реакций:
- Составить уравнение химической реакции.
- Над химическими формулами веществ написать известные и неизвестные величины с единицами измерения.
- Под химическими формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
- Составить и решить пропорцию.
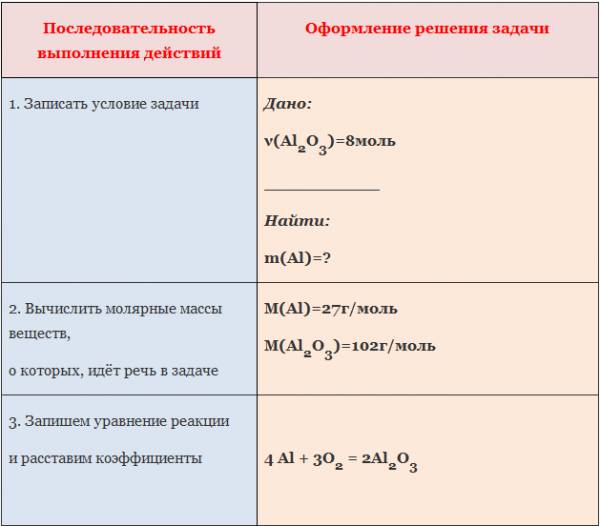
Пример. Вычислить массу и количество вещества оксида магния, образовавшегося при полном сгорании 24 г магния.
1. Составим уравнение химической реакции:
2. Под формулами веществ укажем количество вещества (число молей), которое соответствует стехиометрическим коэффициентам:
3. Определим молярную массу магния:
Относительная атомная масса магния Ar(Mg) = 24.
Т.к. значение молярной массы равно относительной атомной или молекулярной массе, то M(Mg) = 24 г/моль.
4. По массе вещества, заданной в условии, вычислим количество вещества:
5. Над химической формулой оксида магния MgO, масса которого неизвестна, ставим x моль, над формулой магния Mg пишем его молярную массу:
6. Составим пропорцию:
По правилам решения пропорции:
Количество оксида магния ν(MgO) = 1 моль.
8 класс. Химия. Расчеты массы вещества по уравнению химической реакции
8 класс. Химия. Расчеты массы вещества по уравнению химической реакции
- Оглавление
- Занятия
- Обсуждение
- О курсе
Вопросы
Задай свой вопрос по этому материалу!
Поделись с друзьями
Комментарии преподавателя
Соотношение количеств веществ, участвующих в реакции
Коэффициенты в уравнении реакции показывают не только число молекул каждого вещества, но и соотношение количеств веществ, участвующих в реакции. Так, по уравнению реакции: 2H2 + O2 = 2H2O – можно утверждать, что для образования определенного количества воды (например, 2 моль) необходимо столько же моль простого вещества водорода (2 моль) и в два раза меньше моль простого вещества кислорода (1 моль). Приведем примеры подобных расчетов.
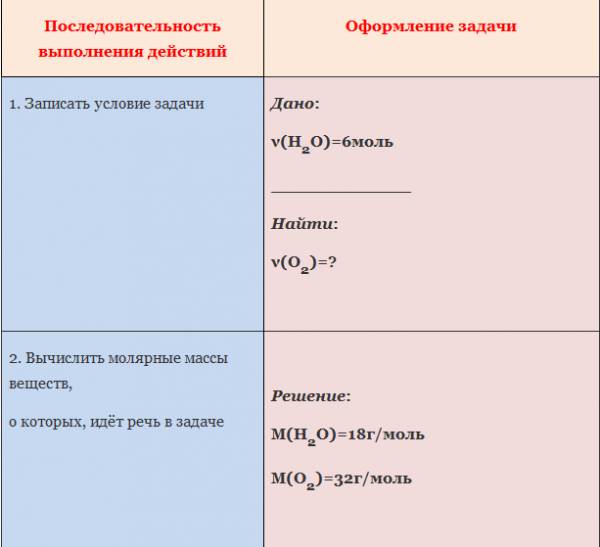
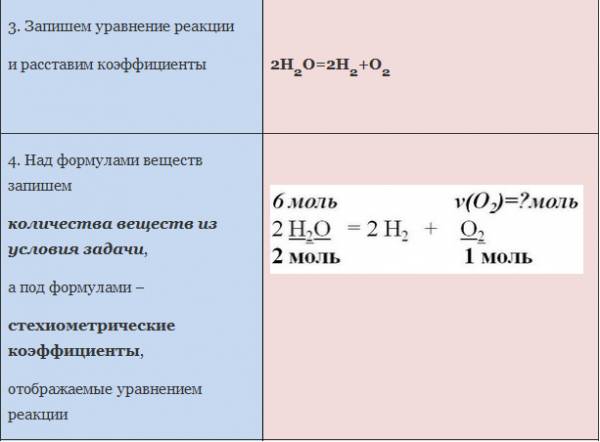
ЗАДАЧА 1. Определим количество вещества кислорода, образующегося в результате разложения 4 моль воды.
АЛГОРИТМ решения задачи:
1. Составить уравнение реакции
2. Составить пропорцию, определив количества веществ по уравнению реакции и по условию задачи (обозначить неизвестное количество вещества за х моль).
3. Составить уравнение (из пропорции).
4. Решить уравнение, найти х.
Рис. 1. Оформление краткого условия и решения задачи 1
ЗАДАЧА 2. Какое количество кислорода потребуется для полного сжигания 3 моль меди?
Воспользуемся алгоритмом решения задач с использованием уравнения химической реакции.
Рис. 2. Оформление краткого условия и решения задачи 2.
I. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите количество вещества оксида алюминия, образовавшегося в результате взаимодействия алюминия количеством вещества 0,27 моль с достаточным количеством кислорода (4Al +3O2=2Al2O3).
2. Вычислите количество вещества оксида натрия, образовавшегося в результате взаимодействия натрия количеством вещества 2,3 моль с достаточным количеством кислорода (4Na+O2=2Na2O).
Алгоритм №1
Вычисление количества вещества по известному количеству вещества, участвующего в реакции.
Пример. Вычислите количество вещества кислорода, выделившегося в результате разложения воды количеством вещества 6 моль.
II. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите массу серы, необходимую для получения оксида серы (IV) количеством вещества 4 моль (S+O2=SO2).
2. Вычислите массу лития, необходимого для получения хлорида лития количеством вещества 0,6 моль (2Li+Cl2=2LiCl).
Внимательно изучите алгоритм и запишите в тетрадь
Алгоритм №2
Вычисление массы вещества по известному количеству другого вещества, участвующего в реакции.
Пример: Вычислите массу алюминия, необходимого для получения оксида алюминия количеством вещества 8 моль.
III. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите количество вещества сульфида натрия, если в реакцию с натрием вступает сера массой 12,8 г (2Na+S=Na2S).
2. Вычислите количество вещества образующейся меди, если в реакцию с водородом вступает оксид меди (II) массой 64 г (CuO + H2 = Cu + H2O).
Внимательно изучите алгоритм и запишите в тетрадь
Алгоритм №3
Вычисление количества вещества по известной массе другого вещества, участвующего в реакции.
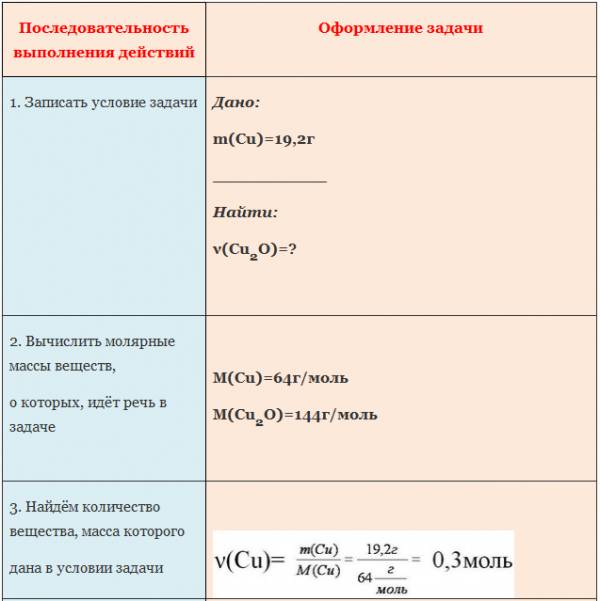
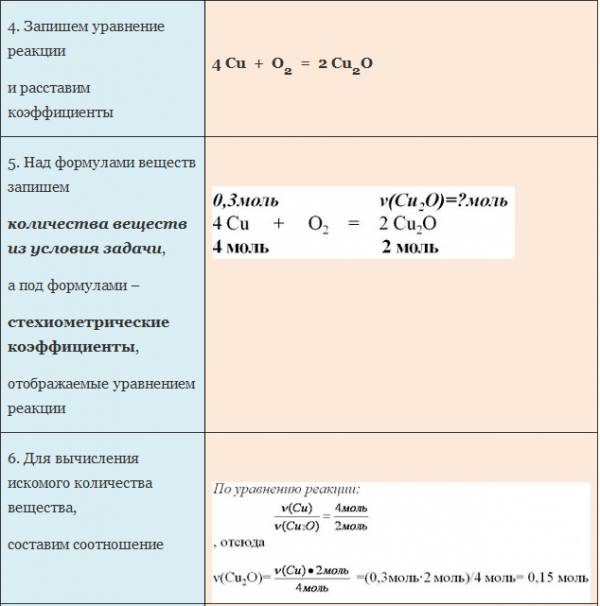
Пример. Вычислите количество вещества оксида меди (I), если в реакцию с кислородом вступает медь массой 19,2г.
Внимательно изучите алгоритм и запишите в тетрадь
IV. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите массу кислорода, необходимую для реакции с железом массой 112 г
Алгоритм №4
Вычисление массы вещества по известной массе другого вещества, участвующего в реакции
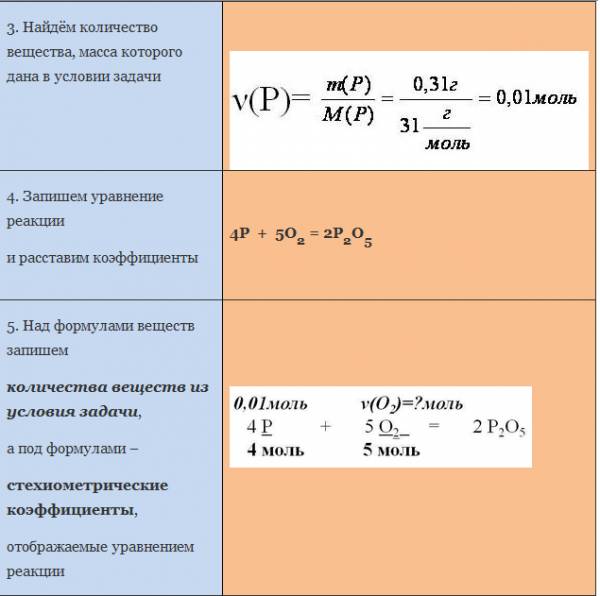
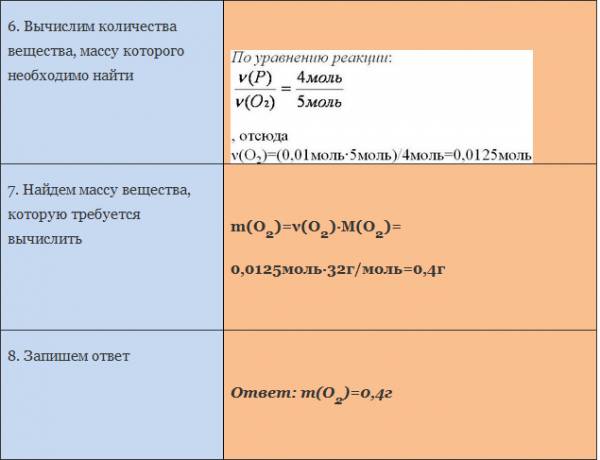
Пример. Вычислите массу кислорода, необходимую для сгорания фосфора, массой 0,31г.
Рассмотрим уравнение реакции образования воды из простых веществ:
Можно сказать, что из двух молекул водорода и одной молекулы кислорода образуется две молекулы воды. С другой стороны, эта же запись говорит о том, что для образования каждых двух молей воды нужно взять два моля водорода один моль кислорода.
Мольное соотношение участников реакции помогает производить важные для химического синтеза расчеты. Рассмотрим примеры таких расчетов.
ЗАДАЧА 1. Определим массу воды, образовавшуюся в результате сгорания водорода в 3,2 г кислорода.
Чтобы решить эту задачу, сначала необходимо составить уравнение химической реакции и записать над ним данные условия задачи.
Если бы мы знали количество вещества вступившего в реакцию кислорода, то смогли бы определить количество вещества воды. А затем, рассчитали бы массу воды, зная ее количество вещества и молярную массу. Чтобы найти количество вещества кислорода, нужно массу кислорода разделить на его молярную массу.
Молярная масса численно равна относительной молекулярной массе. Для кислорода это значение составляет 32. Подставим в формулу: количество вещества кислорода равно отношению 3,2 г к 32 г/моль. Получилось 0,1 моль.
Для нахождения количества вещества воды оставим пропорцию, используя мольное соотношение участников реакции:
на 0,1 моль кислорода приходится неизвестное количество вещества воды, а на 1 моль кислорода приходится 2 моля воды.
Отсюда количество вещества воды равно 0,2 моль.
Чтобы определить массу воды, нужно найденное значение количества воды умножить на ее молярную массу, т.е. умножаем 0,2 моль на 18 г/моль, получаем 3,6 г воды.
Рис. 1. Оформление записи краткого условия и решения Задачи 1
Помимо массы, можно рассчитывать объем газообразного участника реакции (при н.у.), используя известную вам формулу, в соответствие с которой объем газа при н.у. равен произведению количества вещества газа на молярный объем. Рассмотрим пример решения задачи.
ЗАДАЧА 2. Рассчитаем объем кислорода (при н.у.), выделившийся при разложении 27г воды.
Запишем уравнение реакции и данные условия задачи. Чтобы найти объем выделившегося кислорода, нужно найти сначала количество вещества воды через массу, затем по уравнению реакции определить количество вещества кислорода, после чего можно рассчитать его объем при н.у.
Количество вещества воды равно отношению массы воды к ее молярной массе. Получаем значение 1,5 моль.
Составим пропорцию: из 1,5 моля воды образуется неизвестное количество кислорода, из 2 молей воды образуется 1 моль кислорода. Отсюда количество кислорода равно 0,75 моля. Рассчитаем объем кислорода при н.у. Он равен произведению количества кислорода на молярный объем. Молярный объем любого газообразного вещества при н.у. равен 22,4 л/моль. Подставив числовые значения в формулу, получим объем кислорода, равный 16,8 л.
Рис. 2. Оформление записи краткого условия и решения Задачи 2
Зная алгоритм решения подобных задач, можно рассчитать массу, объем или количество вещества одного из участников реакции по массе, объему или количеству вещества другого участника реакции.
ИСТОЧНИКИ
исчтоник конспекта — http://interneturok.ru/ru/school/chemistry/8-klass/bvewestva-i-ih-prevraweniyab/raschety-massy-veschestva-po-uravneniyu-himicheskoy-reaktsii
источник видео — http://www.youtube.com/watch?v=wZbj-o5J5Vs
источник видео — http://www.youtube.com/watch?v=8sPwPk7a7p0
источник видео — http://www.youtube.com/watch?v=ygaarSGQDwE
источник видео — http://www.youtube.com/watch?v=Gv-jZX0wZxE
Файлы
Нет дополнительных материалов для этого занятия.
http://www.calc.ru/Raschty-Po-Uravneniyam-Khimicheskikh-Reaktsiy.html
http://www.kursoteka.ru/course/2183/lesson/6956/unit/18148/1