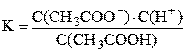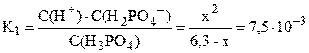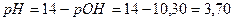РАСЧЁТ pH В РАСТВОРАХ КИСЛОТ И ОСНОВАНИЙ
Чистая вода является очень слабым электролитом. Процесс диссоциации воды может быть выражен уравнением: HOH ⇆ H + + OH – . Вследствие диссоциации воды в любом водном растворе содержатся и ионы H + , и ионы OH – . Концентрации этих ионов можно рассчитать с помощью уравнения ионного произведения воды
где Kw – константа ионного произведения воды; при 25°C Kw = 10 –14 .
Растворы, в которых концентрации ионов H + и OH – одинаковы, называются нейтральными растворами. В нейтральном растворе C(H + ) = C(OH – ) = 10 –7 моль/л.
В кислом растворе C(H + ) > C(OH – ) и, как следует из уравнения ионного произведения воды, C(H + ) > 10 –7 моль/л, а C(OH – ) –7 моль/л.
В щелочном растворе C(OH – ) > C(H + ); при этом в C(OH – ) > 10 –7 моль/л, а C(H + ) –7 моль/л.
pH – величина, с помощью которой характеризуют кислотность или щёлочность водных растворов; эта величина называется водородным показателем и рассчитывается по формуле:
В кислом растворе pH 7.
По аналогии с понятием «водородный показатель» (pH) вводится понятие «гидроксильный» показатель (pOH):
Водородный и гидроксильный показатели связаны соотношением
Гидроксильный показатель используется для расчёта pH в щелочных растворах.
Пример 7.1 Рассчитать pH 0,005 М раствора серной кислоты.
Серная кислота – сильный электролит, диссоциирующий в разбавленных растворах необратимо и полностью по схеме: H2SO4 ® 2 H + + SO4 2– . Из уравнения процесса диссоциации видно, что C(H + ) = 2·C(H2SO4) = 2 × 0,005 моль/л = 0,01 моль/л.
pH = –lg C(H + ) = –lg 0,01 = 2.
Пример 7.2 Рассчитать pH 0,1 М раствора гидроксида натрия.
Гидроксид натрия – сильный электролит, диссоциирующий необратимо и полностью по схеме: NaOH ® Na + +OH – . Из уравнения процесса диссоциации видно, что C(OH – ) = C(NaOH) = 0,1 моль/л.
pOH = –lg C(H + ) = –lg 0,1 = 1; pH = 14 – pOH = 14 – 1 = 13.
Диссоциация слабого электролита – это равновесный процесс. Константа равновесия, записанная для процесса диссоциации слабого электролита, называется константой диссоциации. Например, для процесса диссоциации уксусной кислоты
Каждая стадия диссоциации многоосновной кислоты характеризуется своей константой диссоциации. Константа диссоциации – справочная величина; см. [1; 2].
Расчёт концентраций ионов (и pH) в растворах слабых электролитов сводится к решению задачи на химическое равновесие для того случая, когда известна константа равновесия и необходимо найти равновесные концентрации веществ, участвующих в реакции (см. пример 6.2 – задача 2 типа).
Пример 7.3 Рассчитать pH и степень диссоциации электролита в растворе NH4OH с массовой долей 0,35%. Плотность раствора – 1 г/мл.
В 0,35% растворе NH4OH молярная концентрация гидроксида аммония равна 0,1 моль/л (пример перевода процентной концентрации в молярную – см. пример 5.1). Эту величину часто обозначают C0. C0 – это общая концентрация электролита в растворе (концентрация электролита до диссоциации).
NH4OH принято считать слабым электролитом, обратимо диссоциирующим в водном растворе: NH4OH ⇆ NH4 + + OH – (см. также примечание 2 на стр. 5). Константа диссоциации К = 1,8·10 –5 (справочная величина). Поскольку слабый электролит диссоциирует неполностью, сделаем предположение, что продиссоциировало x моль/л NH4OH, тогда равновесная концентрация ионов аммония и гидроксид-ионов также будут равняться x моль/л: C(NH4 + ) = C(OH — ) = x моль/л. Равновесная концентрация непродиссоциировавшего NH4OH равна: С(NH4OH) = (C0–x) = (0,1–x) моль/л.
Подставляем выраженные через x равновесные концентрации всех частиц в уравнение константы диссоциации:
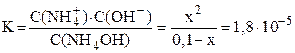
Очень слабые электролиты диссоциируют незначительно (x ® 0) и иксом в знаменателе как слагаемым можно пренебречь:
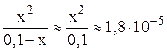
Обычно в задачах общей химии иксом в знаменателе пренебрегают в том случае, если 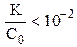
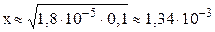
С(OH – ) = x = 1,34∙10 -3 моль/л; pOH = –lg C(OH – ) = –lg 1,34∙10 –3 = 2,87.
pH = 14 – pOH = 14 – 2,87 = 11,13.
Степень диссоциации электролита можно рассчитать как отношение концентрации продиссоциировавшего электролита (x) к общей концентрации электролита (C0):
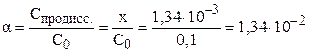
Пример 7.4 Рассчитать pH 30% раствора фосфорной кислоты (плотность раствора 1,18 г/мл. Чему равна степень диссоциации электролита в этом растворе?
Сначала следует перевести процентную концентрацию в молярную (см. пример 5.1). В данном случае C0(H3PO4) = 3,6 моль/л.
Расчёт концентрации ионов водорода в растворах многоосновных слабых кислот, проводится только по первой стадии диссоциации. Строго говоря, общая концентрация ионов водорода в растворе слабой многоосновной кислоты равна сумме концентраций ионов H + , образовавшихся на каждой стадии диссоциации. Например, для фосфорной кислоты C(H + )общая = C(H + )по 1 стадии + C(H + )по 2 стадии + C(H + )по 3 стадии . Однако, диссоциация слабых электролитов протекает преимущественно по первой стадии, а по второй и последующим стадиям – в незначительной степени, поэтому
C(H + )по 2 стадии ≈ 0, C(H + )по 3 стадии ≈ 0 и C(H + )общая ≈ C(H + )по 1 стадии .
Пусть фосфорной кислоты продиссоциировало по первой стадии x моль/л, тогда из уравнения диссоциации H3PO4 ⇆ H + + H2PO4 – следует, что равновесные концентрации ионов H + и H2PO4 – также будут равны x моль/л, а равновесная концентрация непродиссоциировавшей H3PO4 будет равна (3,6–x) моль/л. Подставляем выраженные через x концентрации ионов H + и H2PO4 – и молекул H3PO4 в выражение константы диссоциации по первой стадии (K1 = 7,5·10 –3 – справочная величина):
K1/C0 = 7,5·10 –3 / 3,6 = 2,1·10 –3 –2 ; следовательно, иксом как слагаемым в знаменателе можно пренебречь (см. также пример 7.3) и упростить полученное выражение.
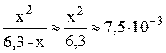
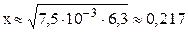
С(H + ) = x = 0,217 моль/л; pH = –lg C(H + ) = –lg 0,217 = 0,66.
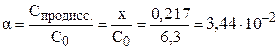
Задание №8
Рассчитайте а) pH растворов сильных кислот и оснований; б) раствора слабого электролита и степень диссоциации электролита в этом растворе (таблица 8). Плотность растворов принять равной 1 г/мл.
Таблица 8 – Условия задания №8
| № вари- анта | а | б | № вари- анта | а | б |
| 0,01М H2SO4; 1% NaOH | 0,35% NH4OH | ||||
| 0,01МCa(OH)2; 2%HNO3 | 1% CH3COOH | 0,04М H2SO4; 4% NaOH | 1% NH4OH | ||
| 0,5М HClO4; 1% Ba(OH)2 | 0,98% H3PO4 | 0,7М HClO4; 4%Ba(OH)2 | 3% H3PO4 | ||
| 0,02M LiOH; 0,3% HNO3 | 0,34% H2S | 0,06M LiOH; 0,1% HNO3 | 1,36% H2S | ||
| 0,1М HMnO4; 0,1% KOH | 0,031% H2CO3 | 0,2М HMnO4; 0,2%KOH | 0,124%H2CO3 | ||
| 0,4М HCl; 0,08%Ca(OH)2 | 0,47% HNO2 | 0,8МHCl; 0,03%Ca(OH)2 | 1,4% HNO2 | ||
| 0,05M NaOH; 0,81% HBr | 0,4% H2SO3 | 0,07M NaOH; 3,24% HBr | 1,23% H2SO3 | ||
| 0,02M Ba(OH)2; 0,13%HI | 0,2% HF | 0,05M Ba(OH)2; 2,5% HI | 2% HF | ||
| 0,02М H2SO4; 2% NaOH | 0,7% NH4OH | 0,06МH2SO4; 0,8%NaOH | 5%CH3COOH | ||
| 0,7М HClO4; 2%Ba(OH)2 | 1,96% H3PO4 | 0,08М H2SO4; 3% NaOH | 4% H3PO4 | ||
| 0,04MLiOH; 0,63%HNO3 | 0,68% H2S | 0,008M HI; 1,7%Ba(OH)2 | 3,4% H2S | ||
| 0,3МHMnO4; 0,56%KOH | 0,062% H2CO3 | 0,08M LiOH; 1,3% HNO3 | 0,2% H2CO3 | ||
| 0,6М HCl; 0,05%Ca(OH)2 | 0,94% HNO2 | 0,01M HMnO4; 1% KOH | 2,35% HNO2 | ||
| 0,03M NaOH; 1,62% HBr | 0,82% H2SO3 | 0,9МHCl; 0,01%Ca(OH)2 | 2% H2SO3 | ||
| 0,03M Ba(OH)2; 1,26%HI | 0,5% HF | 0,09M NaOH; 6,5% HBr | 5% HF | ||
| 0,03М H2SO4; 0,4%NaOH | 3% CH3COOH | 0,1M Ba(OH)2; 6,4% HI | 6%CH3COOH | ||
| 0,002M HI; 3% Ba(OH)2 | 1% HF | 0,04МH2SO4; 1,6%NaOH | 3,5% NH4OH | ||
| 0,005МHBr; 0,24% LiOH | 1,64% H2SO3 | 0,001М HI; 0,4%Ba(OH)2 | 5% H3PO4 |
Пример 7.5 Смешали 200 мл 0,2М раствора H2SO4 и 300 мл 0,1М раствора NaOH. Рассчитайте pH образовавшегося раствора и концентрации ионов Na + и SO4 2– в этом растворе.
Приведём уравнение реакции H2SO4 + 2 NaOH → Na2SO4 + 2 H2O к сокращённому ионно-молекулярному виду: H + + OH — → H2O
Из ионно-молекулярного уравнения реакции следует, что в реакцию вступают только ионы H + и OH – и образуют молекулу воды. Ионы Na + и SO4 2– в реакции не участвуют, поэтому их количество после реакции такое же как и до реакции.
Расчёт количеств веществ до реакции:
n(H + ) = 2 × n(H2SO4) = 2 × 0,02 моль = 0,04 моль;
n(NaOH) = 0,1 моль/л · 0,3 л = 0,03 моль = n(Na + ) = n(OH – ).
Ионы OH – – в недостатке; они прореагируют полностью. Вместе с ними прореагирует столько же (т.е. 0,03 моль) ионов H + .
Расчёт количеств ионов после реакции:
n(H + ) = n(H + )до реакции – n(H + )прореагировавших = 0,04 моль – 0,03 моль = 0,01 моль;
n(Na + ) = 0,03 моль; n(SO4 2– ) = 0,02 моль.
Т.к. смешиваются разбавленные растворы, то
Vобщ. » Vраствора H2SO4 + V раствора NaOH » 200 мл + 300 мл = 500 мл = 0,5 л.
C(Na + ) = n(Na + ) / Vобщ. = 0,03 моль : 0,5 л = 0,06 моль/л;
C(H + ) = n(H + ) / Vобщ. = 0,01 моль : 0,5 л = 0,02 моль/л;
pH = –lg C(H + ) = –lg 2·10 –2 = 1,699.
Задание №9
Рассчитайте pH и молярные концентрации катионов металла и анионов кислотного остатка в растворе, образовавшемся в результате смешивания раствора сильной кислоты с раствором щёлочи (таблица 9).
Таблица 9 – Условия задания №9
| № вари- анта | Объёмы и состав растворов кислоты и щёлочи | № вари- анта | Объёмы и состав растворов кислоты и щёлочи |
| 300 мл 0,1М NaOH и 200 мл 0,2М H2SO4 | |||
| 2 л 0,05М Ca(OH)2 и 300 мл 0,2М HNO3 | 0,5 л 0,1М KOH и 200 мл 0,25М H2SO4 | ||
| 700 мл 0,1М KOH и 300 мл 0,1М H2SO4 | 1 л 0,05М Ba(OH)2 и 200 мл 0,8М HCl | ||
| 80 мл 0,15М KOH и 20 мл 0,2М H2SO4 | 400мл 0,05М NaOH и 600мл 0,02М H2SO4 | ||
| 100 мл 0,1М Ba(OH)2 и 20 мл 0,5М HCl | 250 мл 0,4М KOH и 250 мл 0,1М H2SO4 | ||
| 700мл 0,05М NaOH и 300мл 0,1М H2SO4 | 200мл 0,05М Ca(OH)2 и 200мл 0,04М HCl | ||
| 50 мл 0,2М Ba(OH)2 и 150 мл 0,1М HCl | 150мл 0,08М NaOH и 350мл 0,02М H2SO4 | ||
| 900мл 0,01М KOH и 100мл 0,05М H2SO4 | 600мл 0,01М Ca(OH)2 и 150мл 0,12М HCl | ||
| 250 мл 0,1М NaOH и 150 мл 0,1М H2SO4 | 100 мл 0,2М Ba(OH)2 и 50 мл 1М HCl | ||
| 1 л 0,05М Ca(OH)2 и 500 мл 0,1М HNO3 | 100 мл 0,5М NaOH и 100 мл 0,4М H2SO4 | ||
| 100 мл 1М NaOH и 1900 мл 0,1М H2SO4 | 25 мл 0,1М KOH и 75 мл 0,01М H2SO4 | ||
| 300 мл 0,1М Ba(OH)2 и 200 мл 0,2М HCl | 100мл 0,02М Ba(OH)2 и 150мл 0,04 М HI | ||
| 200 мл 0,05М KOH и 50 мл 0,2М H2SO4 | 1 л 0,01М Ca(OH)2 и 500 мл 0,05М HNO3 | ||
| 500мл 0,05М Ba(OH)2 и 500мл 0,15М HI | 250мл 0,04М Ba(OH)2 и 500мл 0,1М HCl | ||
| 1 л 0,1М KOH и 2 л 0,05М H2SO4 | 500 мл 1М NaOH и 1500 мл 0,1М H2SO4 | ||
| 250мл 0,4М Ba(OH)2 и 250мл 0,4М HNO3 | 200 мл 0,1М Ba(OH)2 и 300 мл 0,2М HCl | ||
| 80 мл 0,05М KOH и 20 мл 0,2М H2SO4 | 50 мл 0,2М KOH и 200 мл 0,05М H2SO4 | ||
| 300 мл 0,25М Ba(OH)2 и 200 мл 0,3М HCl | 1 л 0,03М Ca(OH)2 и 500 мл 0,1М HNO3 |
ГИДРОЛИЗ СОЛЕЙ
При растворении в воде любой соли происходит диссоциация этой соли на катионы и анионы. Если соль образована катионом сильного основания и анионом слабой кислоты (например, нитрит калия KNO2), то нитрит-ионы будут связываться с ионами H + , отщепляя их от молекул воды, в результате чего образуется слабая азотистая кислота. В результате этого взаимодействия в растворе установится равновесие:
Таким образом, в растворе соли, гидролизующейся по аниону, появляется избыток ионов OH – (реакция среды – щелочная; pH > 7).
Если соль образована катионом слабого основания и анионом сильной кислоты (например, хлорид аммония NH4Cl), то катионы NH4 + слабого основания будут отщеплять ионы OH – от молекул воды и образовывать слабодиссоциирующий электролит – гидроксид аммония 1 .
В растворе соли гидролизующейся по катиону появляется избыток ионов H + (реакция среды – кислая pH + связываются с ионами OH – , отщепляя их от молекул воды, а анионы слабой кислоты F – связываются с ионами H + , в результате чего образуется слабое основание NH4OH и слабая кислота HF: 2
Реакция среды в растворе соли, гидролизующейся и по катиону, и по аниону определяется тем, какой из образующихся в результате гидролиза малодиссоциирующих электролитов является более сильным (это можно выяснить, сравнив константы диссоциации). В случае гидролиза NH4F среда будет кислой (pH –5 –4 .
Таким образом, гидролизу (т.е. разложению водой) подвергаются соли, образованные:
– катионом сильного основания и анионом слабой кислоты (KNO2, Na2CO3, K3PO4);
– катионом слабого основания и анионом сильной кислоты (NH4NO3, AlCl3, ZnSO4);
– катионом слабого основания и анионом слабой кислоты (Mg(CH3COO)2, NH4F).
C молекулами воды взаимодействуют катионы слабых оснований или (и) анионы слабых кислот; соли образованные катионами сильных оснований и анионами сильных кислот гидролизу не подвергаются.
Гидролиз солей, образованных многозарядными катионами и анионами, протекает ступенчато; ниже на конкретных примерах показана последовательность рассуждений, которой рекомендуется придерживаться при составлении уравнений гидролиза таких солей.
 |
1. Как уже отмечалось ранее (см. примечание 2 на стр. 5) существует альтернативная точка зрения, согласно которой гидроксид аммония является сильным основанием. Кислая реакция среды в растворах солей аммония, образованных сильными кислотами, например, NH4Cl, NH4NO3, (NH4)2SO4, объясняется при таком подходе обратимо протекающим процессом диссоциации иона аммония NH4 + ⇄ NH3 + H + или, более точно NH4 + + H2O ⇄ NH3 + H3O + .
2. Если гидроксид аммония считать сильным основанием, то в растворах солей аммония, образованных слабыми кислотами, например, NH4F следует рассматривать равновесие NH4 + + F – ⇆ NH3 + HF, в котором происходит конкуренция за ион H + между молекулами аммиака и анионами слабой кислоты.
Пример 8.1 Запишите в молекулярном и ионно-молекулярном виде уравнения реакций гидролиза карбоната натрия. Укажите pH раствора (pH>7, pH + + CO3 2–
2. Соль образована катионами (Na + ) сильного основания NaOH и анионом (CO3 2– ) слабой кислоты H2CO3. Следовательно, соль гидролизуется по аниону:
Гидролиз в большинстве случаев протекает обратимо (знак ⇄); на 1 ион, участвующий в процессе гидролиза, записывается 1 молекула HOH.
3. Отрицательно заряженные карбонат ионы CO3 2– связываются с положительно заряженными ионами H + , отщепляя их от молекул HOH, и образуют гидрокарбонат ионы HCO3 – ; раствор обогащается ионами OH – (щелочная среда; pH>7):
Это ионно-молекулярное уравнение первой стадии гидролиза Na2CO3.
4. Уравнение первой стадии гидролиза в молекулярном виде, можно получить, соединив все имеющиеся в уравнении CO3 2– + HOH ⇆ HCO3 – + OH – анионы (CO3 2– , HCO3 – и OH – ) с катионами Na + , образовав соли Na2CO3, NaHCO3 и основание NaOH:
5. В результате гидролиза по первой стадии образовались гидрокарбонат ионы, которые участвуют во второй стадии гидролиза:
(отрицательно заряженные гидрокарбонат ионы HCO3 – связываются с положительно заряженными ионами H + , отщепляя их от молекул HOH).
6. Уравнение второй стадии гидролиза в молекулярном виде, можно получить, связав имеющиеся в уравнении HCO3 – + HOH ⇆ H2CO3 + OH – анионы (HCO3 – и OH – ) с катионами Na + , образовав соль NaHCO3 и основание NaOH:
В результате этих рассуждений получаем следующие уравнения гидролиза:
Пример 8.2 Запишите в молекулярном и ионно-молекулярном виде уравнения реакций гидролиза сульфата алюминия. Укажите pH раствора (pH>7, pH 3+ + 3SO4 2–
2. Соль образована катионами (Al 3+ ) слабого основания Al(OH)3 и анионами (SO4 2– ) сильной кислоты H2SO4. Следовательно, соль гидролизуется по катиону; на 1 ион Al 3+ записывается 1 молекула HOH: Al 3+ + HOH ⇆ … .
3. Положительно заряженные ионы Al 3+ связываются с отрицательно заряженными ионами OH – , отщепляя их от молекул HOH, и образуют ионы гидроксоалюминия AlOH 2+ ; раствор обогащается ионами H + (кислая среда; pH 3+ + HOH ⇆ AlOH 2+ + H + .
Это ионно-молекулярное уравнение первой стадии гидролиза Al2(SO4)3.
4. Уравнение первой стадии гидролиза в молекулярном виде, можно получить, связав все имеющиеся в уравнении Al 3+ + HOH ⇆ AlOH 2+ + H + катионы (Al 3+ , AlOH 2+ и H + ) с анионами SO4 2– , образовав соли Al2(SO4)3, AlOHSO4 и кислоту H2SO4:
5. В результате гидролиза по первой стадии образовались катионы гидроксоалюминия AlOH 2+ , которые участвуют во второй стадии гидролиза:
AlOH 2+ + HOH ⇆ Al(OH)2 + + H +
(положительно заряженные ионы AlOH 2+ связываются с отрицательно заряженными ионами OH – , отщепляя их от молекул HOH).
6. Уравнение второй стадии гидролиза в молекулярном виде, можно получить, связав все имеющиеся в уравнении AlOH 2+ + HOH ⇆ Al(OH)2 + + H + катионы (AlOH 2+ , Al(OH)2 + , и H + ) с анионами SO4 2– , образовав соли AlOHSO4, (Al(OH)2)2SO4 и кислоту H2SO4:
7. В результате второй стадии гидролиза образовались катионы дигидроксоалюминия Al(OH)2 + , которые участвуют в третьей стадии гидролиза:
(положительно заряженные ионы Al(OH)2 + связываются с отрицательно заряженными ионами OH – , отщепляя их от молекул HOH).
8. Уравнение третьей стадии гидролиза в молекулярном виде, можно получить, связав имеющиеся в уравнении Al(OH)2 + + HOH ⇆ Al(OH)3 + H + катионы (Al(OH)2 + и H + ) с анионами SO4 2– , образовав соль (Al(OH)2)2SO4 и кислоту H2SO4:
В результате этих рассуждений получаем следующие уравнения гидролиза:
Пример 8.3 Запишите в молекулярном и ионно-молекулярном виде уравнения реакций гидролиза ортофосфата аммония. Укажите pH раствора (pH>7, pH + + PO4 3–
2. Соль образована катионами (NH4 + ) слабого основания NH4OH и анионами
(PO4 3– ) слабой кислоты H3PO4. Следовательно, соль гидролизуется и по катиону, и по аниону: NH4 + + PO4 3– +HOH ⇆ … ; (на одну пару ионов NH4 + и PO4 3– в данном случае записывается 1 молекула HOH). Положительно заряженные ионы NH4 + связываются с отрицательно заряженными ионами OH – , отщепляя их от молекул HOH, образуя слабое основание NH4OH, а отрицательно заряженные ионы PO4 3– связываются с ионами H + , образуя гидрофосфат ионы HPO4 2– :
Это ионно-молекулярное уравнение первой стадии гидролиза (NH4)3PO4.
4. Уравнение первой стадии гидролиза в молекулярном виде, можно получить, связав имеющиеся в уравнении NH4 + + PO4 3– + HOH ⇆ NH4OH + HPO4 2– анионы (PO4 3– , HPO4 2– ) с катионами NH4 + , образовав соли (NH4)3PO4, (NH4)2HPO4:
5. В результате гидролиза по первой стадии образовались гидрофосфат анионы HPO4 2– , которые вместе с катионами NH4 + участвуют во второй стадии гидролиза:
(ионы NH4 + связываются с ионами OH – , ионы HPO4 2– – с ионами H + , отщепляя их от молекул HOH, образуя слабое основание NH4OH и дигидрофосфат ионы H2PO4 – ).
6. Уравнение второй стадии гидролиза в молекулярном виде, можно получить, связав имеющиеся в уравнении NH4 + + HPO4 2– + HOH ⇆ NH4OH + H2PO4 – анионы (HPO4 2– и H2PO4 – ) с катионами NH4 + , образовав соли (NH4)2HPO4 и NH4H2PO4:
7. В результате второй стадии гидролиза образовались дигидрофосфат анионы H2PO4 – , которые вместе с катионами NH4 + участвуют в третьей стадии гидролиза:
(ионы NH4 + связываются с ионами OH – , ионы H2PO4 – – с ионами H + , отщепляя их от молекул HOH и образуют слабые электролиты NH4OH и H3PO4).
8. Уравнение третьей стадии гидролиза в молекулярном виде, можно получить, связав присутствующие в уравнении NH4 + + H2PO4 – + HOH ⇆ NH4OH + H3PO4 анионы H2PO4 – и катионами NH4 + и образовав соль NH4H2PO4:
В результате этих рассуждений получаем следующие уравнения гидролиза:
Процесс гидролиза протекает преимущественно по первой стадии, поэтому реакция среды в растворе соли, гидролизующейся и по катиону, и по аниону определяется тем, какой из малодиссоциирующих электролитов, образующихся на первой стадии гидролиза, является более сильным. В рассматриваемом случае
реакция среды будет щелочной (pH>7), поскольку ион HPO4 2– – более слабый электролит, чем NH4OH: KNH4OH = 1,8·10 –5 > KHPO4 2– = KIII H3PO4 = 1,3×10 –12 (диссоциация иона HPO4 2– – это диссоциация H3PO4 по третьей стадии, поэтому KHPO4 2– = KIII H3PO4).
Задание №10
Запишите в молекулярном и ионно-молекулярном виде уравнения реакций гидролиза солей (таблица 10). Укажите pH раствора (pH>7, pH
ЧТО ТАКОЕ УВЕРЕННОЕ ПОВЕДЕНИЕ В МЕЖЛИЧНОСТНЫХ ОТНОШЕНИЯХ? Исторически существует три основных модели различий, существующих между.
ЧТО И КАК ПИСАЛИ О МОДЕ В ЖУРНАЛАХ НАЧАЛА XX ВЕКА Первый номер журнала «Аполлон» за 1909 г. начинался, по сути, с программного заявления редакции журнала.
Что делать, если нет взаимности? А теперь спустимся с небес на землю. Приземлились? Продолжаем разговор.
ЧТО ПРОИСХОДИТ ВО ВЗРОСЛОЙ ЖИЗНИ? Если вы все еще «неправильно» связаны с матерью, вы избегаете отделения и независимого взрослого существования.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
Водородный показатель кислотности (рН)
Водородный показатель, pH (лат. pondus Hydrogenii — «вес водорода», произносится «пэ аш») — мера активности (в сильно разбавленных растворах эквивалентна концентрации) ионов водорода в растворе, которая количественно выражает его кислотность. Равен по модулю и противоположен по знаку десятичному логарифму активности водородных ионов, которая выражена в молях на один литр:

История водородного показателя pH .
Понятие водородного показателя введено датским химиком Сёренсеном в 1909 году. Показатель называется pH (по первым буквам латинских слов potentia hydrogeni — сила водорода, либо pondus hydrogeni — вес водорода). В химии сочетанием pX обычно обозначают величину, которая равна lg X, а буквой H в этом случае обозначают концентрацию ионов водорода (H + ), либо, вернее, термодинамическую активность гидроксоний-ионов.
Уравнения, связывающие pH и pOH .
Вывод значения pH .
В чистой воде при 25 °C концентрации ионов водорода ([H + ]) и гидроксид-ионов ([OH − ]) оказываются одинаковыми и равняются 10 −7 моль/л, это четко следует из определения ионного произведения воды, равное [H + ] · [OH − ] и равно 10 −14 моль²/л² (при 25 °C).
Если концентрации двух видов ионов в растворе окажутся одинаковыми, в таком случае говорится, что у раствора нейтральная реакция. При добавлении кислоты к воде, концентрация ионов водорода возрастает, а концентрация гидроксид-ионов понижается, при добавлении основания — напротив, увеличивается содержание гидроксид-ионов, а концентрация ионов водорода уменьшается. Когда [H + ] > [OH − ] говорится, что раствор оказывается кислым, а при [OH − ] > [H + ] — щелочным.
Чтоб было удобнее представлять, для избавления от отрицательного показателя степени, вместо концентраций ионов водорода используют их десятичный логарифм, который берется с противоположным знаком, являющийся водородным показателем — pH.

Показатель основности раствора pOH .
Немного меньшую популяризацию имеет обратная pH величина — показатель основности раствора, pOH, которая равняется десятичному логарифму (отрицательному) концентрации в растворе ионов OH − :
как во всяком водном растворе при 25 °C 

Значения pH в растворах различной кислотности.
- Вразрез с распространённым мнением, pH может изменяться кроме интервала 0 — 14, также может и выходить за эти пределы. Например, при концентрации ионов водорода [H + ] = 10 −15 моль/л, pH = 15, при концентрации ионов гидроксида 10 моль /л pOH= −1.
Т.к. при 25 °C (стандартных условиях) [H + ] [OH − ] = 10 −14 , то ясно, что при такой температуре pH + pOH = 14.
Т.к. в кислых растворах [H + ] > 10 −7 , значит, у кислых растворов pH 7, pH нейтральных растворов равняется 7. При более высоких температурах константа электролитической диссоциации воды увеличивается, значит, увеличивается ионное произведение воды, тогда нейтральной будет pH = 7 (что соответствует одновременно возросшим концентрациям как H + , так и OH − ); с понижением температуры, наоборот, нейтральная pH увеличивается.
Методы определения значения pH .
Существует несколько методов определения значения pH растворов. Водородный показатель приблизительно оценивают при помощи индикаторов, точно измерять при помощи pH-метра либо определять аналитическим путём, проводя кислотно-основное титрование.
- Для грубой оценки концентрации водородных ионов часто используют кислотно-основные индикаторы — органические вещества-красители, цвет которых зависит от pH среды. Самые популярные индикаторы: лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и др. Индикаторы могут быть в 2х по-разному окрашенных формах — или в кислотной, или в основной. Изменение цвета всех индикаторов происходит в своём интервале кислотности, зачастую составляющем 1–2 единицы.
- Для увеличения рабочего интервала измерения pH применяют универсальный индикатор, который является смесью из нескольких индикаторов. Универсальный индикатор последовательно изменяет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислой области в щелочную. Определения pH индикаторным способом затруднено для мутных либо окрашенных растворов.
- Применение специального прибора — pH-метра — дает возможность измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем при помощи индикаторов. Ионометрический метод определения pH основывается на измерении милливольтметром-ионометром ЭДС гальванической цепи, которая включает стеклянный электрод, потенциал которого зависим от концентрации ионов H + в окружающем растворе. Способ обладает высокой точностью и удобством, особенно после калибровки индикаторного электрода в избранном диапазоне рН, что дает измерять pH непрозрачных и цветных растворов и поэтому часто применяется.
- Аналитический объёмный метод — кислотно-основное титрование — тоже даёт точные результаты определения кислотности растворов. Раствор известной концентрации (титрант) каплями добавляют к раствору, который исследуется. При их смешивании происходит химическая реакция. Точка эквивалентности — момент, когда титранта точно хватает, для полного завершения реакции, — фиксируется при помощи индикатора. После этого, если известна концентрация и объём добавленного раствора титранта, определяется кислотность раствора.
- Влияние температуры на значения pH:
0,001 моль/Л HCl при 20 °C имеет pH=3, при 30 °C pH=3,
0,001 моль/Л NaOH при 20 °C имеет pH=11,73, при 30 °C pH=10,83,
Влияние температуры на значения pH объясняют разчной диссоциацией ионов водорода (H + ) и не есть ошибкой эксперимента. Температурный эффект нельзя компенсировать за счет электроники pH-метра.
Роль pH в химии и биологии.
Кислотность среды имеет важное значение для большинства химических процессов, и возможность протекания либо результат той или иной реакции зачастую зависит от pH среды. Для поддержания определённого значения pH в реакционной системе при проведении лабораторных исследований либо на производстве применяют буферные растворы, позволяющие сохранять почти постоянное значение pH при разбавлении либо при добавлении в раствор маленьких количеств кислоты либо щёлочи.
Водородный показатель pH часто применяют для характеристики кислотно-основных свойств разных биологических сред.
Для биохимических реакций сильное значение имеет кислотность реакционной среды, протекающих в живых системах. Концентрация в растворе ионов водорода зачастую оказывает влияние на физико-химические свойства и биологическую активность белков и нуклеиновых кислот, поэтому для нормального функционирования организма поддержание кислотно-основного гомеостаза является задачей исключительной важности. Динамическое поддержание оптимального pH биологических жидкостей достигается под действием буферных систем организма.
В человеческом организме в разных органах водородный показатель оказывается разным.
Некоторые значения pH.
Расчёт pH в растворах слабых (средних) кислот и оснований.
Слабые (и средние) электролиты в водных растворах диссоциируют не полностью, равновесие в этих растворах описывается с помощьюконстант диссоциации (ионизации):
КА — константы кислотности и КВ. — константы основности, которые связаны со степенью диссоциации (a) законом разбавления Оствальда:
 |
Для электролитов, степень диссоциации которых меньше 5% при концентрации более 10 моль/дм 
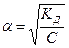 |
Расчёты рН в таком случае ведут по формулам:
Для слабой кислоты:
[Н + ]= a • Cна = 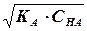 Þ рН =- lg Þ рН =- lg 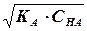 |
Для слабого основания:
[OН — ]= a • CB =  Þ рОН =- lg Þ рОН =- lg   Þ pH = 14 – pOH или [Н + ] = Kw/ [ОН — ] Þ pH – lg[H + ] Þ pH = 14 – pOH или [Н + ] = Kw/ [ОН — ] Þ pH – lg[H + ] |
Примеры решения задач по расчёту рН растворов слабых кислот и оснований.
Пример 8.Вычислить рН 0,001 Н уксусной кислоты, если 
Решение:
Пример 9.Определить:
А) рН 0,01н СН3СООН, если
В) рН 0,01н NH4OH, если
Решение: Представив уравнение 

таким образом для одноосновной кислоты
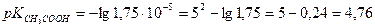


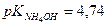
Пример 10. Концентрация ионов Н + в растворе равна 2 . 10 -4 моль/дм 
Решение:

Пример 11.Вычислить рН раствора, в 500мл которого растворено 2г NaOH.
Решение:
РН=14-рСоснов;
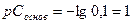
Пример 12. Рассчитать рН 0,01 моль/дм 3 раствора аммиака, КNH3*Н2O = 1,76*10 -5 .
Решение.
В водном растворе аммиака имеет место равновесие
Поскольку раствор аммиака — слабое основание и KB -4 , то расчёт ведут следующим образом:
[OH — ] =
рОН= — lg [ОН — ] = — lg 4,2 • 10-3 = 3- 0,623= 2,38
pH = 14- рОН = 14 — 2,38= 11,62
Пример 13. Степень диссоциации СН3СООН в 0,1 моль/дм 3 растворе равна 1,32*10 -3 . Вычислить концентрации ионов Н + и СНзСОO — , pH раствора и Кд кислоты.
Решение.
Записывают уравнение диссоциации уксусной кислоты
СН3СООН — слабая кислота, поэтому
[H=] = a*CH3COOH = 1,32*10 -2 *0,1 = 1,32*10 -3 моль/дм 3
pH= — lg [H + ]= — lg 1,32 • 10 -3 = 3 — 0,12 = 2,88 [Н + ] = [СН3СОО — ] = 1,32*10 -3 моль/дм 3
Из закона разбавления Оствальда 
КСН3СООН = a 2 * ССН3СООН = (1.32*10 -2 ) 2 • 0,1 = 1,74 *10 -5
Задачи:
Расчет концентрации ионов и ионной силы в растворах сильных электролитов
1. Считая диссоциацию полной, вычислить концентрации ионов:
2. Вычислить ионную силу в растворах:
0,3 М хлорида бария, 0,06 М ортофосфата калия, 0,02 М сульфата алюминия.
3. Рассчитать ионную силу раствора, содержащего в 1 дм 
4. Рассчитать коэффициент активности и активность иона Сl — в 0,015 М растворе хлорида цинка.
Ответ: (0,82; 2,45•10 
5. Вычислить активность ионов Na + ,H + ,SO4 2- в растворе с концентрацией 2•10 

Ответ: (3,16*10 


6. После растворения хлорида калия, сульфата магния и сульфата железа (III) в воде молярная концентрация этих солей равна соответственно: 0,05; 0,02 и 0,01 моль/дм 3 . Вычислить ионную силу раствора.
Расчет концентрации ионов, рН и РОН в растворах слабых электролитов:
7. Вычислить рН 0,01н раствора гидроокиси аммония, степень диссоциации которой равна 0,1.
8. Активная кислотность желудочного сока равна 0,047. Найти рН желудочного сока.
9. Найти рН молочной кислоты, константа диссоциации которой равна 1,44 . 10 -4 , С=0,01.
10.Вычислить рН раствора азотной кислоты, если массовая доля кислоты в растворе равна 4% ( 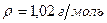
11.Вычислить концентрацию и число ионов водорода в крови объёмом 100мл,если рН крови=7,36.
12.К 99 мл воды добавили 1 мл 0,1н NaOH. Как изменилось значение рН ? Ответ: 7-11
13. Вычислить концентрацию гидроксид-ионов при температуре 20 0 С, если концентрация ионов водорода равна 2 . 10 -4 г-ион/дм 

14.Вычислить рН и рОН 0,001 моль/дм 3 раствора хлороводородной кислоты с учётом ионной силы раствора.
15.Сколько граммов гидроксида натрия потребуется для приготовления 500 см 
16.Вычислить рН 0,02 моль/дм 3 раствора серной кислоты, считая её диссоциацию на ионы полной. (Ответ: 1,40)
17 Рассчитать рН раствора гидроксида калия с массовой долей 0,19%. (12,53)
18 Вычислить активность гидроксид-ионов и ран + в 0,01 моль/дм 3 растворе гидроксида калия. (Ответ: 9*10 моль/дм 3 ; 11,95)
19 Вычислить концентрации ионов водорода и гидроксид-ионов в растворе хлороводородной кислоты при рН 4.
(Ответ: 10 моль/дм 3 ;10 моль/дм 3 )
20 Рассчитать рН 0,60%-ного раствора уксусной кислоты. (Ответ: 2,38)
21 Вычислить рН 0,1 моль/дм 

22 Чему равна степень диссоциации 0,01 моль/дм 3 водного раствора уксусной кислоты, если КснзСООН = 1,76*10 -5 ? (4,2 * 10 
23 Вычислить рН 10%-ного раствора аммиака. Ответ: (11,71)
24 Найти концентрацию водородных ионов в 2М,0,5М и 0,2М растворе уксусной кислоты (Кд = 1,8 10 -5 ).
http://www.calc.ru/214.html
http://lektsii.org/15-26284.html