Как определить уксусную кислоту
Уксусная, или этановая кислота – это органическое соединение класса одноосновных карбоновых кислот. Производные данного вещества называются ацетатами. В разведенном виде кислота имеется практически на каждой кухне в качестве столового 6 % или 9 % уксуса. Его используют для приготовления разнообразных салатов, маринадов, кондитерских изделий, а также при консервировании овощей.
- Как определить уксусную кислоту
- Как определить ацетат натрия
- Как распознать растворы в пробирках

Вопрос «И всё-таки! Что появилось первым? «Яйцо или курица?»» — 13 ответов
Вам понадобится
- — пробирки;
- — трубка-холодильник;
- — индикаторы;
- — уксусная кислота;
- — изопентиловый спирт;
- — серная кислота;
- — гидроксид натрия;
- — хлорид железа (III).
Инструкция
Основным признаком, по которому можно определить, что в емкости находится уксусная кислота, является характерный запах уксуса. Чтобы ощутить запах, откройте склянку и сделайте над ней несколько поступательных движений воздуха ладонью к себе. Ни в коем случае нельзя нюхать летучую жидкость, низко наклонившись над емкостью, так как это может привести к ожогу слизистых оболочек дыхательных путей.

Все соединения класса кислот имеют в своем составе атомы водорода, которые в водном растворе и обусловливают кислые свойства. Поэтому данное вещество можно определить с помощью индикаторов. Для этого возьмите 4 пробирки, налейте в каждую по 1 мл кислоты и опустите в них индикаторы (прилейте, если они в виде растворов). Лакмус в кислой среде становится красным, фенолфталеин свою окраску не меняет, а метиловый оранжевый приобретает насыщенный розово-красный цвет. В 4 пробирку опустите универсальный индикатор, который станет в растворе фиолетово-красным цветом. Сравните окраску по шкале, которая имеется в каждой упаковке и увидите, что она соответствует кислой среде.
Проведите реакцию на наличие ацетат-иона. Для этого возьмите пробирку, налейте в нее 2 мл разбавленной уксусной кислоты, добавьте 1 мл гидроксида натрия. Получится растворимая соль — ацетат натрия. Теперь добавьте к полученной смеси несколько капель раствора хлорида железа (III) – появится красная окраска. Нагрейте смесь, после чего в результате реакции гидролиза выпадет бурый осадок. Это свидетельствует о наличие ацетат-ионов.
Возьмите пробирку, поместите в нее 2 мл исследуемого вещества, добавьте 2 мл изопентилового спирта. Прилейте в смесь 1 мл концентрированной серной кислоты. Закройте пробирку трубкой-холодильником и нагрейте смесь. В результате взаимодействия появляется приятный запах груши за счет образования сложного эфира.
Обратите внимание При выполнении работы соблюдайте правила техники безопасности.
Совет 2: Как распознать уксусную кислоту
Уксусная кислота — незаменимая вещь на кухне. Она используется как в повседневном приготовлении пищи, так и для маринадов и прочих вкусных вещей. Некоторые хозяйки используют ее для очищения приборов от накипи и в других хозяйственных целях. Распознать уксусную кислоту очень просто, да и перепутать ее никак не получится.
Инструкция
Запах — характерное отличие уксусной кислоты. Он очень резкий и шибает в нос. Не нюхайте бутылек с концентрированным уксусом близко, поднесите его в 10-15 см от носа. Если вы близко понюхаете, испарения, идущие от жидкости, могут сжечь дыхательные пути и проблем будет очень много. Старайтесь не капнуть и на кожу рук — будет ожег.
Уксусная кислота горит. Налейте немного жидкости в маленькую тарелочку и поднесите спичку, но будьте осторожны, вы можете обжечься. Горение примерно такое же, как и у обычного спирта. По мере испарения оно прекращается. Если возгорание не произошло, у вас, либо яблочный уксус, либо какая-то другая жидкость, либо кислота разбавленная.
Характерный кислый вкус говорит сам за себя. Но не пробуйте кислоту прямо из бутылочки, вы можете получить сильный ожег пищевода. Налейте чайную ложечку в стакан и разбавьте минимум на 20 частей чистой водой. Затем можете попробовать, вы должны ощутить кислый вкус и резковатый запах. В разведенном виде ее используют для приготовления различных соусов.
К сожалению, в домашних условиях не провести каких-либо экспериментов для более точного определения вещества. Поэтому другие эксперименты оставьте для профессиональных лаборантов. Ну и, конечно, не употребляйте вещество внутрь, если вы в чем-то сомневаетесь. Уксусная кислота очень дешево стоит, поэтому лучше купите новую, чем вы отравитесь непонятным составом.
Совет 3: Как определить кислоту
Чаще всего кислота – это прозрачная жидкость, не обладающая запахом. Как же определить, какая кислота стоит перед нами? Ответ на этот вопрос нам поможет найти аналитическая химия. В качестве примера рассмотрим, как же распознать наиболее часто встречающиеся кислоты: азотную, серную и соляную.
Вам понадобится
- Для определения кислоты нам в первую очередь необходима таблица растворимости кислот, а также реактивы.
Инструкция
Итак, перед нами стоят три одинаковые пробирки с кислотами. Чтобы понять, в какой пробирке какая кислота находится, обратимся к таблице растворимости и подберем реакции, сопровождаемые выпадением осадка, изменением цвета раствора, либо выделением газа, характерные только для одной исследуемой кислоты.
Мы видим, что серная кислота выпадает в осадок при взаимодействии с ионами бария, а остальные две кислоты – нет. Отливаем по несколько миллилитров исследуемых кислот в чистые пробирки. Добавляем к ним несколько миллилитров основания бария Ba(OH)2. В одной из пробирок выпадает белый мутный осадок. Отлично, мы определили, где находится серная кислота!
Изучаем таблицу дальше. Как мы видим, хлорид серебра дает осадок, а нитрат — нет. Отливаем еще несколько миллилитров исследуемых кислот в чистые пробирки. В каждую пробирку добавляем немного AgNO3. В пробирке, где находилась соляная кислота, начинает образовываться осадок белого цвета, в дальнейшем застывая в виде полупрозрачного налета, называемого роговым серебром. В пробирке с азотной кислотой не происходит никаких изменений.
Видео по теме Полезный совет Таким образом, пользуясь таблицей растворимости кислот, можно придумать способ, как определить любую кислоту.
Уксусная кислота. Химико-токсикологический анализ
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Уксусная кислота. Химико-токсикологический анализ
Уксусная кислота (этановая кислота) СН3СООН – бесцветная прозрачная жидкость с резким запахом. Для безводной («ледяной») т.пл. 16,64 °С, т. кип. 117,8 °С. Смешивается со многими растворителями, хорошо растворяет органические соединения.
Уксусная кислота – один из главных промежуточных метаболитов, выполняющих как структурную, так и энергетическую функцию в обмене веществ.
Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей, растворы (концентрация выше 30 % по массе) при соприкосновении с кожей вызывают ожоги.
Уксусная кислота используется в пищевой, химической промышленности, в фармации.
Химико-токсикологическое исследование на наличие уксусной кислоты проводят при специальных заданиях или при наличии соответствующих указаний в материалах делах.
Уксусная кислота. Изолирование.
Уксусную кислоту отгоняют из объектов биологического происхождения, подкисленных 10 % кислоты серной или фосфорной. Дистиллят собирают в сосуд, содержащий 0,1 моль/л раствор натрия гидроксида, ввиду летучести уксусной кислоты. Количество уксусной кислоты определяют оттитровывая кислотой избыток натрия гидроксида.
Уксусная кислота. Качественное обнаружение
1. Реакция с хлоридом железа (III)
Появляется красная окраска. При нагревании окрашенного раствора происходит гидролиз, в результате которого выпадает бурый осадок.
Чувствительность реакции 1,25 мг.
2. Реакция этерификации (образования этилацетата) реакция протекает при нагревании с серной кислотой.
Появляется специфический запах этилацетата.
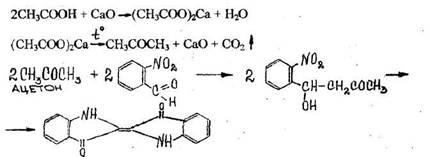
3. Реакция образования индиго
При нагревании уксусной кислоты с солями кальция образуется ацетон, который подвергается конденсации с о-нитробензальдегидом.
Отверстие пробки накрывают фильтровальной бумагой ,смоченной свежеприготовленным раствором о-нитробензальдегида в 5% растворе гидроксида натрия. Затем пробирку нагревают до прокаливания ее содержимого. На бумаге появляется синее пятно (окраска индиго).
Чувствительность реакции 10 мг.
- Реакция образования окиси какодила, обладающего неприятным запахом
Уксусная кислота: химическая формула, свойства и применение
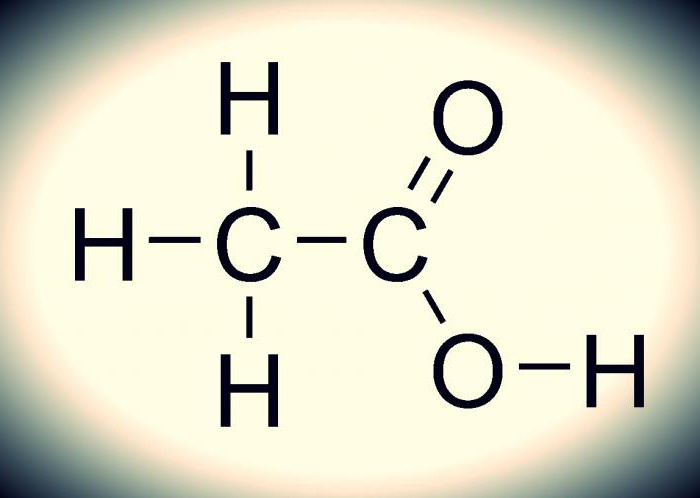
Этановая кислота больше известна как уксусная. Она представляет собой органическое соединение с формулой CH3COOH. Относится к классу карбоновых кислот, молекулы которых содержат функциональные одновалентные карбоксильные группы COOH (либо одну, либо несколько). О ней можно представить много информации, но сейчас вниманием стоит отметить лишь самые интересные факты.
Формула
Как она выглядит, можно понять по приложенному ниже изображению. Химическая формула уксусной кислоты несложная. Это обуславливается многим: само соединение является одноосновным, да и относится оно к карбоксильной группе, для которой характерно легкое отщепление протонов (стабильная элементарная частица). Данное соединение – типичный представитель карбоновых кислот, поскольку оно обладает всеми их свойствами.
Связь между кислородом и водородом (−COOH) — сильнополярная. Это обуславливает легкий процесс диссоциации (растворения, распада) данных соединений и проявление их кислотных свойств.
В итоге образуется протон H + и ацетат-ион CH3COO − . Что представляют собой эти вещества? Ацетат-ион – это лиганд, связанный с определенным акцептором (объектом, получающим что-то от донорского соединения), образующий устойчивые ацетатные комплексы с катионами многих металлов. А протон – это, как уже говорилось выше, частица, способная захватывать электрон с электронной М-, К- или L- оболочками атома.
Качественный анализ
Он основан именно на диссоциации уксусной кислоты. Качественный анализ, также называемый реакцией, представляет собой совокупность физических и химических методов, которые применяются для обнаружения соединений, радикалов (независимые молекулы и атомы) и элементов (совокупности частиц), которые входят в состав анализируемого вещества.
С помощью данного способа удается обнаружить соли уксусной кислоты. Выглядит все не так сложно, как может казаться. В раствор добавляют сильную кислоту. серную, например. И если появляется запах уксусной кислоты, то ее соль в растворе присутствует. Как это работает? Остатки уксусной кислоты, которые образуются из соли, связываются в тот момент с катионами водорода от серной. Каков результат? Появление большего количества молекул уксусной кислоты. Диссоциация так и происходит.
Реакции
Следует отметить, что обсуждаемое соединение способно взаимодействовать с активными металлами. К таковым относится литий, натрий, калий, рубидий, франций, магний, цезий. Последний, кстати, является наиболее активным. Что происходит в момент таких реакций? Выделяется водород, и происходит образование пресловутых ацетатов. Вот как выглядит химическая формула уксусной кислоты, вступившей в реакцию с магнием: Mg + 2СН3СООН → (СН3СОО)2Mg + Н2↑.
Есть способы получения дихлоруксусной (CHCl2COOH) и трихлоруксусной (CCl3COOH) кислот. В них атомы водорода метильной группы замещены хлорными. Способа их получения всего два. Один заключается в гидролизе трихлорэтилена. И он менее распространен, чем другой, основанный на способности уксусной кислоты хлорироваться действием газообразного хлора. Данный метод проще и эффективней.
Вот как этот процесс выглядит в виде химической формулы уксусной кислоты, взаимодействующей с хлором: СН3СООН + Cl2 → СН2CLCOOH + HCL. Только стоит уточнить один момент: так получается просто хлоруксусная кислота, две вышеупомянутые образуются с участием красного фосфора в небольших количествах.
Другие превращения
Стоит отметить, что уксусная кислота (CH3COOH) способна вступать во все реакции, которые являются характерными для пресловутой карбоновой группы. Ее можно восстановить до этанола, одноатомного спирта. Для этого необходимо воздействовать на нее алюмогидридом лития – неорганическим соединением, которое является мощным восстановителем, часто применяемым в органическом синтезе. Его формула – Li(AlH4).
Также уксусную кислоту можно превратить в хлорангидрид – активный ацилирующий агент. Происходит это под воздействием тионилхлорида. Он, кстати, является хлорангидридом сернистой кислоты. Ее формула – H2SO3. Стоит еще отметить, что натриевая соль уксусной кислоты при нагревании со щелочью декарбоксилируется (молекула диоксида углерода исключается), в результате чего образуется метан (CH₄). А он, как известно, представляет собой простейший углеводород, являющийся легче воздуха.
Кристаллизация
Ледяная уксусная кислота – нередко рассматриваемое соединение называют именно так. Дело в том, что она при охлаждении всего до 15-16 °C переходит в кристаллическое состояние, как будто бы замерзает. Визуально это действительно очень похоже на лед. При наличии нескольких ингредиентов можно провести эксперимент, результатом которого станет превращение уксусной кислоты в ледяную. Все просто. Из воды и льда нужно приготовить охлаждающую смесь, а потом опустить в нее подготовленную заранее пробирку с уксусной кислотой. Через несколько минут она кристаллизуется. Кроме соединения, для этого нужен химический стакан, штатив, термометр и пробирка.
Вред вещества
Уксусная кислота, химическая формула и свойства которой были перечислены выше, является небезопасной. Ее пары оказывают раздражающее действие на слизистые оболочки верхних дыхательных путей. Порог для восприятия запаха этого соединения, находящегося в воздухе, находится в районе 0,4 мг/л. Но есть еще понятие предельно допустимой концентрации – санитарно-гигиенический норматив, утвержденный в законодательном порядке. Согласно ему, в воздухе может находиться до 0,06 мг/м³ этого вещества. А если речь идет о рабочих помещениях, то предел возрастает до 5 мг/м 3 .
Губительность действия кислоты на биологические ткани напрямую зависит от того, как сильно она разбавлена водой. Наиболее опасны растворы с содержанием этого вещества более 30 %. А если человек случайно вступит в контакт с концентрированным соединением, то ему не удастся избежать химических ожогов. Этого категорически нельзя допустить, поскольку после этого начинают развиваться коагуляционные некрозы – отмирание биологических тканей. Смертельная доза составляет всего 20 мл.
Последствия
Логично, что чем выше концентрация уксусной кислоты, тем больший вред она окажет в случае попадания ее на кожу или внутрь организма. К общим симптомам отравления относят:
- Ацидоз. Кислотно-щелочной баланс смещается в сторону увеличения кислотности.
- Сгущение крови и нарушение ее свертываемости.
- Гемолиз эритроцитов, их разрушение.
- Поражение печени.
- Гемоглобинурия. В моче появляется гемоглобин.
- Острая почечная недостаточность.
- Токсический ожоговый шок.
Степени тяжести
Принято выделять три:
- Легкая. Характеризуется небольшими ожогами пищевода и ротовой полости. Но сгущение крови отсутствует, а внутренние органы продолжают функционировать нормально.
- Средняя. Наблюдается интоксикация, шок и сгущение крови. Желудок поражен.
- Тяжелая. Сильно страдают верхние дыхательные пути, стенки пищеварительного тракта, развивается почечная недостаточность. Болевой шок максимальный. Возможно развитие ожоговой болезни.
Отравление парами уксусной кислоты тоже возможно. Оно сопровождается сильным насморком, кашлем и слезотечением.
Оказание помощи
Если человек отравился уксусной кислотой, то очень важно быстро действовать для минимизирования последствий от случившегося. Рассмотрим, что надо делать:
- Прополоскать ротовую полость. Воду не проглатывать.
- Сделать зондовое промывание желудка. Потребуется 8-10 литров холодной воды. Даже кровяные примеси – не противопоказание. Потому что в первые часы отравления большие сосуды еще остаются целыми. Так что опасного кровотечения не будет. Перед промыванием нужно сделать обезболивание анальгетиками. Зонд смазывается вазелиновым маслом.
- Рвоту не вызывать! Нейтрализовать вещество можно жженой магнезией или препаратом «Альмагель».
- Нет ничего из перечисленного? Тогда пострадавшему дают лед и подсолнечное масло – надо сделать несколько глотков.
- Допустимо употребление пострадавшим смеси из молока и яиц.
Важно оказать первую помощь в течение двух часов после случившегося. По истечении данного срока слизистые оболочки сильно отекают, и уже уменьшить боль человека будет сложно. И да, ни в коем случае нельзя использовать соду. Сочетание кислоты и щелочи даст реакцию, в ходе которой выработается углекислый газ и вода. А такое образование внутри желудка может привести к летальному исходу.
Применение
Водные растворы этановой кислоты широко используются в пищевой промышленности. Это уксусы. Для их получения кислоту разводят водой, чтобы получился 3-15-процентный раствор. Как добавка они обозначаются маркировкой Е260. Уксусы входят в состав различных соусов, а еще их используют для консервирования продуктов, маринования мяса и рыбы. В быту они широко применимы для удаления накипи, пятен с одежды и посуды. Уксус – прекрасный дезинфектор. Им можно обработать любую поверхность. Иногда его добавляют при стирке, чтобы смягчить одежду.
Также уксус применим в получении душистых веществ, лекарственных средств, растворителей, в производстве ацетона и ацетилцеллюлозы, например. Да, и в крашении и книгопечатании уксусная кислота принимает непосредственное участие.
Кроме всего, ее используют как реакционную среду для проведения окисления самых разных органических веществ. Примером из промышленности можно считать окисление параксилола (углеводород ароматического ряда) кислородом воздуха в терефталевую ароматическую кислоту. Кстати, так как пары этого вещества имеют резкий раздражающий запах, его можно использовать как замену нашатырного спирта для выведения человека из обморочного состояния.
Синтетическая уксусная кислота
Это легковоспламеняющаяся жидкость, которая относится к веществам третьего класса опасности. Она используется в промышленности. При работе с ней применяются индивидуальные средства защиты. Хранят это вещество в особых условиях и только в определенной таре. Как правило, это:
- чистые железнодорожные цистерны;
- контейнеры;
- автоцистерны, бочки, емкости из нержавеющей стали (вместимость до 275 дм 3 );
- стеклянные бутыли;
- полиэтиленовые бочки вместимостью до 50 дм 3 ;
- герметичные резервуары из нержавеющей стали.
Если жидкость хранят в полимерной таре, то это как максимум месяц. Также категорически не допускается совместное хранение данного вещества с такими сильными окислителями, как перманганат калия, серная и азотная кислоты.
Состав уксуса
О нем тоже стоит сказать пару слов. В состав традиционного, всем привычного уксуса входят следующие кислоты:
- Яблочная. Формула: НООССН₂СН(ОН)СООН. Является распространенной пищевой добавкой (Е296) природного происхождения. Содержится в незрелых яблоках, малине, рябине, барбарисе и винограде. В табаке и махорке представлена в виде солей никотина.
- Молочная. Формула: CH₃CH(OH)COOH. Формируется при распаде глюкозы. Пищевая добавка (Е270), которую получают молочнокислым брожением.
- Аскорбиновая. Формула: C₆H₈O₆. Пищевая добавка (Е300), применяемая как антиоксидант, предотвращающий окисление продукта.
И конечно же, этановое соединение в состав уксуса тоже входит – это основа данного продукта.
Как разбавить?
Это часто задаваемый вопрос. Все видели в продаже уксусную кислоту 70 %. Ее покупают, чтобы готовить смеси для народного лечения, или для использования в качестве приправы, маринада, добавки в соус или закатку. Но нельзя применять такой мощный концентрат. Поэтому появляется вопрос о том, как развести до уксуса уксусную кислоту. Для начала нужно себя обезопасить – надеть перчатки. Затем следует подготовить чистую воду. Для растворов различных концентраций понадобится определенное количество жидкости. Какое? Что ж, смотрим на приведенную ниже таблицу и разводим уксусную кислоту с учетом данных.
Начальная концентрация уксуса 70 %
1:1,5 (соотношение – одна часть уксуса на энную часть воды)
http://farmf.ru/lekcii/uksusnaya-kislota-ximiko-toksikologicheskij-analiz/
http://www.syl.ru/article/365993/uksusnaya-kislota-himicheskaya-formula-svoystva-i-primenenie