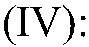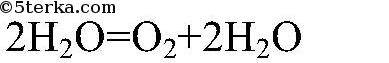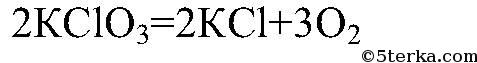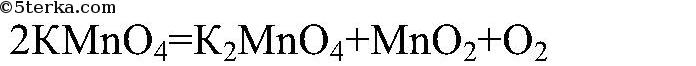Вопрос № 2 Как получают кислород в лаборатории ив промышленности? Напишите уравнения соответствующих реакций. Чем отличаются эти способы друг от друга?
Вопрос № 2 Как получают кислород в лаборатории ив промышленности? Напишите уравнения соответствующих реакций. Чем отличаются эти способы друг от друга?
В лаборатории кислород можно получить следующими способами:
1) Разложение перекиси водорода в присутствии катализатора (оксида марганца
2) Разложение бертолетовой соли (хлората калия):
3) Разложение перманганата калия:
В промышленности кислород получают из воздуха, в котором его содержится около 20% по объему. Воздух сжижают под давлением и при сильном охлаждении. Кислород и азот (второй основной компонент воздуха) имеют разные температуры кипения. Поэтому их можно разделить перегонкой: азот имеет более низкую температуру кипения, чем кислород, поэтому азот испаряется раньше кислорода.
Отличия промышленных и лабораторных способов получения кислорода:
1) Все лабораторные способы получения кислорода химические, то есть при этом происходит превращение одних веществ в другие. Процесс получения кислорода из воздуха — физический процесс, поскольку превращение одних веществ в другие не происходит.
2) Из воздуха кислорода можно получать в гораздо больших количествах.

задача №2
к главе «Глава II. Кислород. Горение Задачи к §§ 18-21 (стр. 53)».
Задание 2
Как получают кислород в лаборатории и в промышленности? Напишите уравнения соответствующих реакций. Обсудите с соседом по парте, чем различаются эти способы.
Получение кислорода в лаборатории
В школьной лаборатории чаще всего кислород получают из перманганата калия:
KMnO4 t ⟶ K2MnO4 + MnO2 + O2↑
Разложение пероксида водорода в присутствии оксида марганца (IV):
2H2O2 MnO₂ ⟶ 2H2O + O2↑
Разложение бертолетовой соли при нагревании в присутствии оксида марганца (IV):
2KClO3 MnO₂, t ⟶ 2KCl + 3O2↑
Получение кислорода в промышленности
В промышленности кислород получают из воздуха. Воздух представляет собой смесь различных газов: основные компоненты в нем – азот и кислород. Для получения кислорода воздух под давлением сжижают. Так как температура кипения жидкого азота (-196°С) ниже температуры кипения жидкого кислорода (-183°С), то азот испаряется, а жидкий кислород остается. Газообразный кислород хранят в стальных баллонах под давлением 15 МПа.
Отличие способов получения кислорода в лаборатории и в промышленности заключается в том, что в лаборатории его получают благодаря химическим процессам, а в промышленности благодаря физическим процессам.
Получение кислорода

Средняя оценка: 4.9
Всего получено оценок: 200.
Средняя оценка: 4.9
Всего получено оценок: 200.
Кислород появился в земной атмосфере с возникновением зелёных растений и фотосинтезирующих бактерий. Благодаря кислороду аэробными организмами осуществляется дыхание или окисление. Важно получение кислорода в промышленности – он используется в металлургии, медицине, авиации, народном хозяйстве и других отраслях.
Свойства
Кислород – восьмой элемент периодической таблицы Менделеева. Это газ, поддерживающий горение и осуществляющий окисление веществ.

Официально кислород был открыт в 1774 году. Английский химик Джозеф Пристли выделил элемент из оксида ртути:
Однако Пристли не знал, что кислород является частью воздуха. Свойства и нахождение в атмосфере кислорода позже уставил коллега Пристли – французский химик Антуан Лавуазье.
Общая характеристика кислорода:
- бесцветный газ;
- не имеет запаха и вкуса;
- тяжелее воздуха;
- молекула состоит из двух атомов кислорода (О2);
- в жидком состоянии имеет бледно-голубой цвет;
- плохо растворим в воде;
- является сильным окислителем.

Присутствие кислорода легко проверить, опустив в сосуд с газом тлеющую лучину. При наличии кислорода лучина вспыхивает.
Как получают
Известно несколько способов получения кислорода из различных соединений в промышленных и лабораторных условиях. В промышленности кислород получают из воздуха путём его сжижения под давлением и при температуре в -183°С. Жидкий воздух подвергают испарению, т.е. постепенно нагревают. При -196°C азот начинает улетучиваться, а кислород сохраняет жидкое состояние.
В лаборатории кислород образуется из солей, пероксида водорода и в результате электролиза. Разложение солей происходит при нагревании. Например, хлорат калия или бертолетову соль нагревают до 500°С, а перманганат калия или марганцовку – до 240°С:
- 2KClO3 → 2KCl + 3O2↑;
- 2KMnO4 → K2MnO4 + MnO2 + O2↑.
Также можно получить кислород путём нагревания селитры или нитрата калия:
При разложении пероксида водорода используется оксид марганца (IV) – MnO2, углерод или порошок железа в качестве катализатора. Общее уравнение выглядит следующим образом:
Электролизу подвергается раствор гидроксида натрия. В результате образуется вода и кислород:
Также кислород с помощью электролиза выделяют из воды, разложив её на водород и кислород:
На атомных подводных лодках кислород получали из пироксида натрия – 2Na2O2 + 2CO2 → 2Na2CO3 + O2↑. Способ интересен тем, что вместе с выделением кислорода поглощается углекислый газ.
Как применяют
Собирание и распознавание необходимо для выделения чистого кислорода, использующегося в промышленности для окисления веществ, а также для поддержания дыхания в космосе, под водой, в задымлённых помещениях (кислород необходим пожарным). В медицине баллоны кислорода помогают дышать пациентам с затруднённым дыханием. Также кислород используется для лечения респираторных заболеваний.
Кислород применяют для сжигания топлива – угля, нефти, природного газа. Кислород широко применяется в металлургии и машиностроении, например, для плавки, резки и сварки металла.
Что мы узнали?
Кислород – бесцветный газ, необходимый для дыхания и используемый в промышленности. Кислород получают путём сжижения и испарения воздуха, электролизом воды или гидроксида натрия, выделяют из солей и пероксида водорода. Кислород используется для поддержания дыхания в местах с ограниченным запасом кислорода или его отсутствием, а также в промышленности для сжигания топлива и производства металла.
http://gomolog.ru/reshebniki/8-klass/rudzitis-i-feldman-2019/22/zadanie-2.html
http://obrazovaka.ru/himiya/poluchenie-kisloroda-sposoby.html