Аммиачная вода: формула, получение, применение
Аммиачная вода находит широкое применение в качестве реагента в синтезе различных веществ, а также как удобрение в сельском хозяйстве. Наибольший эффект достигается при одновременном ее внесении в почву с органикой. Основной промышленный способ получения вещества — насыщение воды парами аммиака.
Описание
Аммиачная вода (синонимы: гидрат аммиака, гидроокись аммония) представляет собой водный раствор аммиака, в котором он присутствует в основном в виде гидроксида аммония. Концентрация аммиака обычно составляет 22 или 25 %.
Химическая формула аммиачной воды такая: NH3H2O.
По внешнему виду вещество представляет собой бесцветную или светло-желтую жидкость с резким запахом нашатырного спирта. Раствор хранят герметично укупоренным в помещениях, защищенных от воздействия атмосферы. Следует избегать контакта тары с источниками тепла и прямыми солнечными лучами.
В зависимости от целей использования это вещество выпускают двух марок:
- А — для применения в различных отраслях. Изготовление раствора производится с помощью парового конденсата или химически очищенной воды.
- Б — для нужд сельского хозяйства (более низкой степени чистоты).
Требования к техническому аммиаку марки А изложены в ГОСТ 9-92. Существует также государственный стандарт, регламентирующий характеристики этого вещества, применяемого в химии в качестве реактивов (ГОСТ 3760-79). Согласно этому документу выделяют 3 степени чистоты раствора: х. ч. (химически чистый), ч. д. а. (чистый для анализов), ч. (чистый).
Получение
Получение аммиачной воды производится несколькими способами:
- Испарением жидкого аммиака и поглощением его паров в абсорбере с жидкостным рециклом. Перед подачей в хранилище готовый продукт охлаждается низкотемпературным хладоносителем.
- Смешиванием сжиженного аммиака с водой (без его испарения) под давлением. Оба вещества подаются в смеситель при помощи насосов.
- Впрыскиванием концентрированного жидкого аммиака в реактор со скоростью до 12,5 м/с и подачей воды со скоростью до 6 м/с. Такая технология позволяет непрерывно получать гидроксид аммония.
Первый способ является наиболее распространенным. Применяемый при этом аммиак может быть получен синтетическим путем или при коксовании каменного угля в печах. Реакция синтеза обратима. В ходе образования продукта выделяется тепло, для устранения которого используют холодильники, охлаждаемые оборотной водой. В растворах гидроксид аммония находится в равновесии с аммиаком. По этой причине жидкость имеет характерный аммиачный запах.
Физические свойства
Основными физическими характеристиками этого вещества являются следующие:
- плотность аммиачной воды (25 % раствор, температура +15 ˚С) — 910-930 кг/м 3 ;
- молярная масса — 35,046 г/моль;
- давление паров аммиака (при температуре +40 ˚С) — 1 атм.;
- плотность паров — 0,59 г/см 3 ;
- температура, при которой происходит выпадение твердой фазы — -31…-53,9 ˚С;
- температура самовоспламенения — 651 ˚С.
При транспортировке и хранении аммиак способен улетучиваться, в результате наблюдается потеря азота в составе соединения.
Чугун и черные металлы, резина и алюминий устойчивы к воздействию гидроксида аммония. Цветные металлы и их сплавы при контакте с ним корродируют.
Химические свойства
К основным химическим параметрам вещества относятся:
- слабые основные свойства вследствие диссоциации в воде на катионы аммония и анионы гидроксида (-ОН);
- окраска индикаторов: лакмусовая бумага — синий, фенолфталеин — малиновый;
- раствор бурно реагирует при контакте с концентрированными кислотами, сильными окислителями, альдегидом акриловой кислоты, галогенами, диметилсульфатом (со взрывом), азотнокислым серебром, ртутью.
В нормальных условиях продукт химически стабилен. При взаимодействии с кислотами аммиачная вода образует соответствующие соли аммония.
Техника безопасности при работе с веществом
Сам по себе водный раствор аммиака является негорючей и невзрывоопасной жидкостью, но при выделении паров аммиака в помещениях могут скапливаться взрывоопасные концентрации. Даже в малых концентрациях они вызывают следующие негативные реакции со стороны организма человека:
- обильное слезотечение;
- сильный кашель;
- удушье;
- ринит;
- головокружение;
- разъедание желудочно-кишечного тракта при проглатывании;
- ожог слизистых оболочек;
- отек легких при накоплении в них паров (в результате длительного вдыхания в течение 48 часов), что в конечном итоге может привести к смерти.
Поэтому при работе с этим веществом соблюдают следующие меры предосторожности:
- использование вытяжного шкафа;
- герметизация технологического оборудования и тары;
- использование средств индивидуальной защиты: резиновых перчаток, спецодежды, противогазов и защитных очков.
Это соединение является также токсичным для флоры и фауны водоемов.
Где используется водный раствор аммиака?
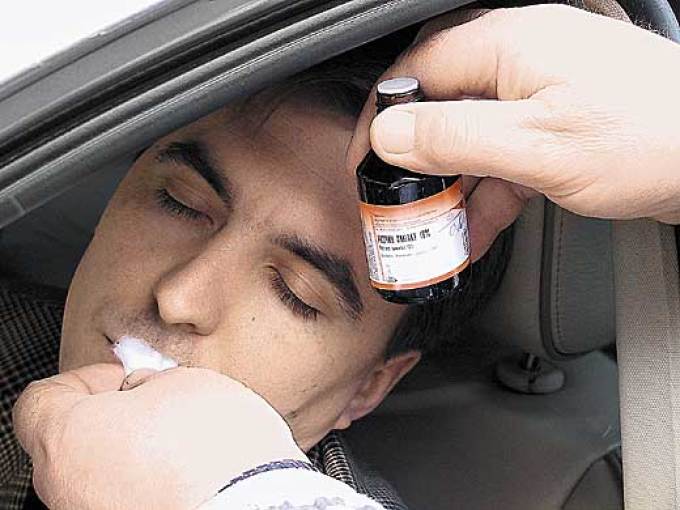
10 % аммиачный раствор в воде — это всем известная «нашатырка», или нашатырный спирт. В медицине его традиционно использовали при обмороках. В быту это соединение применяют в следующих целях:
- чистка ювелирных изделий из серебра;
- мойка окон и других глянцевых, зеркальных поверхностей (для устранения разводов);
- удаление пятен на тканях;
- устранение неприятных запахов в холодильнике.
Существуют также другие области использования этого соединения:
- химическая промышленность — производство соды, марганца, азотной кислоты, ферросплавов, полимерных материалов и красителей;
- военная промышленность — изготовление взрывчатых веществ;
- пищевая промышленность — добавка Е527 (эмульгатор);
- текстильная промышленность — крашение тканей;
- производство холодильной техники — хладагент;
- строительство — противоморозная и антикоррозионная добавка в железобетонных конструкциях;
- другие отрасли — серебрение зеркал, изготовление светокопировальных материалов.
Применение аммиачной воды в сельском хозяйстве
Гидрат аммиака — дешевый и эффективный источник азота для сельскохозяйственных культур, особенно необходимый в период их вегетативного роста. Растения лучше всего усваивают этот элемент в виде солей азотной кислоты и солей аммония. При поглощении аммиака частицами почвы он диссоциирует на катионы аммония и ионы нитратов. Аммиачный азот имеет высокую степень подвижности в грунте и легко мигрирует с его жидкой фазой.
Существуют следующие особенности использования аммиачной воды в качестве удобрения:
- Период внесения в почву — осенью под перепашку земли (сентябрь), весной — под предпосевное рыхление (апрель), подкормка культур с большими площадями питания в течение всего лета (кукуруза, свекла и другие).
- Применение возможно на всех видах почв. Особенно эффективно использование удобрения на грунтах с тяжелым механическим составом, так из легкой почвы аммиак быстро улетучивается.
- Не рекомендуется применять гидрат аммония на одном и том же месте подряд в течение нескольких лет, поскольку он повышает минерализацию почвы. Это способствует уменьшению содержания органики в ней.
- На легких почвах удобрение лучше вносить весной. Земля должна прогреться до температуры не менее +10 ˚С.
- Водный аммиак необходимо заделывать глубоко в почву (на 10 и 15 см в тяжелую и легкую соответственно). Поверхностное внесение недопустимо, чтобы предотвратить испарение аммиака. Для этого в сельском хозяйстве используют специальные машины. Можно эту процедуру проводить также одновременно с поливом в прохладную погоду.
Такое удобрение позволяет получить высокий урожай и сохранить плодородие земли. Его влияние на характеристики почвы также заключается в следующем:
- Аммиачная вода подкисляет почву, поэтому для ее нейтрализации необходимо вносить карбонат кальция CaCO3 (в расчете 0,3 ц на 1 ц гидрата аммония).
- После подкормки в зоне распространения удобрения наблюдается снижение количества микроорганизмов. Через 6-8 недель после того, как аммиак превратится в нитраты, их число увеличивается в результате роста растительных остатков. То же наблюдается с дождевыми червями.
Кроме этого, аммиачную воду в сельском хозяйстве применяют для аммонизации кормов и антисептической обработки помещений.
Аммиачная вода: получение, формула, применение
Бесцветный газ с резким запахом аммиак NH3 не только хорошо растворяется в воде с выделением тепла. Вещество активно взаимодействует с молекулами H2O с образованием слабой щелочи. Раствор получил несколько названий, одно из них — аммиачная вода. Соединение обладает удивительными свойствами, которые заключаются в способе образования, составе и химических реакциях.
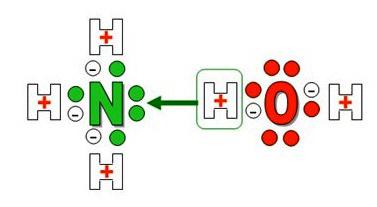
Образование иона аммония
Образуется ион аммония с одним положительным зарядом и особым типом слабой ковалентной связи – донорно-акцепторной. По своим размерам, заряду и некоторым другим особенностям он напоминает катион калия и ведет себя подобно щелочным металлам. Необычное в химическом плане соединение реагирует с кислотами, образует соли, имеющие важное практическое значение. Названия, в которых отражены особенности получения и свойства вещества:
- аммиачная вода;
- гидроксид аммония;
- гидрат аммиака;
- едкий аммоний.
Меры предосторожности
Необходимо соблюдать осторожность при работах с аммиаком и его производными. Важно помнить:
- Аммиачная вода имеет неприятный запах. Выделяющийся газ раздражает слизистую поверхность носовой полости, глаз, вызывает кашель.
- При хранении нашатырного спирта в неплотно закрытых флаконах, ампулах выделяется аммиак.
- Можно обнаружить без приборов, только по запаху даже небольшое количество газа в растворе и воздухе.
- Соотношение между молекулами и катионами в растворе изменяется при разных рН.
- При значении около 7 снижается концентрация токсичного газа NH3, увеличивается количество менее вредных для живых организмов катионов NH4 +
Получение гидроксида аммония. Физические свойства
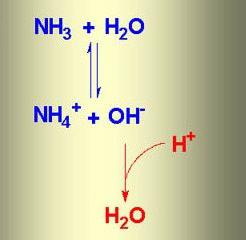
При растворении аммиака в воде образуется аммиачная вода. Формула этого вещества – NH4OH, но на самом деле одновременно присутствуют ионы
NH4 + , OH – , молекулы NH3 и H2O. В химической реакции ионного обмена между аммиаком и водой устанавливается равновесное состояние. Процесс можно отразить с помощью схемы, на которой противоположно направленные стрелочки указывают на обратимость явлений.
В лаборатории получение аммиачной воды проводят в опытах с азотосодержащими веществами. При смешивании аммиака с водой получается прозрачная бесцветная жидкость. При высоких давлениях растворимость газа увеличивается. Вода больше отдает растворенный в ней аммиак при повышении температуры. Для производственных нужд и сельского хозяйства в промышленных масштабах получают 25-процентное вещество при растворении аммиака. Второй способ предусматривает использование реакции коксового газа с водой.
Химические свойства гидроксида аммония
При соприкосновении две жидкости — аммиачная вода и соляная кислота — покрываются клубами белого дыма. Он состоит из частиц продукта реакции – хлорида аммония. С таким летучим веществом, как соляная кислота, реакция происходит прямо в воздухе.
Слабо-щелочные химические свойства гидрата аммиака:
- Вещество обратимо диссоциирует в воде с образованием катиона аммония и гидроксид-иона.
- В присутствии иона NH4 + бесцветный раствор фенолфталеина окрашивается в малиновый цвет, как в щелочах.
- Химическая реакция нейтрализации с кислотами приводит к образованию солей аммония и воды: NH4OH + HCl = NH4Cl + H2O.
- Аммиачная вода вступает в реакции ионного обмена с солями металлов, которым соответствуют слабые основания, при этом образуется нерастворимый в воде гидроксид: 2NH4OH + CuCl2 = 2NH4Cl + Cu(OH)2 (синий осадок).
Аммиачная вода: применение в разных отраслях хозяйства
Необычное вещество широко используется в быту, сельском хозяйстве, медицине, промышленности. Технический гидрат аммиака применяется в сельском хозяйстве, производстве кальцинированной соды, красителей и других видов продукции. В жидком удобрении азот содержится в легкоусвояемой растениями форме. Вещество считается наиболее дешевым и эффективным для внесения в предпосевной период под все сельскохозяйственные культуры.
На производство аммиачной воды затрачивается в три раза меньше средств, чем на выпуск твердых гранулированных азотных удобрений. Для хранения и транспортировки жидкости применяются герметически закрытые цистерны из стали. Некоторые виды красок и средств для обесцвечивания волос производятся с использованием едкого аммония. В каждом медицинском учреждении есть препараты с нашатырным спиртом — 10-процентным раствором аммиака.
Соли аммония: свойства и практическое значение
Вещества, которые получают при взаимодействии гидроксида аммония с кислотами, используются в хозяйственной деятельности. Соли разлагаются при нагревании, растворяются в воде, подвергаются гидролизу. Они вступают в химические реакции со щелочами и другими веществами. Наиболее важное практическое значение приобрели хлориды, нитраты, сульфаты, фосфаты и карбонаты аммония.
Очень важно соблюдать правила и меры безопасности, проводя работы с веществами, в составе которых есть ион аммония. При хранении на складах промышленных и сельскохозяйственных предприятий, в подсобных хозяйствах не должно быть соприкосновения таких соединений с известью и щелочами. Если нарушится герметичность упаковок, то начнется химическая реакция с выделением ядовитого газа. Каждый, кому приходится работать с аммиачной водой и ее солями, обязан знать основы химии. При соблюдении требований техники безопасности используемые вещества не принесут вреда людям и окружающей среде.
Аммиак ЧДА: как получить аммиачную воду?
Существует несколько водородных соединений азота. Наиболее известным и важным является аммиак — NH3. Это бинарное соединение азота с водородом, при нормальных условиях представляющее собой бесцветный газ со специфическим запахом.
Растворяется в воде и спиртах. 18-20%-ный раствор NH3 в воде называют аммиачной водой или водным аммиаком. Это бесцветная или желтоватая прозрачная жидкость с характерным резким запахом, без каких-либо механических примесей.
Известен также другой раствор NH3, с содержанием основного вещества 10 %, именуемый нашатырным спиртом. Очень часто его отождествляют с аммиачной водой, но на самом деле это разные субстанции, отличающиеся концентрацией аммиака и сферой применения.
Получать водный аммиак возможно благодаря тому, что молекула этого газа является высокополярной. Это обусловливает его отличную растворимость в воде (1 объем воды растворяет 700-1200 объемов аммиака), а также сравнительную простоту перехода в твердое и жидкое состояния. Но главным образом получение раствора этого вещества осуществляется только в промышленных условиях.
Получение аммиачной воды и нашатырного спирта
Водный аммиак получают при взаимодействии сырого коксового газа с водой, конденсирующейся из-за охлаждения газа или специально добавляющейся в него для вымывания NH3. В обоих вариантах получается слабая (скрубберная) аммиачная вода. Ее дистиллируют с водяным паром и последующими конденсацией и дефлегмацией, в результате чего получается концентрированная аммиачная вода с содержанием NH3 18-20 %. Ее применяют для производства азотных удобрений, полимеров, кальцинированной соды, взрывчатых веществ, в качестве хладагента, растворителя, противоморозной добавки, в животноводстве и др.
Из водного аммиака можно получить нашатырный спирт, широко известный в качестве антисептика и возбуждающего средства при обмороках. Для этого доводят концентрацию основного вещества до 10 % путем разбавления водой. Но существует и более короткий и простой метод, применяемый, к примеру, мастерами-холодильщиками.
Они пропускают первый этап и получают нашатырный спирт прямо из аммиака. Для этого шланг с газом помещают в ведро с водой и ждут определенного сигнала – так называемых щелчков, означающих, что реакция завершилась и газ можно перекрывать. Полученный таким образом нашатырный спирт не подходит для использования в химической промышленности и медицине, но может применяться в качестве хладагента.
Существует еще одна разновидность растворов NH3 – аммиак водный ЧДА (чистый для анализа). Он не содержит никаких посторонних примесей и производится с максимально четким соблюдением технологии. Вещество используется в качестве реактива в аналитической химии и медицине. Оно позволяет синтезировать химически чистые вещества в химической отрасли.
Безопасность и хранение
Реагент является трудногорючим, токсичным веществом. По степени воздействия на организм человека относится к 4-му классу опасности. При работе с ним следует использовать защитные перчатки, очки, маску и прорезиненную спецодежду. Работу выполнять только в хорошо вентилируемых помещениях.
В случае попадания реактива на кожные покровы и слизистые оболочки следует промыть пораженные области большим количеством воды и обратиться к врачу.
Хранить реагент нужно в закрытой упаковке в сухих складских помещениях. Срок годности – 1 год с даты изготовления.
Где приобрести?
Компания «АКВАХИМ» реализуем высококачественную химпродукцию от ведущих производителей России и зарубежья. Заказать у нас просто: нажмите на соответствующую кнопку возле фотографии товара и введите ваше имя, номер телефона и e-mail. Мы свяжемся с вами в рабочее время для обсуждения деталей.
http://fb.ru/article/135157/ammiachnaya-voda-poluchenie-formula-primenenie
http://himrus.ru/stati/ammiak-vodnyij