Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e16ecdf3c33497d • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Хлорид железа (III)
| Хлорид железа | |
|---|---|
 | |
| Систематическое наименование | Хлорид железа (III) |
| Хим. формула | FeCl3 |
| Состояние | твердый |
| Молярная масса | 162.5 г/моль |
| Плотность | 2,8 г/см³ |
| Т. плав. | 306 °C |
| Т. кип. | 315 °C |
| Растворимость в воде | 92 г/100 мл |
| ГОСТ | ГОСТ 4147-74 |
| Рег. номер CAS | 7705-08-0 |
| PubChem | 24380 |
| Рег. номер EINECS | 231-729-4 |
| SMILES | |
| RTECS | LJ9100000 |
| ChEBI | 30808 |
| ChemSpider | 22792 |
| ЛД50 | 440 мг/кг (крысы, орально) |
| Токсичность | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Хлорид железа (III), хлорное железо, также — трихлорид железа. FeCl3 — средняя соль трёхвалентного железа и соляной кислоты.
Содержание
- 1 Физические свойства
- 2 Методы получения
- 3 Химические свойства
- 4 Применение
- 5 Безопасность
Физические свойства
Мерцающие, черно-коричневые, либо темно-красные, либо фиолетовые в проходящем свете, зеленые в отраженном свете листочки с металлическим блеском. Сильно гигроскопичен, на воздухе превращается в гидрат FeCl3· 6H2O — гигроскопичные жёлтые, по другим источникам желто-коричневые кристаллы, хорошо растворимые в воде (при 20 °C в 100 г воды растворяется 91,9 г безводной соли). Tпл 309 °C.
Методы получения
- Самым простым методом получения трихлорида железа является действие на железные опилки или раскалённую железную проволоку газообразным хлором. При этом, в отличие от действия соляной кислоты, образуется соль трёхвалентного железа — выделяется бурый дым из мельчайших её частиц:
2Fe + 3Cl2 → 2FeCl3
- Также трихлорид получается при окислении хлором хлорида железа (II):
2FeCl2 + Cl2 → 2FeCl3
- Также существует достаточно интересный метод окисления оксидом серы (IV):
4FeCl2 + SO2↑ + 4HCl → 4FeCl3 + S + 2H2O
- Другим способом получения трихлорида железа (FeCl3) является взаимодействие
оксида железа(III) с соляной кислотой, сопровождающееся выделением воды и энергии в виде тепла:
Fe2O3 + 6HCl → 2FeCl3 + 3H2O + Q↑
Химические свойства
- При нагревании в атмосферном давлении до температуры плавления начинается медленное разложение трихлорида железа с образованием дихлорида и молекулярного хлора:
2FeCl3 → 2FeCl2 + Cl2
- За счёт того, что трихлорид железа является сильной кислотой Льюиса, он вступает во взаимодействие с некоторыми другими хлоридами, при этом образуются комплексные соли тетрахлороферратной кислоты:
FeCl3 + Cl − → [FeCl4] −
- При нагревании до 350 °C с оксидом железа(III) образуется оксохлорид железа:
FeCl3 + Fe2O3 → 3FeOCl
- Соли трёхвалентного железа являются слабыми окислителями, в частности, трихлорид железа хорошо окисляет металлическую медь, переводя её в растворимые хлориды:
FeCl3 + Cu → FeCl2 + CuCl FeCl3 + CuCl → FeCl2 + CuCl2
- реагирует с иодоводородом:
2FeCl3 + 2HI → 2FeCl2 + I2 + 2HCl
Применение
- Хлорид железа(III) применяется при травлении печатных плат (радиотехника, системотехника).
- Используется для травления печатных форм (офорт, цинкография), как альтернатива азотной кислоте, реакция с которой сопровождается выделением высокотоксичных паров («лисий хвост»).
- Используется в кузнечном деле для проявления рисунка железа.
- Применяется как протрава при крашении тканей.
- В промышленных масштабах применяется как коагулянт для очистки воды.
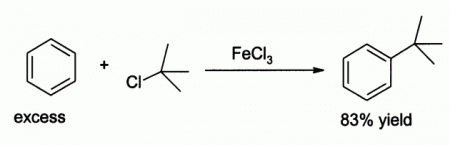
- За счёт чётко выраженных кислотных свойств широко применяется в качестве катализатора в органическом синтезе. Например, для реакции электрофильного замещения в ароматических углеводородах.
Безопасность
Хлорид железа (III) является токсичным, высококоррозионным соединением. Безводная соль служит осушителем.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. источники: http://chem.ru/hlorid-zheleza-iii.html http://acetyl.ru/o/nfe11cl13.php |