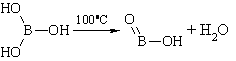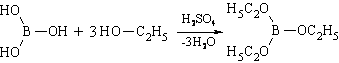Лабораторная работа № 2
Читайте также:
|
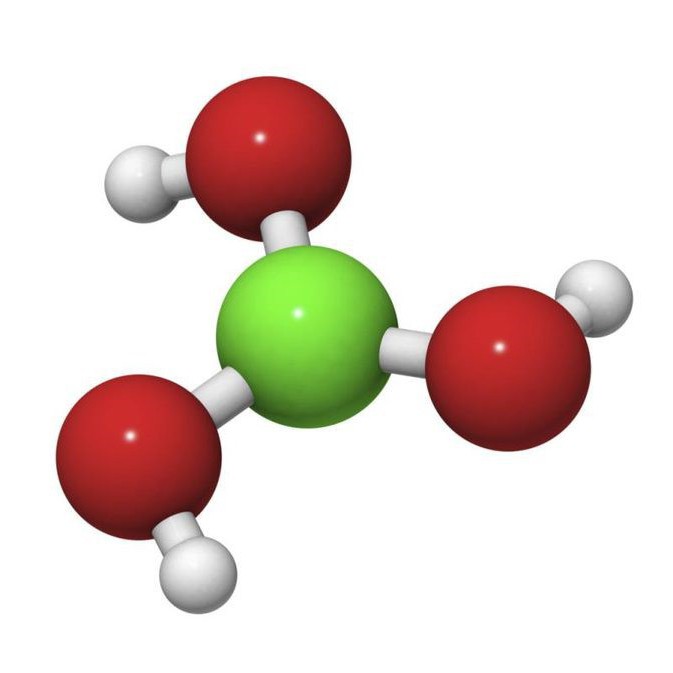
Acidum boricum – Кислота борная
Описание. Белые блестящие, слегка жирные на ощупь чешуйки или мелкий кристаллический порошок без запаха. Летуч с парами воды и спирта. При продолжительном нагревании (до 100°С) теряет часть воды, переходя в метаборную кислоту ( HBO 2 ), при более сильном нагревании образуется стекловидная масса ( H 2 B 4 O 7 ), которая при дальнейшем нагревании, вспучиваясь, теряет всю воду и переходит в борный ангидрид ( B 2 O 3 ) бурого цвета. Водный раствор имеет слабокислую реакцию.
Растворимость. Растворим в 25 ч. воды, в 4 ч. кипящей воды, в 25ч. спирта, медленно в 7 частях глицерина.
Получение. Из природных минералов: ашарит ( Mg 2 B 2 O 5 ∙ H 2 O ), сассолин ( H 3 BO 3 ), бура ( Na 2 B 4 O 7 ∙10 H 2 O ), борокальций ( CaB 4 O 7 ∙10 H 2 O ):
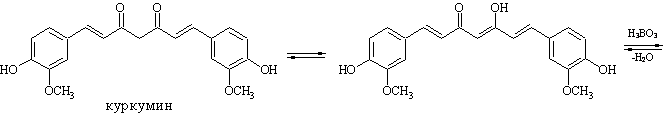
1. Реакция с куркумином (ГФ Х). Куркумовая бумага, смоченная раствором препарата и раствором соляной кислоты, окрашивается при высушивании в розовый или буровато-красный цвет, переходящий от смачивания раствором аммиака в зеленовато-черный:
SHAPE \* MERGEFORMAT
SHAPE \* MERGEFORMAT
Недопустимо присутствие Fe , Mo , W (образуют комплексы подобного цвета).
2. Образование борноэтилового эфира (ГФ Х) , горящего пламенем с зеленой каймой:
Примеси. Допустимые: мышьяк, хлориды, сульфаты, железо, тяжелые металлы, кальций.
Количественное определение (ГФ Х). Прямая алкалиметрия.
Титрант – NaOH , индикатор – фенолфталеин, среда – глицерин.
f экв ( H 3 BO 3 )=1, 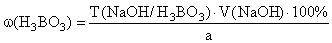
Формула борной кислоты в химии
Данная статья будет посвящена борной кислоте, которая широко применяется в самых разных сферах деятельности и известна практически каждому человеку. Формула борной кислоты предельно проста для запоминания. В статье будут рассмотрены общая характеристика и свойства борной кислоты, области ее применения и нахождения в природе.
Что такое борная кислота
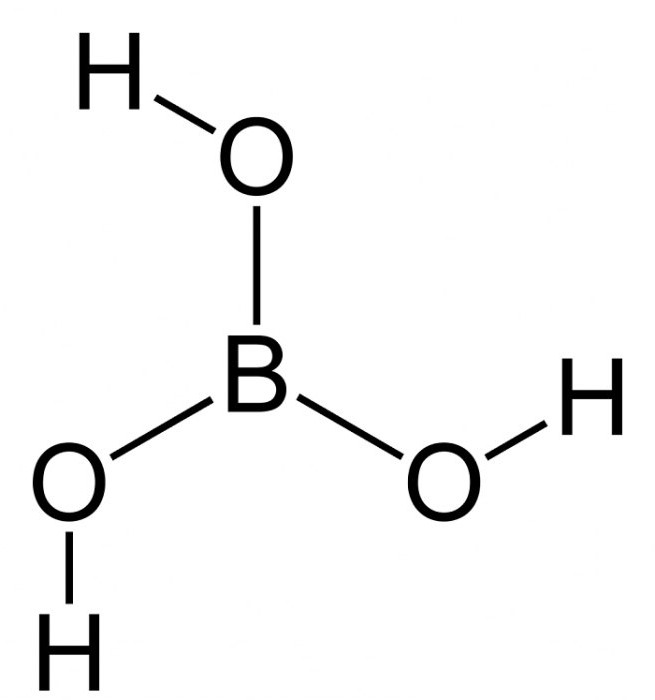
Формула борной кислоты в химии известная многим. Она довольно слабая по сравнению с «коллегами». Ее активно используют для химических опытов в школах. Формула борной кислоты — H3Bo3.
Борная кислота — это кристаллический порошок, не имеющий цвета и запаха. Молекулы триклинной слоистой решетки соединены между собой водородными связями и образуют плоские слои. Таким образом и строится молекула борной кислоты.
Представленное вещество имеет слабовыраженные свойства кислот — в воде растворяется плохо. Одной из особенностей является то, что свойство кислоты H3Bo3 придает присоединение аниона гидроксильной группы. У других кислот наблюдается способность к отщеплению H+ протона.
При образовании гидросульфата бора B(HSO4)3, который весьма слабоустойчив, борная кислота может проявлять довольно слабые признаки амфотерности. Если соединение подвергнуть термическому воздействию, борная кислота будет способна растворять металлы оксидов, в результате чего образуются соли. Формула нашего химического соединения в присутствии серной кислоты в концентрированном виде может образовать эфиры:
| H3Bo3 + 3CH3OH → 3H2O + B(OCH3)3 |
Во время протекания процесса нейтрализации щелочами в растворах воды, ортобораты, содержащие (BO3)3, не образуются. Это явление объясняется тем фактом, что они при нейтрализации почти полностью гидролизируются из-за чрезмерно малого количества константы [B(OH3)-. В результате этой реакции в растворе начинают образоваться соли полиборной кислоты, например, метабораты, тетрабораты и другие:
| 2NaOH + 3H3Bo3 → Na2B4O7 + 7H2O |
Если щелочи присутствуют в избытке, то они могут перейти в метабораты:
| 2NaOH + Na2B4O7 → 4NaBO2 + H2O |
И тетра-, и метабораты способны к гидролизу, но в сравнении с ортоборатами имеют меньшую степень склонности.
Борная кислота в природе
Борная кислота, формула химическая которой H3Bo3, часто встречается в природе в практически свободном виде — в минерале сассолине. Более того, эта кислота входит в состав воды практически каждого горячего природного источника. Довольно большое количество H3Bo3 содержится в подземных минеральных водах, которые необычайно полезны для здоровья.
Использование H3Bo3 человеком
Химический состов используют как поглотитель нейтронов в ядерных реакторах, в медицине H3Bo3 раствором с содержаниям вещества в два процента используют в качестве антисептика для обеззараживания поверхности кожи.
Фотографы используют ее в качестве проявителя мелкозернистого типа. С ее помощью создается кислая среда для фиксажей.
Литейщики используют борную кислоту как связующее вещество во время футеровки печи.
В быту человек использует ее для борьбы с насекомыми.
Кислота активно используется в косметологии для уходом за проблемной кожей.
В пищевой промышленности борная кислота носит название добавки E284, а в лабораториях на ее основе готовят буферные растворы.
Формула борной кислоты H3Bo3 используется при производстве керамики, стекла, стекловолокна и оптоволокна.
Множество комбинированных препаратов группы ATX D08AD одним из компонентов имеют борную кислоту.
Ювелиры используют её во время пайки сплавов, в состав которых входит золото, в качестве основы флюсоф для пайки.
Опасна ли борная кислота?
В заключении можно сказать, что H3Bo3 является незаменимым веществом в жизни и деятельности человека.
http://nesterovdmitriy.narod.ru/03-Nauchnaya_Deyat/pharm_chem/Ac_boricum.htm
http://fb.ru/article/302367/formula-bornoy-kislotyi-v-himii
 + 2NaNO3 + 2H2O
+ 2NaNO3 + 2H2O