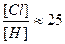Получение HCl
Хлороводород в промышленности получают либо прямым синтезом из хлора и водорода, либо из побочных продуктов при хлорировании алканов (метана). Мы будем рассматривать прямой синтез из элементов.
HCl – бесцветный газ с резким, характерным запахом
t°пл= –114,8°C, t°кип= –84°C, t°крист= +57°C, т.е. хлороводород можно получать при комнатной температуре в жидком виде, увеличивая давление до 50 – 60 атм. В газовой и жидкой фазе находится в виде отдельных молекул (отсутствие водородных связей). Прочное соединение Есв= 420 кДж/моль. Начинает разлагаться на элементы при t>1500°C.
2HCl 
Эффективный радиус HCl = 1,28 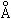
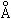
RCl — = 1,81 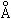
Хлороводород хорошо растворим в воде в любых соотношениях (в одном объеме H2O расторяется до 450 объемов HCl), с водой образует несколько гидратов и дает азеотропную смесь – 20,2% HCl и t°кип= 108,6°C.
Образование хлороводорода из элементов:
Смесь водорода и хлора при освещении взрывается, что указывает на цепной характер реакции.
В начале века Баденштейн предложил следующий механизм реакции:
Инициирование: Cl2 + hν → ē + Cl2 +
Обрыв цепи: Cl + + ē → Cl
Но ē в сосуде обнаружен не был.
В 1918 г. Нернст предложил другой механизм:
Инициирование: Cl2 + hν → Cl• + Cl•
Цепь: Cl• + H2 → HCl + H•
Обрыв цепи: H• + Cl• → HCl
В дальнейшем этот механизм получил дальнейшее развитие и дополнение.
1 стадия – инициирование
реакция Cl2 + hν → Cl• + Cl•
Инициируется фотохимическим путем, т.е. путем поглощения кванта света hν. Согласно принципу эквивалентности Эйнштейна каждый квант света может вызвать превращение только одной молекулы. Количественной характеристикой принципа эквивалентности является квантовый выход реакции:
– количество прореагировавших молекул приходящихся на 1 квант света.
γ в обычных фотохимических реакциях ≤1. Однако в случае цепных реакций γ>>1. Например, в случае синтеза HCl γ=10 5 , при распаде H2O2 γ=4.
Если молекула Cl2 поглотила квант света, то она находится в возбужденном состоянии
10 -8 -10 -3 сек и, если полученной с квантом света энергии хватило для превращения, то происходит реакция, если нет, то молекула снова перейдет в основное состояние, либо с испусканием кванта света (флуоресценция или фосфоресценция), либо электронное возбуждение конверсируется в энергию колебания или вращения.
Посмотрим, что происходит в нашем случае:
Еобр HCl = 432,82 кДж/моль – без облучения реакция не идет.
Квант света имеет энергию Екв = 41,1*10 -20 Дж. Энергия, необходимая для начала реакции (энергия активации) ровна энергии, затраченной диссоциацию молекулы Cl2:
В отличие от катализа, при котором потенциальный барьер снижается, в случае фотохимических реакций он просто преодолевается за счет энергии кванта света.
Еще одна возможность инициирования реакции – добавление паров Na в смесь H2+Cl2. Реакция идет при 100°C в темноте:
Na + Cl2 → NaCl + Cl•
и образуется до 1000 HCl на 1 атом Na.
2 стадия – продолжение цепи
Реакции продолжения цепи при получении HCl бывают следующих типов:
1. Cl• + H2 → HCl + H• Ea=2,0 кДж/моль
2. H• + Cl2 → HCl + Cl• Ea=0,8 кДж/моль
Это звенья цепи.
Скорость данных реакций можно представить следующим образом:
Т.к. энергии активации этих реакций малы, то их скорости велики. Цепи в данном случае неразветвленные, а по теории неразветвленных цепей:
Wразвитие цепи = Wициируется фотохимическим путем, т.е. путем поглощения кванта светаобрыва,
тогда, если считать, что обрыв квадратичен:

в данном случае W1 =W2, т.к.цепи достаточно длинные (из теории цепных реакций)
Данное кинетическое уравнение справедливо в отсутствие примесей в смеси H2 + Cl2. Если в систему попадет воздух, то кинетическое уравнение будет иное. В частности
Wобр = K[Cl•], т.е. не квадратичный обрыв и ход процесса полностью меняется.
Т.к. есть вещества, являющиеся ингибиторами цепных реакций. Ингибитором реакции образования HCl является кислород:
Этот радикал малоактивен и может реагировать только с таким же радикалом, регенерируя кислород
Расчеты показывают, что в присутствии 1% O2 реакция замедляется в 1000 раз. Еще более сильно замедляет скорость процесса присутствие NCl3, который замедляет реакцию в 10 5 раз сильнее, чем кислород. Т.к. хлорид азота может присутствовать в хлоре в процессе его получения в промышленности, необходима тщательная очистка исходного хлора перед синтезом HCl.
Механизм действия NCl3:
и восстановление Cl• идет чрезвычайно медленно и идет процесс
3 стадия – обрыв цепи
Представление Нернста о механизме обрыва цепи при тщательном исследовании не подтвердилось.
В данном случае возможно 3 способа рекомбинации радикалов:
1. Cl• + Cl• +М → Cl2 + М
2. H• + H• + М → H2 + М
3. H• + Cl• + М → HCl + М

Отсюда , что при t
600°C и [Cl2] ≈ [H2] (условия синтеза HCl), дает
Следовательно, скорость рекомбинации по 1 будет в 25 раз выше, чем по 3 и в 625 раз, чем по 2, т.е. процессами 2 и 3 можно практически пренебречь.
Дата добавления: 2015-06-17 ; просмотров: 4764 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Урок №19. Соляная кислота и её соли
Соляная кислота
Физические свойства:
Концентрированная соляная кислота – это бесцветный раствор, сильно дымящий во влажном воздухе, с резким запахом.
Получение соляной кислоты:
Соляная кислота HCl получается при растворении газа хлороводорода воде. Хлороводород можно получить действием концентрированной серной кислоты на поваренную соль.
NaCl + H 2 SO 4 = HCl↑ + NaHSO 4 (хлороводород + гидросульфат натрия)
Химические свойства:
Раствор хлороводорода в воде — соляная кислота — сильная кислота:
1) реагирует с металлами , стоящими в ряду напряжений до водорода:
2Al + 6HCl = 2AlCl 3 + 3H 2
3) с оксидами металлов :
MgO + 2HCl = MgCl 2 + H 2 O
4) с основаниями и аммиаком :
HCl + KOH = KCl + H 2 O
3HCl + Al(OH) 3 = AlCl 3 + 3H 2 O
HCl + NH 3 = NH 4 Cl
5) с солями :
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2 ↑
HCl + AgNO 3 = AgCl↓ + HNO 3
Образование белого осадка хлорида серебра — AgCl, нерастворимого в минеральных кислотах используется в качестве качественной реакции для обнаружения анионов Cl — в растворе.
Хлориды металлов — соли соляной кислоты, их получают взаимодействием металлов с хлором или реакциями соляной кислоты с металлами, их оксидами и гидроксидами; путем обмена с некоторыми солями
2Fe + 3Cl 2 = 2FeCl 3
Mg + 2HCl = MgCl 2 + H 2
Fe + 2HCl = FeCl 2 + H 2
CaO + 2HCl = CaCl 2 + H 2 O
Ba(OH) 2 + 2HCl = BaCl 2 + 2H 2 O
Pb(NO 3 ) 2 + 2HCl = PbCl 2 ↓ + 2HNO 3
Большинство хлоридов растворимы в воде (за исключением хлоридов серебра, свинца и одновалентной ртути).
Применение соляной кислоты и ее солей:
1. Соляная кислота входит в состав желудочного сока и способствует перевариванию белковой пищи у человека и животных.
2. Хлороводород и соляная кислота используются для производства лекарств, красителей, растворителей, пластмасс.
3. Применение основных солей соляной кислоты:
KCl — удобрение, используется также в стекольной и химической промышленности.
HgCl 2 — сулема — яд, используется для дезинфекции в медицине, для протравливания семян в сельском хозяйстве.
Hg 2 Cl 2 — каломель — не ядовита, слабительное средство.
NaCl — поваренная соль — сырье для производства соляной кислоты, гидроксида натрия, водорода, хлора, хлорной извести, соды. Применяется в кожевенной и мыловаренной промышленности, в кулинарии и консервировании.
ZnCl 2 — для пропитки древесины против гниения, в медицине, при паянии.
AgCl — применяется в черно-белой фотографии, так как обладает светочувствительностью — разлагается на свету с образованием свободного серебра: 2AgCl = 2Ag + Cl 2
Задания для повторения и закрепления
№1. Осуществите превращения по схеме:
HCl → Cl 2 → AlCl 3 → Al(OH) 3 → Al 2 O 3 → AlCl 3 → Cl 2
№2. Расставьте коэффициенты методом электронного баланса в следующей реакции:
HCl + KClO 3 → KCl + H 2 O + Cl 2
Укажите окислитель и восстановитель; процессы окисления и восстановления.
Какое количество алюминия прореагирует с избытком соляной кислоты для получения 5,6 л водорода (н.у.)?
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e18e12a5b057a43 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
http://www.sites.google.com/site/himulacom/%D0%B7%D0%B2%D0%BE%D0%BD%D0%BE%D0%BA-%D0%BD%D0%B0-%D1%83%D1%80%D0%BE%D0%BA/9-%D0%BA%D0%BB%D0%B0%D1%81%D1%81-%D0%B2%D1%82%D0%BE%D1%80%D0%BE%D0%B9-%D0%B3%D0%BE%D0%B4-%D0%BE%D0%B1%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D1%8F/%D1%83%D1%80%D0%BE%D0%BA-19-%D1%81%D0%BE%D0%BB%D1%8F%D0%BD%D0%B0%D1%8F-%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D0%B0-%D0%B8-%D0%B5%D1%91-%D1%81%D0%BE%D0%BB%D0%B8
http://gomolog.ru/reshebniki/9-klass/rudzitis-i-feldman-2019/15/zadanie-1.html