Карбонат аммония: свойства, польза и опасность, применение, уравнение и взаимодействия
Карбонат аммония – это вещество, которое бывает техническим и пищевым. Технический карбонат аммония категорически запрещено употреблять в пищу! Концентрат легко провоцирует отравление с летальным исходом. Рассмотрим, что такое углеаммонийная соль, чем отличается пищевая от технической, формулы, уравнения, влияние на человеческий организм, применение вещества и другую информацию.
Что такое карбонат аммония
Карбонат аммония – это прозрачная синтезированная гранулообразная субстанция лабораторного происхождения (нашатырно-спиртовой раствор). Производное углекислоты и солей аммония. Также существует в виде серых, белых или розоватых кристаллов с выраженным аммиачным ароматом. В пищевой промышленности вещество зарегистрировано, как пищевая добавка Е503.
- углекислый аммоний;
- углеаммонийные соли;
- бикарбонат аммония.
Физические и химические свойства карбоната аммония, реакции
Высокая растворимость в Н₂О. Контактируя с кислородом, при температуре до 18-24ºС проявляет неустойчивость, превращаясь в аммониевый гидрокарбонат, выделяя аммиак. При 60ºС разлагается на аммиак, Н₂О и углеродный оксид.
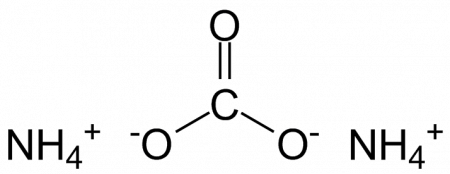
Структурная формула карбоната аммония
Физические свойства
Свойства карбоната аммония:
- Плотность: 1,6 г/см³;
- Терморазложение: 60°C;
- Масса: 96 г/моль;
- Растворимость в Н₂О: (0°C); 100,1 (15°C); Разл. (100 °C).
Молекула карбоната аммония
Химические свойства, реакции с карбонатом аммония
Аммониевый карбонат при взаимодействии с водой разлагается, как слабокислая соль и слабые электролиты:
(NH₄)₂CO₃+ HOH ↔ NH₄CO₃ + NH₃OH
2NH₄⁺ + CO₃²⁻ + HOH ↔ HCO₃- + NH₄OH
CO₃²⁻ + HOH ↔ HCO₃⁻ + OH⁻
(NH₄)₂CO₃ → CO₂↑ + 2NH₃↑ + H₂O↑
Взаимодействует с кислотами, поскольку СО₂ слабейшая из синтетических окислителей:
(NH₄)₂CO₃+ H₂SO₄ → (NH₄)₂CO₄ + CO₂↑ + H₂O
Реакция с диссоциирующими электролитами:
(NH₄)₂CO₃ + NaOH → Na₂CO₃ + 2NH₃↑ + 2H₂O
Реагирует с солями:
(NH₄)₂CO₃ +СaCl₂ → CaCO₃↓ + 2NH₄Cl
Взаимодействие с кислотами:
С щелочной средой:
Получение и производство карбоната аммония
До появления современных технологий пищевую добавку Е503 извлекали из костных тканей, рогов, ногтевых пластин и др. азотных веществ, путем высокотемпературной перегонки жидкости. Сейчас добывают только в лабораторных условиях:
- Смешивая водяной пар, углекислоту и газообразный аммиак.
- При распаде аммония хлористого.
- Обработке жидкого аммиака углеродной двуокисью.
Раствор карбоната аммония добывают, путем насыщения углекислотой или реакцией между водой, аммиаком, углекислотой. Зачастую используют оба метода. 1-й, чтобы получить жидкую форму, затем выводят углеродную двуокись и аммиак для твердой.
Пищевая добавка Е503
Пищевая добавка Е503 – это смесь продуктов распада карбоната аммония. Не концентрированная субстанция. Пищевая добавка Е503 не распадается при комнатном давлении и температуре, чем и отличается от технического вещества.
Сферы применения карбоната аммония
Различные формы (твердая, жидкая) карбоната аммония, позволяют использовать вещество в различных индустриях.
Применение карбоната аммония в пищевой промышленности
Карбонат аммония незаменим при изготовлении кондитерских и хлебобулочных изделий, например бубликов, тортов. Применяют, в качестве дрожжей или соды для активации брожения и поднятия пышного теста. В оригинальных Скандинавских изделиях, используется исключительно пищевая добавка Е503. Применение традиционных дрожжей изменяет вкус готового печенья.
Также в пекарнях используют углекислый аммоний, в качестве разрыхлителя. Выделяя углекислоту, оказывает разрыхляющее действие. При изготовлении какао напитков, стабилизирует вкус и цвет.
Применение карбоната аммония в фармацевтике
В медицине карбонат аммония полезен для приготовления лекарственных средств, например, противокашлевых сиропов и местнораздражающих веществ для возбуждения чувствительных нервных окончаний верхних дыхательных путей – нашатырный спирт.
Применение карбоната аммония в виноделии
Пищевую добавку Е503 используют для винных напитков. Элемент ускоряет брожение, превращая сахар в алкоголь.
Применение карбоната аммония в восметологии
Карбонат аммония применяют для оттеночной стабилизации косметических средств: теней, румян, туши и пр.
Домоводство
Распространено добавление вещества в огородные азотные удобрения. Используют, в качестве подкормки в вегетационный период (для роста и развития растений). В составе аммонийного карбоната для удобрений содержится 24% азота. Контактируя с воздухом, аммиак испаряется, вещество превращается в бикарбонат натрия.
Углекислый аммоний добавляют в вещества для чистки оружия и порошок для пожаротушения. Используется как самостоятельный реагент, так и в комплексе с натриевыми бикарбонатами, гидроксидами, гидрокарбонатами.
Воздействие на человеческий организм
Пищевой эмульгатор Е503 безопасен для живых существ. Техническая версия вещества – агрессивна, взрывоопасна. Возможно поражение тканей, вплоть до летального исхода.
Польза
Пищевую добавку Е503 не употребляют в чистом виде, только в продуктах промышленного производства. Пользы для человеческого организма нет, как и вреда. В процессе термической обработки, вещество разрушается, выделяются вредные газы и компоненты наружу, делая пищу полностью безопасной для употребления. В результате воздействия углекислого аммония в продуктах остается пористость, стабилизируется вкус, цвет.
Сравнительно с пищевой добавкой Е503, техническая угольноаммонийная соль опасна. Требует осторожности при использовании. Применяется в промышленности, поэтому сотрудникам предприятия важно знать меры предосторожности.
Из данных паспорта безопасности химической продукции от 9.03.2016 г. технический аммиак внесен в Регистр Росстандарта информационно-аналитическим центром «Безопасность веществ и материалов» ФГУП «ВНИИ СМТ».
Опасность для человека и живых существ:
- раздражает дыхательные пути (пары);
- вызывает химические ожоги, попадая в органы зрения, на кожный покров;
- при проглатывании разъедает пищеварительную систему.
Избегать утечки карбоната аммония в т.ч. отходов в водоемы. Чрезвычайная опасность для водных существ.
| Тип | Симптомы | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Отравление при вдохе паров | Низкая концентрация вещества:
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Поражение кожного покрова | Краснота, болезненность, в области пораженного участка. При отсутствии первой помощи химический ожог, пузыри | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Проникновение в органы зрения | Острое раздражение, ожоги слизистой оболочки | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Проглатывание, повлекшее отравление | Ожог слизистой рта, боль в голове, краснота лица, отечность языка\губ, тошнотный рефлекс, рвота, возможно с кровяными выделениями. В тяжелых случаях летальный исход. Оказание первой помощи пострадавшему:
Тип пищевой добавкиКарбонатная аммонийная соль (карбонат аммония) – это пищевой консервант, Е503. Пищевая добавка считается полностью безопасной. Отличима от технической версии сниженной концентрацией. Применяется, в качестве кислотного регулятора, дрожжей, разрыхлителя, эмульгатора (индексы Е500-599). Смешивает до однородности жидкости разных консистенций, например: масло и воду. Под термическим влиянием становится полностью безопасной. Опасна только в исходном техническом состоянии (для промышленного применения, удобрений). Класс опасности и токсичностьВ связи с различным влиянием на организм и окружающую среду, карбонату аммония присвоено несколько классов опасности. Общие сведения о воздействии на организм по ГОСТу- малоопасное вещество 4 класс.
По СГС карбонат аммония классифицируется, как средство для коррозии металлов. Присвоено сигнальное слово: ОПАСНО! Предупредительная маркировка по ГОСТу 31340-2013. Предотвращение вредного воздействия при чрезвычайных\аварийных ситуациях:
ВАЖНО! Ходить по объекту только в защитном костюме! Порядок ликвидации аварийной протечки:
Обеспечение пожаровзрывоопасностиЖидкий аммиачный раствор углекислого аммония не взрывоопасен, не горюч но, распадаясь, выделяет взрывоопасные концентрированные аммиачные пары. Выделяемый газ легко воспламеняется, загорается.
Распространение пламени в кислороде 15-28 объемных аммиачных долей. Аммиак – продукт термической деструкции. Не вдыхать! Оказывает раздражающее и прижигающее действие на бронхиально-легочную систему. Запрещенных средств для пожаротушения не выявлено. Можно использовать воду, пену, инертные газы. тушить с максимального расстояния для обеспечения безопасности. Тушить в огнеупорном костюме с самоспасателем, использовать дыхательные аппараты с избыточным давлением. Хранение и упаковкаУпаковывают углекислый аммоний в полиэтиленовые мешки, весом от 25 кг. Жидкий раствор в металлических цистернах, герметично закрытых крышкой. Хранят в сухих складских помещениях при температуре 15-25 °C, вдали от солнечных лучей. Срок хранения – 365 дней с даты изготовления. ТранспортировкаЛюбым видом транспорта, кроме воздушного, соблюдая правила перевозки взрывоопасных грузов. Где купить и сколько стоитПриобрести карбонат аммония можно у завода изготовителя, официального дистрибьютора или через интернет. Они помогут определиться с количеством, организуют доставку, согласно правилам перевозки. Стоимость от 30 руб\кг. Возможна покупка оптом. Соответственно цена снизится, уточняйте у поставщика. Пищевой карбонат аммония – это пищевая добавка E503, которая считается безопасной для человека. Технический карбонат аммония способен повлечь смерть при ингаляционном и пероральном поражении. На воздухе вещество воспламеняется. Соблюдайте меры предосторожности, работайте с веществом только в перчатках, не вдыхайте пары. Карбонат аммония
Карбонат аммония, углекислый аммоний, (NH4)2CO3 — аммониевая соль угольной кислоты. СодержаниеСвойстваБесцветные кристаллы соединения хорошо растворимы в воде. Карбонат аммония очень неустойчив как на воздухе, так и в растворе, так как уже при комнатной температуре выделяет аммиак, превращаясь в гидрокарбонат аммония NH4HCO3 . При температуре 60 °C быстро распадается на NH3 , CO2 и H2O . (NH4)2CO3 + H2O ⇄ NH4HCO3 + NH4OH ПрименениеНа процессе разложения, связанном с выделением газов, основано применение карбоната аммония вместо дрожжей в хлебопечении и кондитерской промышленности (пищевая добавка E503). Получают карбонат аммония взаимодействием газообразных NH3 , CO2 и H2O при быстром охлаждении продуктов реакции. Технический продукт содержит наряду с (NH4)2CO3 соединение гидрокарбоната аммония с карбаминатом аммония NH4HCO3 ⋅ NH4COONH2 . Карбонат аммония применяется для получения сульфата аммония из гипса по реакции При этом карбонат аммония можно вводить в виде раствора (жидкостный процесс конверсии), вместо карбоната аммония можно вводить газообразные NH3 и CO2 (газовый процесс конверсии), а также можно вводить газообразные NH3 и CO2 дополнительно к раствору (NH 4)2CO3 в количестве 10—15 % стехиометрического количества в расчёте на CaSO4 (газожидкостный процесс конверсии). В последнем случае при растворении газов выделяется дополнительная теплота, необходимая для протекания реакции. Карбонат аммония может рассматриваться как источник карбонат-ионов и в перспективе может применяться, например, для осаждения солей магния для отделения его от солей калия. При добыче калия из морской воды соли калия выделяются вместе с солями магния и не могут быть очищены от него перекристаллизацией. При добавлении карбоната аммония магний выпадает в осадок в виде карбоната, в растворе остаются в основном хлорид калия и хлорид аммония, которые впоследствии могут быть разделены (рекристаллизацией или возгонкой), либо не разделяться, а использоваться как азотно-калийное удобрение. Также карбонат аммония применяется:
Карбонат аммония: свойства, структура, применение и рискиКарбонат аммония: свойства, структура, применение и риски — Наука Содержание:В карбонат аммония представляет собой неорганическую азотную соль, в частности аммиачную, химическая формула которой (NH4)2CO3. Изготовлен синтетическими методами, среди которых выделяется использование сублимации смеси сульфата аммония и карбоната кальция: (NH4)2ЮЗ4(s) + CaCO3(s) => (NH4)2CO3(s) + CaSO4(s). Обычно соли карбоната аммония и кальция нагревают в сосуде для получения карбоната аммония. Промышленный метод получения тонны этой соли состоит в пропускании диоксида углерода через абсорбционную колонну, содержащую раствор аммиака в воде, с последующей дистилляцией. Пары, содержащие аммоний, диоксид углерода и воду, конденсируются с образованием кристаллов карбоната аммония: 2NH3(г) + H2О (л) + СО2(г) → (NH4)2CO3(s). Угольная кислота, H2CO3, после того, как углекислый газ растворяется в воде, и именно эта кислота отдает свои два протона, H + , до двух молекул аммиака. Физические и химические свойстваЭто белое, кристаллическое и бесцветное твердое вещество с сильным запахом аммиака и привкусом. Он плавится при 58ºC, разлагаясь на аммиак, воду и углекислый газ: в точности предыдущее химическое уравнение, но в противоположном направлении. Однако это разложение происходит в два этапа: сначала выделяется молекула NH.3, производя бикарбонат аммония (NH4HCO3); и, во-вторых, если нагревание продолжается, карбонат становится непропорциональным, выделяя еще больше газообразного аммиака. Это твердое вещество, хорошо растворимое в воде и менее растворимое в спиртах. Он образует водородные связи с водой, и когда 5 граммов растворяется в 100 граммах воды, образуется щелочной раствор с pH около 8,6. Его высокое сродство к воде делает его гигроскопичным твердым веществом (впитывает влагу), поэтому его трудно найти в безводной форме. Фактически, его моногидратная форма (NH4)2CO3ЧАС2O), является наиболее распространенным из всех и объясняет, как соль переносит газообразный аммиак, вызывающий запах. На воздухе он разлагается с образованием бикарбоната аммония и карбоната аммония (NH4NH2CO2). Химическая структураНа верхнем изображении показана химическая структура карбоната аммония. В середине — анион CO3 2– , плоский треугольник с черным центром и красными сферами; а с двух сторон катионы аммония NH4 + с четырехгранной геометрией. Геометрия иона аммония объясняется sp-гибридизацией. 3 атома азота, расположив атомы водорода (белые сферы) вокруг него в форме тетраэдра. Между тремя ионами взаимодействия устанавливаются водородными связями (H3N-H- O-CO2 2– ). Благодаря своей геометрии одиночный анион CO3 2– может образовывать до трех водородных связей; катионы NH4 + они могут быть не в состоянии образовать соответствующие четыре водородные связи из-за электростатического отталкивания между их положительными зарядами. Результатом всех этих взаимодействий является кристаллизация орторомбической системы. Почему он такой гигроскопичный и растворимый в воде? Ответ находится в том же абзаце выше: водородные связи. Эти взаимодействия ответственны за быстрое поглощение воды из безводной соли с образованием (NH4)2CO3ЧАС2ИЛИ). Это приводит к изменению пространственного расположения ионов и, следовательно, кристаллической структуры. Структурные курьезыТак же просто, как (NH4)2CO3, он настолько чувствителен к бесконечности преобразований, что его структура остается загадкой для истинного состава твердого тела. Эта структура также меняется в зависимости от давления, которое влияет на кристаллы. Некоторые авторы обнаружили, что ионы расположены в виде компланарных цепочек с водородными связями (то есть цепочки с последовательностью NH4 + -CO3 2– -…), в которых, вероятно, молекулы воды служат связующими звеньями с другими цепями. Кроме того, что касается этих кристаллов, выходящих за пределы земного неба, в космосе или в межзвездных условиях? Каков их состав с точки зрения устойчивости карбонатных разновидностей? Существуют исследования, подтверждающие большую стабильность этих кристаллов, захваченных планетными ледяными массами и кометами. Это позволяет им действовать как запасы углерода, азота и водорода, которые, получая солнечное излучение, могут быть преобразованы в органический материал, такой как аминокислоты. Другими словами, эти замороженные аммиачные блоки могут быть носителями «колеса, запускающего механизмы жизни» в космосе. По этим причинам его интерес к области астробиологии и биохимии растет. ПриложенияОн используется как разрыхлитель, так как при нагревании выделяет углекислый газ и газы аммония. Карбонат аммония, если хотите, является предшественником современных разрыхлителей и может использоваться для выпечки печенья и лепешек. Однако не рекомендуется для выпечки тортов. Из-за толщины лепешек газы аммония задерживаются внутри и имеют неприятный вкус. Он используется как отхаркивающее средство, то есть облегчает кашель, снимая отек бронхов. Обладает фунгицидным действием, поэтому используется в сельском хозяйстве. Он также является регулятором кислотности, присутствующей в пище, и используется в органическом синтезе мочевины в условиях высокого давления и гидантоинов. РискиКарбонат аммония очень токсичен. При контакте вызывает у человека острое раздражение ротовой полости. Также при проглатывании вызывает раздражение желудка. Аналогичное действие наблюдается в глазах, подвергшихся воздействию карбоната аммония. Вдыхание газов, образующихся при разложении соли, может вызвать раздражение носа, горла и легких, вызывая кашель и респираторную недостаточность. Острое воздействие карбоната аммония на голодных собак в дозе 40 мг / кг массы тела вызывает рвоту и диарею. Более высокие дозы карбоната аммония (200 мг / кг массы тела) часто приводят к летальному исходу. Причиной смерти указывается повреждение сердца. При нагревании до очень высоких температур в воздухе, обогащенном кислородом, он выделяет токсичные газы NO.2. Ссылки
Значение символа медицины Карбокация: образование, характеристики, типы, стабильность источники: http://chem.ru/karbonat-ammonija.html http://ru1.warbletoncouncil.org/carbonato-amonio-16225 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||