Нитрат кальция: способы получения и химические свойства
Нитрат кальция Ca(NO3)2 — соль щелочного металла кальция и азотной кислоты. Белый, при нагревании разлагается. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 164,09; относительная плотность для тв. и ж. состояния d = 2,36; tпл = 561º C (разлагается).
Способ получения
1. Нитрат кальция можно путем взаимодействия кальция и разбавленной азотной кислоты, образуется нитрат кальция, оксид азота (I) и вода:
если кальций будет взаимодействовать с очень разбавленной азотной кислотой , то на выходе будет образовываться нитрат кальция, нитрат аммония и вода:
2. В результате взаимодействия сульфида кальция и концентрированной азотной кислоты образуется нитрат кальция, сера, оксид азота (IV) и вода:
Качественная реакция
Качественная реакция на нитрат кальция — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат кальция образует сульфат кальция, нитрат меди, бурый газ оксид азота и воду:
Химические свойства
1. Hитрат кальция разлагается при температуре 450 — 500º С с образованием нитрита кальция и кислорода:
а если температуре поднимется выше 561 о С, то на выходе реакции будут образовываться оксид кальция, оксид азота (IV) и кислород:
2. Нитрат кальция реагирует с простыми веществами :
2.1. Нитрат кальция вступает в реакцию с атомным водородом (цинком и в присутствии соляной кислоты). В результате реакции образуется нитрат кальция и вода :
3. Возможны реакции между нитратом кальция и сложными веществами :
Нитрат кальция вступает в реакцию с cолями :
В результате реакции между нитратом кальция и гидрофосфатом натрия при кипении образуется фосфат кальция, азотная кислота и нитрат натрия:
Нитрат кальция ГОСТ 4142-77
| Нитрат кальция | |
|---|---|
 | |
 | |
 | |
| Традиционные названия | кальциевая селитра, норвежская селитра, азотнокислый кальций |
| Хим. формула | Ca(NO3)2 |
| Состояние | гранулы сферической формы белого, светло-серого, светло-бежевого цвета |
| Молярная масса | |
| Т. всп. | негорючая °C |
| Мол. теплоёмк. | 149,33 Дж/(моль·К) |
| Энтальпия образования | -937,2 кДж/моль |
| Растворимость в воде | Безводной: 121,2 г/100 мл (20 °C); 271,0 г/100 мл (40 °C); 359 г/100 мл (51,6 °C). Тетрагидрата: 102 г/100 мл (0 °C); 129 г/100 мл (20 °C); (100 °C) 363 г/100 мл |
| Растворимость в | спирте и ацетоне |
| Кристаллическая структура | |
| Рег. номер CAS | |
| PubChem | 24963 |
| Рег. номер EINECS | 233-332-1 |
| SMILES | |
| RTECS | EW2985000 |
| ChEBI | 64205 |
| Номер ООН | 1454 |
| ChemSpider | 23336 и 21500286 |
| ГОСТ | ГОСТ 4142-77 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Кальция нитрат (кальциевая селитра, азотнокислый кальций) — неорганическая соль азотной кислоты. Соединение сильно гигроскопично, поэтому его хранят без доступа влаги. Химическая формула Ca(NO3)2.
Содержание
- 1 Свойства
- 1.1 Физические свойства
- 1.2 Химические свойства
- 2 Получение
- 2.1 Реакции с получением нитрата кальция
- 3 Применение
- 3.1 В сельском хозяйстве
- 3.2 В пиротехнике
Свойства
Физические свойства
Химические свойства
При 500 °C начинает разлагаться с выделением O2 и образованием сначала Ca(NO2)2, а затем CaO и NO2. Кальциевая селитра при нормальных условиях негорючая, пожаро- и взрывобезопасная, устойчивая в интервале температур от −60 °C до +155 °C.
Получение
Получают кальция нитрат действием HNO3 на известняк или поглощением нитрозных газов (в основном NO2) известковым молоком. Применяют кальция нитрат как азотное удобрение и для получения особо чистого CaO.
Для получения гранулированной кальциевой селитры используется способ низкотемпературной нейтрализации азотной кислоты природным известняком или продуктами переработки известняка.
Реакции с получением нитрата кальция
Нитрат кальция производится путём обработки известняка с азотной кислотой, после нейтрализации аммиака:
Он также является побочным продуктом процесса Оддо при добыче фосфата кальция:
Так же как нитраты других щелочноземельных металлов и LiNO3, кальциевая селитра при нагревании разлагается на выпуске диоксида азота:
Также нитрат кальция можно получить проделав следующие реакции:
Также образование нитрата кальция возможно и за счет атмосферных явлений:
Применение
Гранулированный, безводный нитрат кальция, применяется как добавка в бетон, в качестве удобрения, для приготовления рассола в холодильной технике, в производстве реактивов, стеклопластиков, а также как один из компонентов для производства взрывчатки.
В сельском хозяйстве
Нитрат кальция является физиологическим щелочным удобрением, пригодным для всех почв и прежде всего для закисленных почв. В сельском хозяйстве применяют как азотное удобрение. Выпускают в гранулированном виде; товарный продукт должен содержать не менее 15,5 % азота, кроме того, к нему добавляют в процессе производства 4—7 % нитрата аммония для уменьшения гигроскопичности удобрения; содержание влаги не должно превышать 15 %. Нитрат кальция вносят под все культуры. Наиболее эффективен на кислых почвах, особенно для весенней подкормки озимых.
В пиротехнике
Несмотря на то, что нитрат кальция в смеси с горючими веществами способен давать недорогой источник кирпично-красного пламени, применение его в этом качестве крайне ограничено из-за сильной гигроскопичности.
Структура нитрата кальция (Ca (NO3) 2), свойства, применение и применение
нитрат кальция третичная неорганическая соль, химическая формула которой Ca (NO)3)2. Из его формулы известно, что его твердое вещество состоит из ионов Ca 2+ и НЕТ3 — в соотношении 1: 2. Следовательно, это соединение чисто ионной природы.
Одним из его свойств является его окислительный характер благодаря нитрат-аниону. Он не горючий, то есть не горит при высоких температурах. Будучи негорючим, он представляет собой надежный сейф, с которым можно обращаться без особой осторожности; однако, это может ускорить воспламенение горючих материалов..
Его внешний вид состоит из гранулированного твердого вещества, которое имеет белый или светло-серый цвет (верхнее изображение). Может быть безводным или тетрагидратированным, Ca (NO3)2· 4H2О. Он очень растворим в воде, метаноле и ацетоне.
Нитрат кальция широко используется в качестве удобрения, поскольку он легко перемещается во влажной почве и быстро усваивается корнями растений. Он обеспечивает два важных элемента для питания и роста растений: азот и кальций.
Азот является одним из трех важнейших элементов для развития растений (N, P и K), имеет важное значение в синтезе белков. Между тем, кальций необходим для поддержания структуры клеточной стенки растений. По этой причине Ca (НЕТ3)2 это предназначено много в сады.
С другой стороны, эта соль обладает токсическим действием, особенно при непосредственном контакте с кожей и глазами, а также при вдыхании ее пыли. Кроме того, он может разлагаться при нагревании.
- 1 Структура нитрата кальция
- 2 Физические и химические свойства
- 2.1 Химические названия
- 2.2 Молекулярная формула
- 2.3 Молекулярный вес
- 2.4 Внешний вид
- 2.5 Точка кипения
- 2.6 Точка плавления
- 2.7 Растворимость в воде
- 2.8 Растворимость в органических растворителях
- 2.9 Кислотность (пКа)
- 2.10 Плотность
- 2.11 Разложение
- 2.12 Реактивный профиль
- 3 использования
- 3.1 Сельское хозяйство
- 3.2 Бетон
- 3.3 Очистка сточных вод или сточных вод
- 3.4 Приготовление холодных компрессов
- 3.5 Латексная коагуляция
- 3.6 Передача и хранение тепла
- 4 анкеты
- 5 ссылок
Структура нитрата кальция
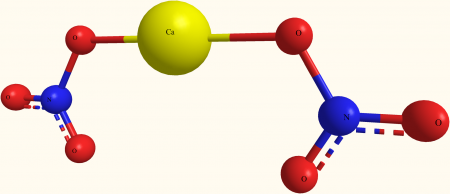
Структура Ca (NO) показана на изображении выше3)2 в модели сфер и баров. Здесь, однако, есть недостаток: предполагается существование ковалентных связей Ca-O, что противоречит его ионному характеру. Разъяснение этого, действительно взаимодействия имеют электростатический тип.
Катион Са 2+ окружен двумя NO анионов3 — в соответствии с его пропорциями в кристалле. Азот в форме нитрата преобладает в кристаллической структуре.
Ионы сгруппированы таким образом, что они устанавливают конфигурацию, минимальным выражением которой является элементарная ячейка; который для безводной соли является кубическим. Другими словами, из кубов, содержащих для этих ионов соотношение 1: 2, кристалл воспроизводится полностью.
С другой стороны, тетрагидратированная соль Ca (NO)3)2· 4H2Или это имеет четыре молекулы воды на комплект NO3 — Калифорния 2+ НЕТ3 — . Это изменяет кристаллическую структуру, превращая ее в моноклинную элементарную ячейку.
Следовательно, ожидается, что кристаллы для обеих солей, безводной и тетрагидратированной, будут разными; различия, которые можно определить по их физическим свойствам, например, по точкам плавления.
Физико-химические свойства
Химические названия
-Норвежская селитра и известь сальпетро.
Молекулярная формула
Молекулярный вес
Безводный 164,088 г / моль и тетрагидрат 236,15 г / моль. Обратите внимание на влияние воды на молекулярную массу, и им нельзя пренебрегать при соответствующем взвешивании..
Внешний вид
Твердые или гранулы белого или светло-серого цвета. Кубические белые кристаллы или распущенные гранулы; то есть они впитывают влагу до такой степени, что они растворяются из-за их высокой растворимости.
Точка кипения
Безводная форма разлагается при нагревании до температуры, которая не позволяет определить ее температуру кипения; в то время как тетрагидратированная форма соли имеет температуру кипения 132 ° С (270 ° F, 405 К).
Точка плавления
-Безводная форма: от 561 ºC до 760 мм рт. Ст. (1042 ºF, 834 K).
-Тетрагидратированная форма: 42,7 ºC (109 ºF, 316 K).
Это показывает, как молекулы воды вмешиваются в электростатические взаимодействия между Са 2+ и НЕТ3 — внутри кристаллов; и, следовательно, твердое вещество плавится при значительно более низкой температуре.
Растворимость в воде
-Безводная форма: 1212 г / л при 20 ºC.
-Тетрагидратированная форма: 1290 г / л при 20 ºC.
Вода в кристаллах едва увеличивает растворимость соли.
Растворимость в органических растворителях
-В этаноле, 51,42 г / 100 г при 20 ºC.
-В метаноле 134 г / 100 г при 10 ºC.
-В ацетоне, 168 г / 100 г при 20 ºC.
Кислотность (пКа)
плотность
2,5 г / см 3 при 25 ° С (тетрагидрат).
разложение
Когда нитрат кальция нагревается до ламп накаливания, он разлагается на оксид кальция, оксид азота и кислород.
Реактивный профиль
Это сильно окисляющий агент, но он не горючий. Ускоряет воспламенение горючих материалов. Разделение нитрата кальция на мелкие частицы облегчает его взрыв, когда соединение подвергается длительному воздействию огня..
Смеси с алкиловыми эфирами становятся взрывоопасными при образовании алкилнитратных сложных эфиров. Комбинация нитрата кальция с фосфором, хлоридом олова (II) или другим восстановителем может реагировать взрывоопасно.
приложений
сельское хозяйство
Он используется в сельскохозяйственных культурах в качестве источника азота и кальция. Нитрат кальция очень хорошо растворяется в воде и легко усваивается корнями растений. Кроме того, он не окисляет почвы, потому что их ионы не могут значительно гидролизовать.
Избегайте смешивания с удобрениями, содержащими фосфор или сульфат, чтобы избежать образования нерастворимых солей. Вследствие своей гигроскопичности его следует хранить в сухом и прохладном месте..
Его использование имеет преимущество перед использованием аммиачной селитры в качестве удобрения. Хотя это последнее соединение вносит азот в растения, оно препятствует усвоению кальция, что может привести к дефициту кальция в растениях..
Кальций способствует поддержанию структуры клеточной стенки растений. При наличии дефицита кальция ткани, образующие растения, такие как кончики корней, молодые листья и кончики почек, часто демонстрируют искаженный рост..
Снижение содержания аммония
Нитрат кальция уменьшает накопление летучих жирных кислот и фенольных, фитотоксичных соединений, которые накапливаются вследствие разложения остатков соевых культур.
Кроме того, нитрат кальция имеет тенденцию к снижению концентрации аммония в почве, что увеличивает буферную емкость водорода.
бетон
Нитрат кальция используется для сокращения времени схватывания бетона. Это происходит в результате образования гидроксида кальция, возможно, в результате реакции двойного вытеснения..
Кроме того, нитрат кальция вызывает образование соединения гидроксида железа, защитное действие которого снижает его коррозию. То есть присутствующее железо может реагировать с основными компонентами бетона, такими как сам гидроксид кальция.
Нитрат кальция уменьшает время схватывания, а также прочность бетона, к которому был добавлен вулканический пепел. Для изучения влияния добавления нитрата кальция к бетону были использованы возрастающие концентрации нитрата кальция, от 2% до 10%..
Наблюдается большее уменьшение времени схватывания, а также увеличение прочности бетона, так как концентрация нитрата кальция увеличилась до 10%..
Сточные воды или очистка сточных вод
Нитрат кальция используется для уменьшения неприятных запахов из сточных вод за счет уменьшения образования сероводорода. Кроме того, органическое вещество, которое генерирует анаэробные условия, потребляется, что препятствует выживанию многих биологических видов..
Приготовление холодных компрессов
Тетрагидрат нитрата кальция является эндотермическим соединением, то есть обладает способностью поглощать тепло из окружающей среды. Это приводит к охлаждению тел, которые входят в контакт с контейнерами, которые его содержат.
Компрессы повышают их температуру, и для их регенерации достаточно поместить их в морозильник
Латексная коагуляция
Нитрат кальция используется в фазе коагуляции латекса. Он является частью иммерсионного раствора, и когда он вступает в контакт с раствором, содержащим латекс, он нарушает его стабилизацию и вызывает его коагуляцию.
Передача и хранение тепла
Бинарная смесь солей расплавленных нитратов, включая кальций с другими нитратами, используется вместо термального масла на солнечных электростанциях для передачи и хранения тепла..
Анкеты
-Применяется нитрат кальция в смеси с почвой в концентрации 1,59 кг на 30,48 м. 2 , с адекватным поливом. Нитрат кальция растворяется в воде, что позволяет его усвоению корнями растения. В гидропонных культурах растворяется в воде культуры.
-Нитрат кальция также используется в виде спрея для опрыскивания листьев и цветов, что является эффективным средством для предотвращения гниения цветка томата, пятна от пробки и горькой косточки яблока..
-К бетонообразующей смеси добавляется некоторое количество нитрата кальция (цемент, песок, камни и вода), и определяется влияние его добавления на конкретные свойства бетона; такие как установка скорости и сопротивления.
-Нитрат кальция добавляется в подходящей концентрации, чтобы уменьшить запахи из сточных вод или сточных вод до уровня, чтобы запахи были приемлемыми для людей.
http://chem.ru/nitrat-kalcija.html
http://ru.thpanorama.com/articles/qumica/nitrato-de-calcio-cano32-estructura-propiedades-usos-y-aplicaciones.html






