Нитрат магния: способы получения и химические свойства
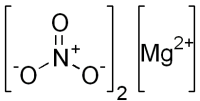
Нитрат магния Mg(NO3)2 — соль магния и азотной кислоты. Белый. При нагревании разлагается. Хорошо растворяется в воде (гидролиз по катиону).
Относительная молекулярная масса Mr = 148,31; относительная плотность для тв. и ж. состояния d = 1,636;
Способ получения
1. Нитрат магния можно путем взаимодействия магния и разбавленной азотной кислоты, образуется нитрат магния, оксид азота (I) и вода:
Качественная реакция
Качественная реакция на нитрат магния — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат магния образует сульфат магния, нитрат меди, бурый газ оксид азота и воду:
Химические свойства
1. Hитрат магния разлагается при температуре выше 300º С с образованием оксида магния, оксида азота (IV) и кислорода:
2. Возможны реакции между нитратом магния и сложными веществами :
2.1. Нитрат магния вступает в реакцию с основаниями :
2.1.1. В результате реакции между нитратом магния и разбавленным раствором гидроксида натрия образуется гидроксид магния и нитрат натрия:
Нитрат магния ГОСТ 11088-75
| Нитрат магния | |
|---|---|
 | |
| Систематическое наименование | Нитрат магния |
| Хим. формула | Mg(NO3)2 |
| Рег. номер CAS | 10377-60-3 |
| PubChem | 25212 |
| Рег. номер EINECS | 233-826-7 |
| SMILES | |
| ChEBI | 64736 |
| ChemSpider | 23415 |
| ГОСТ | ГОСТ 11088-75 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Нитрат магния Mg(NO3)2 — бесцветные гигроскопичные кристаллы с кубической решеткой (а = 0,748 нм, пространств. группа Ра3); температура плавления 426 °C (с разложением); С°р 141,9 Дж/(моль. К); DH0обр −792,8 кДж/моль, DG0обр −591,4 кДж/моль. Выше 300 °C начинает разлагаться на MgO и оксиды азота. Растворимость в воде (г в 100 г): 73,3 (20 °C), 81,2 (40 °C), 91,9 (60 °C). Растворим также в этаноле, метаноле, жидком NH3. Из водных растворов в зависимости от концентрации кристаллизуются нона-, гекса- и дигидраты.
Известен также метастабильный тетрагидрат. Гексагидрат — бесцветные кристаллы. Существует в трех модификациях. При —13-66 °C устойчива форма с моноклинной решеткой (а = 0,619 нм, b = 0,127 нм, с = 0,666 нм, b = 93°, пространств. группа P21/c); т. пл. 90 °C; плотность 1,46 г/см3; DH0пл 41,0 кДж/моль, DH0обр −2614,7 кДж/моль; S0298 427 Дж/(моль. К); уравнение температурной зависимости давления пара Н2О над твердым веществом: lgр(мм рт. ст.) = 10,0372 — 3088/Т (293—323 К); выше 90 °C обезвоживается до дигидрата, затем происходит отщепление воды с частичным гидролизом и разложение до MgO. Дигидрат — бесцветные кристаллы с моноклинной решеткой (а = 0,581 нм, b = 0,599 нм, с = 0,865 нм, b = 90,7°, пространств. группа Р21/с); т. пл. 130 °C; плотн. 2,02 г/см3; DH0обр −1411,4 к Дж/моль; S0298 251 Дж/(моль. К).
Магния нитрат образует с N2O4 аддукт состава Mg(NO3)2.N2O4, разлагающийся выше 50 °C, а также аммины [Mg(NH3)J(NO3)2 и двойные соли с нитратами др. металлов. Безводный магния нитрат получают взаимодействием Mg с N2O4 с последующим отщеплением N2O4, гидратированный — реакцией MgCO3 или MgO с разбавлением HNO3. Гексагидрат — исходное соединение при синтезе MgO особой чистоты, нитратов др. металлов, а также разложении соединений Mg;
30-40% растворы нитрата магния технической чистоты, получаемые азотнокислотным разложением магнийсодержащего сырья (чаще, каустического магнезита или брусита) нашли применение в производстве концентрированной азотной кислоты (как обезвоживающий агент) и гранулированной аммиачной селитры (как модифицирующая добавка).
Компонент сложных удобрений, поскольку магний входит в состав хлорофилла, который необходим для фотосинтеза, способствует повышению активности многих ферментов и выступает в роли транспортера фосфора. Высокая растворимость и низкая электропроводность делают продукт исключительно подходящим для листовой подкормки и фертигации, особенно при использовании оросительных вод с высокой концентрацией солей. Удобрение используется для корневого и некорневого питания овощных, ягодных, плодовых культур, винограда; окислитель в пиротехнических составах. Применение нитрата магния, как удобрения, в кристаллической или гранулированных формах, несмотря на содержание в его составе двух питательных компонентов в водорастворимой форме — собственно, магния и азота ( в виде нитрат-иона), и высокую агрохимическую эффективность, существенно ограничивается значительной гигроскопичностью продукта и повышенной склонностью к слеживаемости при хранении и транспортировке.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. источники: http://chem.ru/nitrat-magnija.html http://acetyl.ru/o/nmg11n1o32.php |



