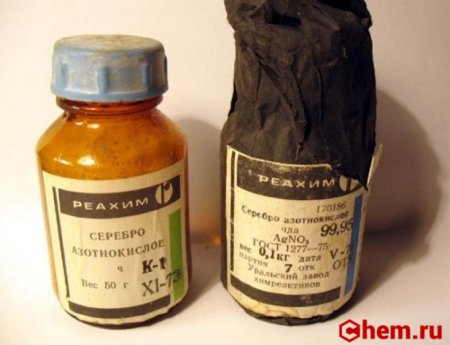
Нитрат серебра I
| Нитрат серебра | |
|---|---|
 | |
| Систематическое наименование | Нитрат серебра |
| Традиционные названия | Адский камень, ляпис |
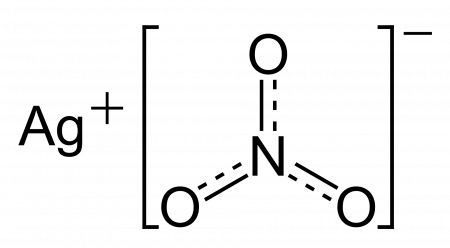
| Хим. формула | AgNO3 |
| Рац. формула | AgNO3 |
| Состояние | твёрдое |
| Молярная масса | 169,87 г/моль |
| Плотность | 4,352 |
| Температура | |
| • плавления | 209,7 |
| • разложения | 440 |
| Мол. теплоёмк. | 93,1 Дж/(моль·К) |
| Энтальпия | |
| • образования | −124,4 кДж/моль |
| Растворимость | |
| • в воде | 122,2 (0 °C); 222,5 (20 °C); 373 (40 °C); 912 (100 °C) |
| Показатель преломления | 1,744 |
| Рег. номер CAS | 7761-88-8 |
| PubChem | 24470 |
| Рег. номер EINECS | 231-853-9 |
| SMILES | |
| RTECS | VW4725000 |
| ChEBI | 32130 |
| Номер ООН | 1493 |
| ChemSpider | 22878 |
| ЛД50 | 20 мг/кг (собака, орально) 800 мг/кг (кролик, орально) |
| Токсичность | ядовит, коррозионно-активен |
| Пиктограммы СГС |     |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитрат серебра (азотнокислое серебро, «адский камень», ляпис от итал. lapis «карандаш» /лат. lapis «камень») — неорганическое соединение, соль металла серебра и азотной кислоты с формулой AgNO3, бесцветные ромбические кристаллы, растворимые в воде. Не образует кристаллогидратов.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
- 4.1 Использование в медицине
- 5 Токсичность
- 6 Галерея
Получение
Нитрат серебра может быть получен растворением серебра в азотной кислоте по реакции:
Ag + 2 HNO3 ⟶ AgNO3 + NO2 ↑ + H2O
Физические свойства
Плотность — 4,352 г/см³. Температура плавления — 209,7 °C. При температуре выше 300 °C начинает разлагаться на серебро, кислород и оксид азота(IV), при 440 °C разлагается полностью. Хорошо растворим в воде, растворимость 222,5 г/100 г ; растворимость в метиловом спирте — 3,6 г/100 г ; в этиловом спирте — 2,12 г/100 г ; в ацетоне — 0,44 г/100 г ; в пиридине — 33,6 г/100 г , ацетонитриле (все растворимости — при 20 °C).
Нитрат серебра(I) обладает жгуче-кислым вкусом.
Химические свойства
Нитрат серебра является реактивом на соляную кислоту и соли соляной кислоты, поскольку взаимодействует с ними с образованием белого творожистого осадка хлорида серебра, нерастворимого в азотной кислоте:
HCl + AgNO3 ⟶ AgCl ↓ + HNO3 NaCl + AgNO3 ⟶ AgCl ↓ + NaNO3
Образует осадки с водными растворами бромидов, йодидов, фосфатов, тиоцианатов, цианидов, сульфидов.
При нагревании разлагается, выделяя металлическое серебро:
2 AgNO3 → 350∘C 2 Ag + 2 NO2 + O2 Реагирует с щелочью с образованием оксида: 2 AgNO3 + 2 NaOH ⟶ Ag2O + 2 NaNO3 + H2O в этаноле, при -50 градусах, образуется гидроксид серебра AgNO3 + NaOH → C2H5OH−50 AgOH ↓ + KNO3 ↓
Применение
Нитрат серебра применяется:
- в гальванотехнике как источник ионов серебра;
- в аналитической химии как реактив на хлориды;
- в фотографии как компонент проявителей, усилителей и других растворов;
- в медицине, как средство для прижигания кожи.
Использование в медицине
Нитрат серебра используется в медицине в виде сплава нитрата серебра и нитрата калия) иногда отлитый в виде палочек — ляписного карандаша для прижигания и стерилизации ран, удаления мелких бородавок.
Лечебное действие нитрата серебра заключается в подавлении жизнедеятельности микроорганизмов, в небольших концентрациях он действует как прижигающее, противовоспалительное и вяжущее средство, а концентрированные растворы, как и кристаллы AgNO3, прижигают живые ткани.
Впервые ляпис (адский камень) применили врачи Ян-Баптист ван Гельмонт и Франциск де ла Бое Сильвий, которые научились получать нитрат серебра взаимодействием металла с азотной кислотой. Они обнаружили, что прикосновение к кристаллам полученного вещества приводит к появлению на коже чёрных пятен, а при длительном контакте — глубоких ожогов.
Токсичность
Нитрат серебра ядовит. Минимальная смертельная доза ЛД50 для собак — 20 мг/кг, для кроликов — 800 мг/кг. Класс опасности — 2.
Коррозионно-активен, при контакте с кожей может вызывать химические ожоги. Оставляет на коже чёрные пятна.
Что такое азотнокислое серебро? Свойства, получение и применение азотнокислого серебра
Компонент эликсира бессмертия. Ян Батист Ван-Гельмонт утверждал, что создал чудесный напиток еще в 16-ом веке. Основой эликсира стало азотнокислое серебро. Собственно, Ян Батист его и получил.
Этот бельгиец совмещал должности химика, физиолога и врача. Полученное Батистом вещество назвали ляписом инферналисом. Переводится термин как «адский камень». Он оказался неудачным компонентом эликсира бессмертия, оправдав свое название. Как? Расскажем далее.
Что такое азотнокислое серебро?
Формула азотнокислого серебра: — ArNO3. NO3 здесь – остаток азотной кислоты . Ее формула — HNO3. Поэтому серебро и названо азотнокислым. Соединение сохраняет разъедающую способность кислоты .
Формула азотнокислого серебра
Попадая на тело, нитрат окрашивает его в черный цвет. Спустя некоторое время потемневшая кожа разлагается, образуются язвы. Собственно, поэтому азотнокислое серебро и назвали адским камнем. Если же следовать терминологии химиков, соединение относится к солям азотной кислоты .
Под терминами «ляпис», «азотнокислое серебро» скрываются белесые кристаллы , напоминающие по форме ромбы. Ни от блеска серебра , не от его цвета ни осталось и следа. Кристаллы у чистого серебра , кстати, тоже отличаются.
Агрегаты металла пластинчатые или подобные небольшим палочкам. Азотнокислое серебро – карандаш лишь в соответствии названию «ляпис». С итальянского слово переводится как «карандаш». Однако, понятие lapis есть и в латинском языке , где означает «камень».
Свойства азотнокислого серебра
У ромбических кристаллов героя статьи высокая плотность – 4,3 грамма на кубический сантиметр. Для сравнения, у большинства минералов показатель не доходит до 4-ех, держась в диапазоне 2,4-3,6 граммов на кубический сантиметр.
Из героя статьи легко получить раствор азотнокислого серебра. В воде нитрат диссоциирует на 100% уже при 20-ти градусах тепла, то есть, в обычных условиях. В 100-та миллилитрах жидкости можно растворить 222 грамма соли .
Диссоциирует она и в этаноле, метаноле, но в меньших масштабах. В 100 граммах метанола растворяются лишь 3,6 грамма нитрата. В этаноле распадаются 2,2 грамма азотнокислого соединения.
При нагреве до 209-ти по шкале Цельсия нитрат серебра начинает плавиться. Повысив температуру еще на 90 градусов можно увидеть разложение соли. Впрочем, при нагреве распадаются все нитраты.
Внешний вид азотнокислого серебра
Что же касается разложения ими кожи, оно может пойти во благо. В малых количествах и в малой концентрации азотнокислое серебро не разъедает покровы, а лишь обеззараживает, убивая болезнетворные бактерии.
В химии нитрат серебра используют в качественной реакции определения соляной кислоты . Соединяясь с ней, герой статьи дает творожистый осадок. Это хлорид серебра . Второй продукт реакции – азотная кислота .
Кстати, герой статьи является реактивом не только для хлора , но всей второй группы анионов, то есть йода , сульфура и брома. С ними ионы серебра тоже сцепляются в нерастворимые осадки. Это бромид, сульфид и йодит.
Из нитрата серебра можно получить и чистый металл. Драгоценность выделяется электролизом. В раствор азотнокислого металла помещают катод и анод.
Первый под воздействием пропускаемого через жидкость тока притянет положительно заряженные частицы серебра . Останется слить раствор. Реакцию важно проводить в фарфоровой , керамической или пластиковой ванночках. Металлическая посуда не подходит.
Получение азотнокислого серебра
Ван Батист Ван-Гельмонт получил нитрат, растворяя серебро в концентрате азотной кислоты. Метод актуален по сей день. Однако, в процессе выпадают токсичные окислы азота .
Дабы избежать их образования, серебро травят при нагреве кислоты . Полученный раствор упаривают до концентрата. Его кристаллизуют. Вот и получено серебро азотнокислое. ГОСТ для него – «1277-75».
Существуют разработки, позволяющие исключить процесс упаривания, а так же, допускающие использование 100-процентной азотной кислоты . Обычно, разводят 98-процентную.
Исключает метод и нагревание. Температура повышается за счет экзотермической реакции. Всем изменениям стандартное взаимодействие нитрата с азотной кислотой обязано введению в раствор кислорода .
Он поступает в виде озона с формулой О3 или перекиси водорода с записью H2O2. Они не загрязняют раствор, а лишь снижают расход кислоты . Сразу получается концентрат, пригодный для кристаллизации.
Усовершенствованным методом производства героя статьи пользуются, к примеру, в «ЛенРеактиве». Выпуск солей металлов, в том числе и азотнокислого серебра , предприятие ведет в 2012-го года.
Специализируются на товарах с пометкой «ХЧ». Это значит, что реактивы химически чистые. Такие добавляют в пищу, лекарства, косметику. Куда именно можно примешать нитрат серебра , расскажем в следующей главе.
Применение азотнокислого серебра
Купить азотнокислое серебро стремятся стоматологи. Они лечат героем статьи детский кариес. Это позволяет избежать пломбирования. Реагентом обрабатывают молочные зубы .
Соль серебра блокирует развитие кариеса. Появляется возможность дождаться появления коренных зубов, не рассверливая их предшественников. Минус метода состоит в цвете азотнокислого серебра . Оно чернит эмаль не хуже самого кариеса. Поэтому, для лечения коренных зубов реагент не используют.
Блокировка героем статьи развития кариеса связана с антибактериальными свойствами серебра. Его ионы убивают более 650-ти видов болезнетворных микроорганизмов, в том числе и разрушающие твердые ткани – кости , эмаль . Концентрированный нитрат прижигает, подобно йоду. Поэтому, азотнокислое серебро применяют при лечении эрозий и прочих язв, ранок.
Малая процентовка героя статьи в растворе позволяет использовать жидкость как вяжущее средство. Его действие направлено на коагуляциею белков на поверхности клеток.
Образуются плотные альбуминаты, то есть пленки из простых, растворимых в воде белков. Стенки из них прикрывают нервные окончания. Не получая импульсов, последние не передают в мозг сигналы о болях.
Получается, под вяжущими подразумеваются обезболивающие средства. Одно из них активно рекламируется, это «Альбумин». Он показан при ожогах, травматических шоках, нефритах.
Азотнокислое серебро в аптеке покупали раньше в качестве средства от болей при гастрите. Современные врачи перестали выписывать рецепт, поскольку появились более действенные и при этом щадящие препараты.
Их, как и нитрат серебра , применяют за 15-20 минут до еды. Остальные препараты с солью серебра наружные, максимум, рассчитаны для слизистых горла, носа. Выпускают мази, карандаши, растворы.
Помните рекламу «Протаргола»? Из нее понятно, что папа ходил за ним долго, а теперь достает в момент. Но, что такое «Протаргол»? Не что иное, как раствор серебра.
У него, кстати, нет противопоказаний кроме аллергических реакций и возраста до 3-ех лет. Если купить нитрат в виде карандаша и долго держать в руке , можно заработать химический ожог.
Относительным минусом препаратов с азотнокислым серебром становится их краткий срок хранения. Как правило, через месяц после распаковки, лекарства теряют силу.
Производители пользуются этим, делая лишь большие упаковки. Приходиться покупать, переплачивая, но использовать лишь частично. Пока потребители выкидывают просроченные лекарства, фармацевты считают прибыль.
Похоже на ситуацию с некоторыми антибиотиками в форме суспензии. Продают 500-миллиметровую банку, а ее содержимое портится через 3-5 суток после открытия.
Вне медицинской сферы нитрат серебра – компонент красителей для тканей и кожи . Помните, что и человеческую кожу соль чернит? К тому же, раствор нитрата предотвращает расплывание других красителей. Это относится не только к тканям, но и полиграфии.
Азотнокислое серебро чернит кожу
Добавляют азотнокислое серебро и в фотоэмульсии. Они обеспечивают четкость снимков. Действие реагента основано на светочувствительности всех галогенидов серебра.
Правда, приходиться сенсибилизировать вещества, то есть заставлять чувствовать лучи любых спектров. До процедуры нитрат воспринимает лишь голубой свет и ультрафиолет.
Порой, найти нитрат серебра можно на предприятиях по производству стеклопакетов. Там герой статьи служит реагентом при выявлении содержания оксида кальция в молекулярном сите.
Так именую влагопоглотитель. Его использование при производстве стекол прописано ГОСТом «24866-99». Смотрим пункт «4.2.3». Без молекулярного сита стеклопакеты получаются низкокачественными.
В химической промышленности азотнокислое серебро – катализатор и окислитель в ряде реакций. Раздел, к которому они относятся, именуют аналитической химией. В лабораториях, как правило, азотнокислое серебро изготавливают самостоятельно. Промышленники же часто закупают уже готовый нитрат. Узнаем, почем.
Цена азотнокислого серебра
Фирмы ставят ограничения на отпуск азотнокислого серебра физическим и юридическим лицам. Первые получают в одни руки разово не более 100-та граммов соли. Учитывается степень опасности соединения. Для предприятий рамок нет.
Продают нитрат и меньшими партиями, чем 100 граммов. «Химреактив», к примеру, предлагает химически чистый продукт в фасовке по 10 граммов. Стоят они около 60-ти рублей.
В «Хим ТТ» готовы продать и 1 грамм. Его стоимость равна 36-42-ум рублям . За килограмм кристаллов, соответственно просят десятки тысяч. Обычно, ценник варьируется от 30 000 до 50 000 рублей.
Нитрат серебра (азотнокислое серебро)
Нитрат серебра это бесцветные кристаллы которые очень быстро растворяются в воде и некоторых других растворителях, обладает токсичными свойствами.
Попадание на открытую кожу образует при длительном контакте химический ожог, при недолгом некоторое потемнение кожи от синевато фиолетового до черного цвета.
Именно поэтому получил название (адский камень), другое название : азотно-кислое серебро, ляпис (от слова камень).
Почти во всех реакциях проявляет окислительные свойства, признак реакции с нитратом серебра и хлоридом натрия, а также соляной кислотой это белый творожистый осадок хлорида серебра.
Который сереет на свету связи частичного восстановления серебра.
Что такое нитрат серебра AgNO3
Это неорганическое соединение, соль серебра, очень реакционно способное вещество (образует химические ожоги при попадания на кожу), как и все нитраты проявляет окислительные свойства.
Формула нитрата серебра AgNO3
( Ляпис ) основное получение реакцией серебра с азотной кислотой :
Получение нитрата серебра
Основное получение действием азотной кислоты на серебро содержащие материалы или шлам, основывается на окислении серебра сильной азотной кислотой, в результате чего получается нитрат серебра (азотно кислое серебро) оксид азота и вода.
В результате получается технический нитрат, для очищения реагируют с хлоридом натрия, почти чистый хлорид серебра (творожистый осадок) восстанавливают до металлического серебра, получается чистый нитрат серебра.
В производственных масштабах чистый нитрат серебра, получают из уже аффинированного серебра (не менее 99,8 %), реагируя его с азотной кислотой в присутствии кислорода (для доокисления высших в более высокие оксиды азота).
Нитрат серебра применение
Нитрат серебра раствор применяется в медицине как средство для прижигания свежих ранок и бородавок. Благодаря своим бактерицидным свойствами используется и в настоящее время как противовоспалительное средство.
Для лечения некоторых болезней язв, в акушерстве. Служит источником для получения других веществ в том числе и некоторых органических. В анализе серебра содержащих материалов, в производстве зеркал и зеркальных покрытий.
В недавнем прошлом применялся как компонент проявителя для фотографий, фотоэмульсий, а также для усилителей и других серебро содержащих растворов.
Ионы серебра применяются в косметических средствах, мазях для борьбы с угрями и прыщами.
Купить нитрат серебра можно в аптеке или специальных химических магазинах, цена нитрата серебра зависит от стоимости серебра на коммерческом рынке к примеру один килограмм нитрата серебра на 01.01.2020 составил 26100.00 грн или 70083.72 рубля, или 957,66 долларов.
Свойства нитрата серебра
Нитрат серебра белый порошок , который хорошо растворим в воде . Плотность 4,352 г/см³ . Молярная масса нитрата серебра 169,87 г/моль , Температура плавления 209,7 °C При нагревании до 300 °C плавиться , повышение нагревания приводит разложение нитрата серебра 1 на серебро , оксид азота и кислород .
Теплоёмкость 93,0 Дж/(моль·К). Энтальпия образования −124,5 кДж/моль. Энтропия 140,9 Дж/(моль·К) при 298 К.
Хорошо растворим в метаноле , пиридине , эфире , этаноле. Водный раствор нитрата серебра с альдегидом даёт реакцию серебряного зеркала.
Реакции нитрата серебра
Нитрат серебра нагревание свыше 350°C приводит к разложению его на свободный металл , оксид азота и кислород :
2AgNO3 → 2Ag + 2NO2 + O2 (нитрат серебра разложение)
Реакция с щелочами приводит к образованию оксида серебра ( I ) и нитрата щёлочи :
Реакция с солями галогенов приводит к образованию соответствующих ( хлоридов , бромидов , йодидов ) серебра и нитратов щелочей :
AgNO3 + NaCl → AgCl + NaNO3 (нитрат серебра + хлорид натрия)
AgNO3 + КCl → AgCl + КNO3 (нитрат серебра + хлорид калия)
Нитрат серебра и хлорид бария образуется нитрат бария и хлорид серебра
2AgNO3 + CuCl2 → 2AgCl + Cu(NO3)2 нитрат серебра + хлорид меди 2
Карбонат натрия приводит к образованию карбоната серебра и нитрата серебра :
Реакция с серной кислотой ( конц. ) приводит к образованию сульфата серебра и азотной кислоты :
Взаимодействие сульфата натрия даёт сульфат серебра и нитрат натрия :
Реакция с ортофосфатом натрия даёт ортофосфат серебра и нитрат натрия :
Реакция с соляной кислотой приводит к образованию хлорида серебра :
Реакция с хлором приводит к образованию оксида азота ( V ) кислорода и хлорида серебра реакция протекает в присутствии четырёх хлористого углерода ( катализатор ) при 0°C :
Реакция с сероводородом даёт сульфит серебра и азотную кислоту :
В зависимости от концентрации ( аммиачной воды , нашатырный спирт ) даёт разные реакции с концентрированным :
С разбавленной даёт оксид серебра ( I ) и аммиачную селитру :
Подобно себя ведёт тиосульфат натрия в концентрированном состоянии даёт комплексное соединение и нитрат натрия :
В разбавленном состоянии даёт тиосульфат серебра :
Реакция с концентрированными цианидами приводит к комплексному соединению дицианоаргентат( I ) натрия и нитрата натрия :
С разбавленным цианид серебра и нитрат натрия :
С концентрированным роданид (тиоцианат) калия даёт комплексное соединение дицианоаргентумат калия и нитрат калия :
С разбавленным нитрат калия и тиоцианат серебра :
Концентрированный нитрит калия даёт комплексное соединение и нитрат калия :
С разбавленным нитрат калия и нитрит серебра :
Реакция с концентрированным с сульфитом натрия даёт комплексное соединение битиосульфатоаргенат ( I ) натрия и нитрат натрия :
С разбавленным сульфит серебра и нитрат натрия :
Смесь нитрата серебра , аммиачной воды ( нашатырный спирт ) и формальдегида даёт реакцию серебряного зеркала :
Что мы узнали о нитрате серебра?
Для чего используется нитрат серебра?
Нитрат серебра используется в медицине в виде сплава нитрата серебра и нитрата калия, иногда отлитый в виде палочек — ляписного карандаша для прижигания и стерилизации ран, удаления мелких бородавок.
Как получить нитрат серебра?
Получают нитрат серебра высокой степени чистоты упариванием раствора нитрата серебра, нагреванием раствора и введением высаливателя — концентрированной азотной кислоты.
Чем смыть с кожи нитрат серебра?
Сначала — тщательно намазать черные пятна йодной настойкой и дать впитаться. Серебро перейдет в йодид. А потом — отмачивать руки в тиосульфате (он же — фиксаж нейтральный для фотографии). Если одного подхода окажется мало — процедуру повторить.
Что будет если нагреть нитрат серебра?
Нитрат серебра сначала будет плавиться, а нагревание свыше 350°C приводит к разложению его на свободный металл , оксид азота и кислород.
Как получить нитрат серебра в домашних условиях?
Для этого нужно поместить некоторое количество чистого серебра в лабораторную колбу и добавить азотной кислоты средней концентрации, поставить нагревать в вытяжной шкаф, после поставить на небольшой нагрев для удаления остатков азотной кислоты.
Статья на тему нитрат серебра
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
http://tvoi-uvelirr.ru/chto-takoe-azotnokisloe-serebro-svojstva-poluchenie-i-primenenie-azotnokislogo-serebra/
http://znaesh-kak.com/x/li/serebro/%D0%BD%D0%B8%D1%82%D1%80%D0%B0%D1%82-%D1%81%D0%B5%D1%80%D0%B5%D0%B1%D1%80%D0%B0