Угольная кислота. Получение угольной кислоты.
Получение угольной кислоты.
При растворении углекислого газа образуется угольная кислота, причем в растворе присутствует равновесие:
В природе не встречается, очень неустойчива и легко распадается.
Угольная кислота двухосновная и образует 2 типа солей: кислые (гидрокарбонаты) и средние (карбонаты).
Качественная реакция на присутствие H2CO3: воздействие сильных кислот на соли H2CO3, в результате чего улетучивается СО2:
При пропускании углекислого газа через известковую воду выпадает белый осадок:
Только карбонаты щелочных металлов и аммония, а также гидрокарбонаты, растворимы в воде.
Если через выпавший осадок пропустить углекислый газ, то из нерастворимого карбоната образуется растворимый гидрокарбонат:
Гидрокарбонаты при температуре разлагаются на СО3 2- , Н2О и газ:
Карбонаты (кроме щелочных металлов) при темпеатуре распадаются:
Основное значение из всех солей имеет сода, из которой получают различные кристаллогидраты: Na2CO3·10H2O (наиболее устойчив, называется кристаллической содой), Na2CO3·7H2O, Na2CO3·H2O.
Угольная кислота и её соли — получение и применение
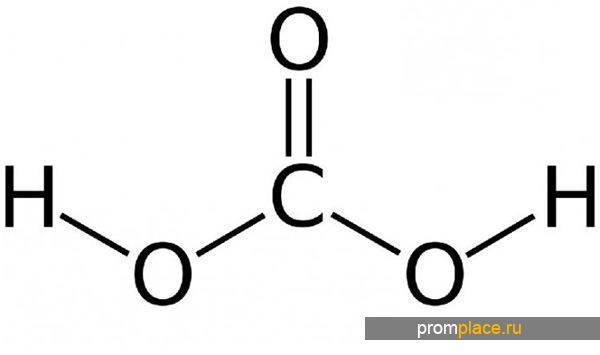
Угольная кислота появляется в результате разложения углекислого газа в водной среде. Этим веществом искусственно насыщают минеральные воды. Формула угольной кислоты Н2СО3. Поэтому при открытии бутылки с газированной водой, можно увидеть активные пузырьки. Основное получение угольной кислоты происходит в воде.
Уравнение
СО2 (г) + Н2О СО2 • Н2О (раствор) Н2СО3 Н+ + HCO3- 2H+ + CO32-.
Сама по себе угольная кислота представляет слабое непрочное соединение, которое невозможно выделить в свободном состоянии из воды.
Структурная формула
Но стоит отметить тот факт, что во время разложения гидрокарбоната аммония, формируются устойчивые соединения угольной кислоты. Такие крепкие химические связи образуются только в период, когда гидрокарбонат аммония вступает в газовую фазу реакции.
Вещество является интересным объектом для изучения. Его изучают австралийские ученые уже более 6 лет. В безводном состоянии эта кислота напоминает прозрачные кристаллы, которые имеют высокую стойкость к низким температурам, но при нагревании кристаллы угольной кислоты начинают разлагаться.
Данное вещество считается слабым по своей структуре, но в тоже время, угольная кислота является сильнее борной. Весь секрет заключается в количестве атомов водорода. В составе угольной кислоты имеется два атома водорода, поэтому она считается двухосновной, а борная кислота — одноосновная.
Особенности солей угольной кислоты
Эта кислота считается двухосновной, поэтому может создавать соли двух видов:
- • карбонаты угольной кислоты – средние соли,
- • гидрокарбонаты – кислые соли.
Карбонатами угольной кислоты могут выступать в соединения: Na2СO3,(NH4)2CO3. Они не способны растворятся в водной среде. Кислые соли этого вещества включают в себя: бикарбонаты NaHCO3 , Ca(HCO3)2. Для получения гидрокарбонатов производят реакцию, в которой основными веществами являются: угольная кислота и натрий.
Соли угольной кислоты помогли человечеству в строительстве, медицине и даже кулинарии. Потому что они встречаются в составе:
- • мела,
- • пищевой, кальцинированной и кристаллической соды,
- • известняковой породы,
- • мраморного камня,
- • поташа.
Гидрокарбонаты и карбонаты кислоты могут вступать в реакции с кислотами, во время этих реакции возможно выделение углекислого газа. Также эти вещества могут быть взаимозаменяемыми, они способны разлагаться под воздействием температуры.
Реакции угольной кислоты:
2NaHCO3 → Na2CO3 +H2O +CO2
Na2CO3 + H2O + CO2 →2NaHCO3
Химические свойства
Данная кислота по своей структуре способна входить в реакции со многими веществами.
Свойства угольной кислоты раскрываются в реакциях:
- • диссоциации,
- • с металлами,
- • с основаниями,
- • с основными оксидами.
Na2O + CO2 → Na2CO3
2NaOH + CO2 → Na2CO3 + H2O
NaOH + CO2 → NaHCO3
Угольная кислота представляет собой слабый электролит, так как слабая летучая кислота не может выступать в роли мощного электролита в отличие от, например, соляной кислоты. Этот факт можно увидеть в результате добавление лакмуса в раствор угольной кислоты. Изменение цвета будет незначительным. Поэтому можно утверждать, что угольная кислота может поддерживать 1 уровень диссоциации.
Применение
Данное вещество можно увидеть в составе газированных вод. Но соли угольной кислоты широко применяют:
- • для строительной сферы,
- • в процессе производства стекла,
- • в процессе производства моющих и чистящих средств,
- • производства бумаги,
- • для некоторых подкормок и удобрений для растений,
- • в медицине.
Отечественный и мировой рынок предлагает в продаже различные препараты и химические вещества, в состав которых входит угольная кислота:
- • мочевина или карбамид,
- • литиевая соль угольной кислоты,
- • углекислый кальций (мел),
- • кальцинированная сода (натрий углекислый) и т.д.
Карбамид используют в качестве удобрения для плодовых и декоративных растений. Его средняя цена составляет 30-40 рублей за 1 кг. Фасуют готовую продукцию в полиэтиленовые пакеты и мешки, весом 1, 5,25,50 кг.
Литиевую соль угольной кислоты используют в составе керамических изделий, ситаллов. Этот материал используется для производства камер сгорания для реактивных двигателей, его добавляют в глазури, эмали, грунтовки для различных металлов. Литиевую соль добавляют в грунтовки для обработки алюминия, чугуна и стали.
Это химическое вещество добавляют в процессе стекловарения. Стекла, в состав которых была добавлена литиевая соль, имеют повышенную проницаемость светлового потока. Иногда литиевую соль угольной кислоты используют в процессе производства пиротехники.
Производители
Средняя цена 1 кг такого вещества в России составляет 3900-4000 рублей. Главным заводом-изготовителем этого вещества считается московский завод ООО Компонент-Реактив. Также литиевую соль угольной кислоты производят в компаниях: ООО КурскХимПром, ООО ВитаХим, ООО Русхим, ЗАО Химпэк.
Мел производится для технических и кормовых целей. Средняя цена кормового мела составляет 1800 рублей за 1 тонну. Фасуется в основном по 50 кг, 32 кг. Производители: ООО Меловик, ООО МТ Ресурс, ООО Зооветснаб, ООО Агрохиминвест.
Кальцинированная сода применяется для стирки, удаления пятен и отбеливания. Средняя цена на этот продукт на розничном рынке варьируется в пределах 16-30 рублей за 1 кг. Производители: ООО Новэра, ЗАО ХимРеактив, ООО ХимПлюс, ООО СпецБурТехнологии, ООО СпецКомплект и др.
Угольная кислота. Свойства, получение, применение и цена угольной кислоты
Ее сложно увидеть. Угольная кислота известна науке в форме раствора. В воде размешен углекислый газ . Последнее вещество – это диоксид углерода с формулой CO2. Химическая запись воды, как известно, — H2O.
Вместе получается угольная кислота. Формула вещества записывается как H2CO3. Однако, выделить кислоту в виде порошка, как многие, не получается. Максимум – льдинки. Почему? Давайте разбираться.
Свойства угольной кислоты
Раствор угольной кислоты легко составляется и столь же просто распадается на изначальные компоненты. Особенно активно углекислый газ выделяется при нагреве. При пониженных температурах диссоциация угольной кислоты замедляется.
Вещество превращается в прозрачные кристаллы . Но, температуры, делающие кислоту стабильной, нетипичны для обычных условий. Поэтому, героиню статьи считают слабой, не способной сохранить собственную структуру и с трудом взаимодействующей с другими веществами.
Так, с растворами щелочей, металлами и их оксидами угольная кислота реагирует минимум в 2-е ступени. Сильная угольная кислота лишь в связке с еще более слабыми кислотами . Их героиня статьи вытесняет из растворов солей . «Капитулировать» приходится, к примеру, метакремниевой кислоте .
Химические свойства угольной кислоты являются робким выражением свойств двухосновных кислот . Героиня статьи относится к ним, поскольку содержит в структуре 2 атома водорода . Если точнее, в молекуле угольного соединения есть 2-е группы COOH.
Это, в частности, заставляет героиню статьи проявлять электролитические свойства. Проводить ток позволяет частичное распадение кислоты на ионы. У твердых электролитов они движутся внутри кристаллических решеток. Угольная кислота выделяет ионы только в растворах.
Как и прочие двухосновные вещества, угольная кислота в реакции вступает, дающие два ряда солей . Это бикарбонаты и простые карбонаты. Последние нерастворимы в воде и известны людям под видом мрамора , мела , известняка . Все три камня основаны на карбонате кальция с формулой CaCO3.
Угольная кислота и ее соли бесцветны. Помните, что мел, известняк и мрамор, зачастую, белые ? В растворе героиня кислоты тоже белеса, находится, в основном, в свободном виде.
Так именуют отдельное существование молекул воды и распределенного в ней углекислого газа. Но, встречаются в растворах и карбонатные ионы CO 32- и бикарбонатные частицы HCO3. Все вместе представляет долю кислоты в воде.
Система отличается кинетическим равновесием, то есть, неизменной концентрацией составляющих. Если допускается избыточное содержание диоксида углерода, вода становится агрессивной. Такой раствор расщепляет металлы , бетоны, различные конструкции и камни .
В обычных условиях доля угольной кислоты в воде мала, как и в воздухе, почве. В земле вещества, к примеру, от 0,0002 до 0,0005 частей. Ученые считают, что так было не всегда.
Ища причины гигантских размеров древних растений, исследователи пришли к выводу, что в прошлые эпохи и в почве, и в атмосфере, героини статьи было в несколько раз больше.
Растения способны усваивать вещество и пользуются его влиянием на растворимость в земле минеральных веществ, необходимых травам, кустам и деревьям для питания.
Проводились опыты выращивания растений в атмосферах с разным содержанием угольной кислоты. Рекорды показали экземпляры, находящие в воздухе с содержанием H2CO3 от 5-ти до 10-ти процентов.
Получение угольной кислоты
Важно не столько получение угольной кислоты, сколько ее соединений. Одно из них, к примеру, сода . Она является солью угольного соединения. Сода – кристаллическое вещество.
Но, как засечь образование чистой кислоты , раз она бесцветна? Отличить раствор от простой воды поможет лакмусовая бумажка . Она фиолетовая . В нейтральной среде цвет не меняется. Кислота окрасит лакмус в красный .
Раз героиня статьи получается добавлением в воду диоксида углерода, для начала нужно получить его. Поможет соляная кислота . Она сильная, с легкостью растворяет многие камни, в том числе и мрамор. Реакция ведет к выделению углекислого газа. С водой он смешается самостоятельно.
Получение углекислой кислоты , кстати, налажено в человеческом организме. Героиня статьи входит в буферные системы крови . Они контролируют постоянный pH организма.
Если извне поступают продукты с явной кислотностью или щелочной средой, буферные агенты удерживают нужный pH, пока «гости» переработаются и выведутся с потом, калом, мочой.
Лишние ионы блокируются и нейтрализуются. Это делают белковый, бикарбонатный, фосфатный и гемоглобиновый буферы. Каждый из них состоит из слабой кислоты , одной из ее солей и сильного основания.
В промышленности углекислоту получают 5-ю путями. Первый – извлечение вещества, как сопутствующего углеводородам при их откачке из скважин. При сжигании нефти , угля , кокса, кислоту тоже получают. Получается углекислота и при производстве аммиака . Героиня статьи становится побочным продуктом реакции.
Побочным продуктом углекислота является, так же, при брожении. Так что, соединением запасаются, к примеру, во время изготовления вина. Еще один источник углекислоты – выпуск гашеной извести.
Правда, от нее «отлетают» еще и азот, прочие примеси. Они же затрудняют получение реагента при сжигании углеводородов и на аммиачных заводах . Так что, эффективными способами промышленного получения героини статьи считаются лишь три из перечисленных.
Применение угольной кислоты
В чистом виде угольная кислота нужна не только организму человека растениям, но и на производствах. В процессе сварки, к примеру, героиня статьи служит защитной средой, подобно аргону.
Правда, углекислое соединение приходится раскислять. Для этого используют марганец и кремний . Иначе, нагрев при сварке провоцирует выделение из диоксида углерода активного кислорода.
Он провоцирует коррозию металлов. Именно из-за необходимости обработки угольной кислоты в качестве защитной среды чаще выбирают газ аргон. В пищевой промышленности углекислота – антиокислитель. Его добавляют в чаи , сыры, кофе . Примесь консервирует их, способствуя продолжительному хранению.
Пожарные бригады знают героиню статьи, как средство борьбы с огнем . Кислотой заполняют емкости, из которых соединение поступает к соплам. Для этого используют распределительные трубопроводы. Сопла находятся в защищаемых помещениях.
Выходя «на свободу» кислота превращается в пар, поглощая тепло окружающей среды, заполняя площади. В открытых помещениях системы углекислого пожаротушения не используют, лишь в трюмах, кладовых, насосных, отсеках электростанций. Принцип действия сводится к снижению уровня кислорода до 8%. Горение при таком показатели прекращается.
Раз угольная кислота нужна организму, ее используют медики, фармацевты. Вещество применяется в производстве аспирина, добавляется при некоторых видах анестезии, к примеру, в кислородные маски .
К угнетению дыхательного центра прибегают, в основном, при отравлениях летучими ядами и асфиксии новорожденных. Асфиксия – удушение. У младенцев вызывается, обычно, рвотными массами и первородным калом. Углекислота способствует сокращению легочных тканей, восстановлению их функции.
Применяют медики и углекислый снег. Это те самые кристаллы кислоты , которые получают при низких температурах. Так что, врачам удается увидеть героиню статьи в кристаллическом виде.
Удается это, так же, больным волчанкой, бородавками, лепрозными узлами. Соприкасаясь с кислотным льдом, пораженные участки кожи разрушаются. Грубо говоря, угольная кислота вырезает лишнее, подобно лазеру.
В жидком виде углекислота тоже может выступать хладагентом, используется в морозильном оборудовании. Еще одно поле применения – умягчение воды. Ее, правда, улучшает не чистая кислота, а одна из ее солей – атронная известь.
Цена угольной кислоты
Структурная формула угольной кислоты вмещается промышленниками в баллоны и цистерны. Прежде чем поместить героиню статьи в них, ее охлаждают. Это помогает сгустить вещество.
Предложений купить его единицы. Чаще, реализуют углекислые соединения. За димитилкарбонат, к примеру, просят около 1 500 рублей за килограмм. Вещество растворяет эфиры целлюлозы, а посему, применяется в органическом синтезе.
За натриевую соль, а попросту соду, приходится выкладывать 80-200 рублей за килограмм. Ценники разнятся в зависимости от производителей и добавок к продукту. Так, бывает, к примеру, кальцированная сода.
Если смотреть в глобальных масштабах, угольная кислота бесценна. Именно она является источником углерода для живых материй, причем, единственным. Углерод есть и в нефти, вулканических выбросах.
Элемент составляет ряд минералов, к примеру, графит и алмаз . Но, там элемент непотребен для животных . Они, как и растения, развиваются за счет угольной кислоты.
Есть даже мнение, что атланты – не чудо-люди или пришельцы из космоса, а всего лишь достойные «дети» атмосферы, насыщенной соединением воды и углекислого газа. Но, это теория в стиле «РенТВ». Сосредоточимся на научных фактах.
Роль угольной кислоты в жизни человека , животных, растений, ученые осознали и изучили около 3-ех столетий назад. С тех пор соединение и стали именовать бесценным. Наибольший вклад в изучение углекислоты внес Ян Ингенхоуз.
Голландский химик жил на рубеже 18-го и 19-го веков. Свои исследования Ян сосредоточил на гелиотропизме растений. Так именуют стремление зелени к солнцу , поворот стебля и бутонов в его сторону. Заодно, Ингенхоуз изучил газы, выделяемые растениями. Отсюда, собственно, и «понеслась» тема со значением в жизни трав и жизни вообще углекислоты.
http://promplace.ru/himicheskie-soedineniya-staty/ugolnaya-kislota-2286.htm
http://tvoi-uvelirr.ru/ugolnaya-kislota-svojstva-poluchenie-primenenie-i-cena-ugolnoj-kisloty/