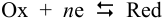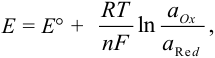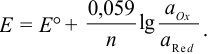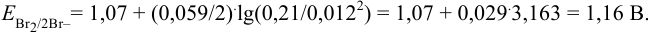Применение уравнения Нернста в решении задач.
При рассмотрении вопроса об окислительно-восстановительных реакциях часто возникает необходимость расчета электродвижущей силы (ЭДС) и потенциалов отдельных полуреакций. В справочниках обычно приведены таблицы т.н. стандартных потенциалов тех или иных процессов, рассчитанных при р=1 атм, Т=298К и активностях участников равных 1. Однако в реальных задачах условия могут значительно отличаться от указанных выше. Как быть в таком случае? Ответ дает уравнение Нернста. В оригинальном виде оно выглядит так:
Как можно заметить, в уравнении фигурируют несколько постоянных величин. Также температура в подавляющем большинстве случаев равна 298К. Кроме того, можно заменить натуральный логарифм на десятичный. Это можно сделать путем умножения на коэффициент перевода. Если собрать все постоянные в единый множитель, то приходим к несколько иному, но более знакомому по учебным пособиям виду уравнения Нернста:
Такой вариант уравнения сильно облегчает жизнь в ряде случаев, например рассмотрении рН-зависимых процессов. Используя данное уравнение можно провести вычисления в любых условиях, приведенных в задаче. Рассмотрим характерные примеры задания по данной теме.
Пример 1:
Рассчитать ЭДС гальванического элемента, составленного из медной и цинковой пластин, погруженных в растворы 0.1М CuSO4 и 0.01М ZnSO4 соответственно. Коэффициенты активности ионов Cu 2+ и Zn 2+ принять равными единице.
Решение:
Для начала запишем уравнения протекающих процессов:
Далее находим по таблице стандартные потенциалы процессов:
Если в условиях задачи ничего не сказано про коэффициенты активности ионов, то можно считать их равными единице, как и в нашем случае. Тогда активности участников процессов можно принять равными их аналитическим концентрациям.
Найдем реальные потенциалы с учетом нестандартных активностей ионов:
Далее необходимо сравнить полученные величины между собой, чтобы определить, кто из участников процесса – окислитель. Потенциал меди больше, чем у цинка, поэтому она будет окислителем. Тогда найдем ЭДС системы:
Ответ: 1.13 В
Пример 2:
Одним из лабораторных способов получения хлора является действие KMnO4 на концентрированную соляную кислоту. Можно ли провести процесс при рН=4?
Решение:
Для начала запишем уравнения протекающих процессов.
Далее находим по таблице стандартные потенциалы процессов:
Несложно заметить, что от рН в данном случае зависит только потенциал перманганата. Тогда воспользуемся уравнением Нернста и рассчитаем его реальный потенциал в условиях задачи:
Получается, что потенциал KMnO4 стал меньше, чем у хлора, а значит, реакция не пойдет.
Расчет электродного потенциала. Уравнение Нернста
В результате изучения потенциалов различных электродных процессов установлено, что их величины зависят от следующих факторов:
1) от природы веществ – участников электродного процесса;
2) от соотношения между концентрациями этих веществ;
3) от температуры системы.
Значения электродных потенциалов рассчитывают по уравнению Нернста:
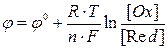
где 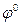
96500 Кл/моль; [Ox] и [Red] – молярные концентрации веществ, участвующих в процессе в окисленной (Ox) и восстановленной (Red) формах.
Для металлического электрода уравнение Нернста принимает вид:
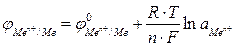
где n – число электронов, теряемых атомом металла при образовании катиона; 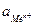
Для обычной при электрохимических измерениях стандартной температуры (Т = 25ºС или 298 К) и при подстановке значений постоянных величин уравнение (2) принимает вид:
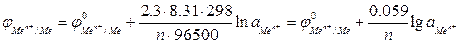
Вычисление потенциала в реальных условиях. Уравнение Нернста с примером решения
Вычисление потенциала в реальных условиях. Уравнение Нернста
В реальных условиях химического равновесия величина потенциала зависит от температуры и активностей окисленной и восстановленной форм. Количественно эта зависимость равновесного потенциала пары (Е) выражается уравнением Нернста:
для полуреакции
уравнение Нернста
где: R — универсальная газовая постоянная (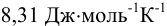
F — число Фарадея (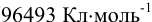
Т- абсолютная температура (К);
Е — равновесный потенциал.
После подстановки постоянных величин и переходя к десятичным логарифмам, получаем коэффициенты 0,059 при 25°С и 0,058 при 20°С.
Тогда уравнение Нернста при 25°С можно записать так:
Обычно вместо активностей в расчетах используют концентрации окисленной и восстановленной форм, пренебрегая различием в величинах коэффициентов активностей обеих форм, которые при близких значениях сокращаются в уравнении (5.3).
Пример 5.4 .
Вычислить 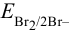
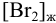
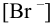
Решение:
Записываем уравнение полуреакции:
Записываем уравнение Нернста для данной полуреакции:
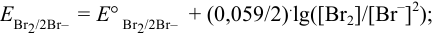
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Возможны вам будут полезны эти страницы:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
http://helpiks.org/1-31302.html
http://lfirmal.com/vyichislenie-potentsiala-v-realnyih-usloviyah-uravnenie-nernsta-s-primerom-resheniya/