Как практически осуществить процессы выражающиеся следующими уравнениями
Ахметов М. А. Подготовка к ЕГЭ по химии 2008
АХМЕТОВ М. А. УРОК 28. Ответы
Диссоциация электролитов в водных растворах. Слабые и сильные электролиты. Реакции ионного обмена.
1. Какие из перечисленных ниже жидкостей проводят электрический ток: а) спирт; б) водный раствор поваренной соли; в) дистиллированная вода; г) водный раствор сахара?
Ответ б)
2. Какие из перечисленных ниже жидкостей проводят электрический ток: а) 100-процентная серная кислота; б) водный раствор азотной кислоты; в) раствор азота в воде?
Ответ б)
3. Безводный жидкий фтороводород не проводит тока, а водный раствор его ток проводит. Чем это можно объяснить?
Ответ HFH + +F —
4. Почему соляную кислоту приходится хранить не в стальных, а в стеклянных или керамических сосудах, между тем как для безводной серной кислоты пригодны железные контейнеры?
Безводная серная кислота не реагирует с железом
5. Раствор хлороводорода в бензоле не проводит электрического тока и не действует на цинк. Чем это можно объяснить?
Хлороводород не диссоциирует в соляной кислоте
6. Какие ионы содержатся в водных растворах: а) нитрата калия; б) хлорида кальция; в) сульфата натрия?
а) K + + NO3 — б) Ca 2+ + Cl — в) Na + + SO4 2-
7. Как называются и чем отличаются между собой частицы, изображенные символами: а) Сl - , С1, С12; б) S03, S03 2- ; в) Na, Na + ; г) S, S 2- ?
Отличаются числом электронов. Каждый отрицательный заряд означает наличие дополнительного электрона.
а) К примеру, у хлора их 17, а у Cl — — 18, у молекулы хлора – 34 электрона
в) У Na – 11 электронов, а Na + — 10
г) у S – 16 электронов, а у S 2- — 18 электронов.
8. Можно ли приготовить водный раствор, который в качестве растворенного вещества содержал бы только: a) S03; б) S04 2- ; в) Na; г) Na + ; д) С1 — ; е) С12; ж) Са 2+ ? Ответ поясните.
б) S04 2- — нет, нужны еще и катионы
в) нет – нужны еще и анионы
г) да – хлор реагирует с водой, но эта реакция обратима Сl2+H2OHCl+HClO
д) нет, нужны еще и катионы
9. Можно ли приготовить раствор, содержащий в растворенном виде только: а) серу; б) ион S 2- ; в) фосфор; г) ион Р 3- ; д) азот; е) ион Na + ? Дайте обоснованный ответ.
10. Какие ионы содержатся в водных растворах: а) бромида калия; б) едкого кали; в) азотной кислоты; г) фторида натрия?
г) NaF=Na + +F —
11. Какие ионы содержатся в водных растворах: а) нитрата алюминия; б) сульфата алюминия; в) иодоводорода?
в) HI=H + +I —
12. Напишите и прочитайте уравнения электролитической диссоциации в водных растворах следующих веществ: а) сульфата калия; б) хлорида кальция; в) бромоводорода.
в) HBr=H + +Br —
13. Напишите и прочитайте уравнения электролитической диссоциации в водных растворах следующих веществ: а) нитрата цинка; б) хлорида бария; в) бромида калия.
14. Изобразите при помощи уравнений электролитическую диссоциацию веществ, формулы которых Ва (ОН)2, К3Р04, КС103, КС1, NaHS04. Прочитайте написанные уравнения.
15. Составьте уравнения электролитической диссоциации: а) сульфата меди; б) хлорида кальция; в) гидроксида натрия. Прочитайте уравнения.
16. Составьте уравнения электролитической диссоциации:
а) сульфата серебра; б) гидроксида кальция; в) соляной кислоты. Прочитайте уравнения.
17. Напишите уравнения электролитической диссоциации веществ, формулы которых: a) FeCl3; б) FeCl2; в) растворимого минерала карналлита KCl-MgCl2. Прочитайте уравнения.
18. Изобразите уравнениями последовательные ступени электролитической диссоциации: а) мышьяковой кислоты H3As04; б) сероводорода в водном растворе.
HAsO4 2- =H + +AsO4 3-
19. Изобразите уравнениями последовательные ступени диссоциации угольной кислоты.
20. Изобразите уравнениями последовательные ступени диссоциации сернистой кислоты H2S03.
21. Изобразите уравнениями последовательные стадии диссоциации селеновой кислоты H2Se04.
22. Как практически осуществить процессы, выражающиеся следующими уравнениями:
в) Си 2+ + 20Н — Си (ОН)2
в) СuSO4+2NaOH=Cu(OH)2+Na2SO4
23. Как практически осуществить реакции, схематически изображаемые уравнениями:
2) H+OH — H20 провести реакцию кислоты со щелочью
3) Mg (OH)2 Mg 2 + + 20Н- — реакция практически не осуществима
24. Как практически осуществить реакцию, представленную уравнением:
опустить натрий в стакан с хлором
25. Опишите подробно опыты, иллюстрирующие следующие превращения:
1) Mg + Pb 2+ Mg 2 + + Pb магний опустили в раствор нитрата свинца
2) Си + 2Ag+ Cu 2 + + 2Ag медь опустили в нитрата серебра
3) Hg + 2Ag+Hg 2 + + 2Ag ртуть опустили в раствор нитрата серебра
26. На сколько ионов распадается при полной диссоциации молекула каждого из электролитов, формулы которых: a) H2S04; б) Sr (OH)2; в) Н3Р04?
27. Как практически осуществить реакцию, сначала представленную уравнением 1, а затем уравнением 2:
1) Са(ОН)2Са 2+ + 20Н — растворить вещество в воде
2) Са 2+ + 20Н — Са(ОН)2 к раствору хлорида кальция добавить гидроксид натрия
28. Напишите формулы веществ, которые при растворении в воде диссоциируют на ионы: а) Ва 2+ и ОН 2- ; б) Са 2+ и N03 — .
Ba(OH)2 Ca(NO3)2
29. Напишите формулы веществ, диссоциирующих в воде на ионы: а) А1 3+ и S04 2 -; б) Mg 2+ и Мn04 2- .
30. Напишите формулы веществ, диссоциирующих в воде на ионы: а) К + и Сг04 2- ; б) Fe 2+ и N03 — ; в) Fe 3 + и N03 — .
31. В воде одного источника были обнаружены следующие ионы: Na+, K + , Fe 2 +, Ca 2 +, Mg 2 +2Cl — , Br — , S04 2- Растворением каких солей в дистиллированной воде можно получить раствор, содержащий те же ионы? Имеет ли задача только одно решение? Ответ поясните.
KCl, MgCl2 Na2SO4, FeBr2,CaCl2 или KBr+MgSO4+NaCl+FeCl2+CaBr2
32. Какие из перечисленных ниже веществ при электролитической диссоциации образуют ионы хлора: а) хлорид калия;
б) бертолетова соль КС103; в) перхлорат калия КС104; г) нашатырь NH4C1? При помощи какого раствора можно доказать присутствие ионов хлора в растворах указанных вами солей?
хлорид калия и хлорид аммония. Можно доказать добавлением раствора нитрата серебра
33. Раствор хлорида калия бесцветен, а раствор марганцовокислого калия КМп04 окрашен в фиолетово-красный цвет. Каким ионом вызвана окраска раствора соли КМп04?
MnO4 —
34. К какому классу относится вещество, если его водный раствор хорошо проводит электрический ток и не окрашивает фиолетового лакмуса ни в красный, ни в синий цвет?
это соль
35. Хлорид меди СuС12 ядовит. С каким ионом связана токсичность этой соли?
36. Напишите формулы: а) четырех бесцветных катионов; б) четырех бесцветных анионов; .в) известных вам окрашенных катионов.
в) Сu 2+ Ni 2+
37. Почему раствор иодида калия, хотя и содержит иод, не окрашивает крахмал в синий цвет?
I2 и KI – разные вещества
38. Каковы различия в свойствах между атомом водорода и ионом водорода?
ион водорода обладает окислительными свойствами, а молекула водорода чаще всего восстановитель. катион водорода обычно существует в водных растворах, а водород бесцветный газ
39. Придают ли окраску раствору: а) ионы кальция; б) ионы меди; в) анионы серной кислоты; г) анионы азотной кислоты; д) ионы серебра?
окрашены только к ионы меди
40. Придают ли окраску раствору: а) ионы иода; б) ионы брома; в) ионы калия; г) ионы С03 2
41. Растворы некоторых солей соляной кислоты имеют окраску. Катионы или анионы придают цвет этим солям? Приведите примеры.
CuCl2 – синезеленый цвет
42. Растворы некоторых солей натрия имеют окраску. Чем она обусловлена — катионами или анионами? Из чего вы это заключаете?
анионами, так как катион не окрашен
43. Растворы хлорида бария и мышьяковой кислоты H3As04 ядовиты. Какими ионами обусловлена ядовитость каждого из этих соединений?
44. Выпишите названия известных вам минеральных удобрений и формулы анионов и катионов, заключающих в себе питательный элемент.
нет, например сахар
46. Зная число молей в 1 л воды и что число ионов водорода в этом объеме воды равно 6,02-10 18 , найдите, сколько молекул воды приходится на одну молекулу воды, распавшейся на ионы.
10 миллионов
47. В лаборатории имеется 98-процентная серная кислота. Как правильно называть такую кислоту — концентрированная или сильная кислота?
концентрированная она не диссоциирована на ионы
48. От каких факторов зависит степень диссоциации электролита в водном растворе? Ответ поясните примерами.
от природы электролита и концентрации
чем концентрация ниже, тем степень диссоциации выше
49. Как влияет повышение концентрации электролита в растворе на степень диссоциации?
чем концентрация ниже, тем степень диссоциации выше
50. Как влияет температура на степень диссоциации?
с температурой увеличивается
51. Приведите примеры сильных, средних и слабых электролитов.
52. Имеется 1 л раствора, содержащего 1 моль нитрата калия. Степень диссоциации соли в этом растворе равна 70%. Сколько граммов электролита диссоциировано на ионы?
70,7
53. Считая, что степень диссоциации соляной кислоты в растворе, содержащем 0,1 моль в 1 л, равна 90%, найдите, сколько граммов водорода находится в виде ионов в 2 л кислоты.
6,57 г
54. В растворе уксусной кислоты содержится е виде ионов 0,001 г водорода и 0,1 моль недиссоциированкой кислоты. Какова степень диссоциации уксусной кислоты в этом растворе?
1%
55. Производились исследования с раствором, в 1 л которого содержалось по 1 моль бромида натрия и сульфата калия. Как приготовить раствор в точности такого же количественного состава, если вместо бремида натрия взять бромид калия?
56. В литре раствора содержится 1 моль нитрата калия и 1 моль хлорида натрия. Из каких двух других солей и как можно приготовить раствор точно такого количественного состава?
57. В 1 л раствора содержится 2 моль хлорида натрия и 1 моль серной кислоты. Из каких двух веществ и как можно приготовить раствор точно такого же состава?
58. Средняя концентрация солей в морской воде выражается следующими числами (по массе): хлорид натрия — 2,91%, сульфат кальция — 0,13%, хлорид магния — 0,41%, сульфат калия — 0,09%, сульфат магния — 0,18%. Каких катионов больше всего в морской воде?
59. При применении цинка в качестве микроудобрения его вносят из расчета 15—20 кг сульфата цинка ZnS04-7H20 на гектар. Сколько это составляет в пересчете на ионы Zn 2+ ?
60. Для предпосевной обработки семян применяется раствор, содержащий 0,02% медного купороса. Вычислите, сколько (в процентах) это составляет в пересчете на ион Cu 2+ .
61. В каких количественных отношениях нужно взять массу хлорида калия и массу сульфата калия, чтобы получить растворы с одинаковым содержанием ионов К + ?
62. В каких количественных отношениях нужно взять массу сульфата магния и массу сульфата алюминия, чтобы получить растворы с одинаковым содержанием ионов SO 2- ?
63. Анализом было установлено, что раствор содержит 0,69 г/л Na + и 1,86 г/л N03 — . Одинаковое или разное количество этих двух видов ионов содержится в указанном растворе?
64. Анализом было найдено, что в 1 л раствора сульфата натрия содержится 0,1 моль ионов S04 2- . Сколько граммов ионов Na + содержится в литре этого раствора?
65. Анализом было найдено, что в 1 л раствора, полученного растворением смеси бромида калия и бромида натрия, содержится 3 моль ионов Вг
и 1 моль ионов К + . Сколько граммов ионов Na + было в этом растворе?
66. Какое вещество, состоящее из двух элементов, подходит одновременно под определения кислоты и основания?
67 Какие из веществ, формулы которых КОН, НС103, НСlO4, KHS04, H20, образуют при диссоциации ионы водорода и гидроксида? Напишите соответствующие уравнения реакций.
68. Что представляют собой ионы водорода с точки зрения теории строения атомов? Как их открывают в водном растворе?
69. Изобразите электронную схему строения иона гидроксида (так, как ранее изображались электронные схемы строения молекулы воды и пр.). Как можно обнаружить ионы гидроксида в водном растворе?
70. Какие из соединений: аммиак, сероводород, фосфин, селеноводород — при растворении в воде способны присоединять протоны и какие их отщепляют?
амимак и фосфин присоединяют, сероводород и селеноводород отщепляют
71. Как меняется сила бескислородных кислот в зависимости от радиуса аниона?
с возрастанием радиуса увеличивается сила
72. Как зависит сила бескислородной кислоты от заряда аниона?
73. От каких факторов зависит сила кислородсодержащих кислот?
от числа атомов кислорода и электроотрицательности кислотообразующего элемента
74. Из трех кислот, формулы которых НС103; HN03; HBr03, укажите самую сильную и самую слабую. Ответ мотивируйте.
HN03– самая сильная
HBr03 – самая слабая
75. Какая из кислот, формулы которых H2C03; H2Si03 и •H2S03, самая сильная и почему? Ответ поясните.
H2Si03 – самая слабая
76. От каких факторов зависит степень диссоциации оснований? Ответ поясните примерами.
От степени полярности связи металл-кислород, а также от заряда катиона металла
77. Какое из оснований: Са(ОН)2; Mg(OH)2; NaOH; Ba(OH)2— самое сильное и какое самое слабое? Ответ мотивируйте.
NaOH – самое сильное
Mg(OH)2 – самое слабое
78. Из четырех оснований: Ва(ОН)2; Sr(OH)2; Ca(OH)3; Mg(OH)2 — укажите самое сильное основание. Объясните почему.
79. Какое из оснований самое сильное и какое самое слабое: RbOH; NaOH; КОН или LiOH? Ответ поясните.
80. Какое из пяти оснований самое сильное: А1(ОН)3; Са(ОН)2; Mg(OH)2; NaOH; КОН? Дайте мотивированный ответ.
81. В литре воды растворены 1 моль хлорида калия и 1 моль-иодида натрия. Из каких двух других солей и как можно приготовить раствор точно такого же состава?
1 моль иодида калия 1 моль хлорида натрия.
82. В литре воды растворены 2 моль бромида калия и 1 моль сульфида натрия. Из каких двух других солей и как можно приготовить раствор точно такого же состава?
83. В литре воды растворены 1 моль сульфата магния и 2 моль хлорида натрия. Из каких двух других солей может быть приготовлен раствор точно такого же состава и какое количество каждой из них нужно для этого взять?
84. Укажите известные вам способы превращения атомов меди в ионы меди и ионов меди в атомы меди. Приведите соответствующие уравнения реакций.
CuO+H2=Cu+H2O
85. Какие ионы могут присутствовать в растворе, если при введении ионов S04 2- выпадает осадок, а при введении ионов Сl образование осадка не наблюдается?
86. Напишите ионные уравнения реакций между растворенными в воде: а) гашеной известью и азотной кислотой; б) азотной кислотой и гидроксидом калия; в) серной кислотой и гидроксидом лития.
87. Напишите ионные уравнения реакций между растворенными в воде: a) H2Se04 (сильная кислота) и КОН; б) НС104 (сильная кислота) и NaOH.
88. Напишите ионные уравнения реакций между растворенными в воде: а) сульфатом меди и гидроксидом лития; б) хлоридом меди (II) и гидроксидом калия.
89. Напишите ионные уравнения реакций между растворенными в воде: а) сульфатом железа (II) и гидроксидом лития, б) сульфатом железа (III) и гидроксидом натрия.
90. Напишите ионные уравнения реакций между растворенными в воде: а) нитратом магния и едким натром; б) сернокислым магнием и гидроксидом лития; в) хлоридом магния и гидроксидом кальция.
91. Напишите ионные уравнения реакций между растворенными в воде: а) сульфатом меди и хлоридом бария; б) сульфатом алюминия и хлоридом бария; в) сульфатом натрия и нитратом бария.
93. Напишите ионные уравнения реакций между растворами следующих солей: а) нитратом серебра и бромидом натрия; б) нитратом серебра и бромидом кальция; в) нитратом серебра и бромидом меди (II).
93. Напишите ионные уравнения реакций (в полной и сокращенной форме) между: а) нитратом серебра и иодидом магния; б) сульфатом серебра и иодидом лития; в) нитратом серебра и иодидом бария в растворе.
94. Напишите в ионной форме уравнения реакций, представленных следующими схемами:
95. Напишите в полной и сокращенной ионной форме уравнения реакций, представленных следующими схемами:
96. Напишите в полной и сокращенной ионной форме уравнения реакций, представленных следующими схемами:
97. Напишите в ионной форме уравнения реакций, представленных следующими схемами:
б) Fe(OH)3 + H2S04 .. → Fe2(S04)3 + Н20
98. Напишите ионные уравнения реакций, происходящих при попарном сливании растворов солей, формулы которых Ag2S04, ВаС12, Pb(N03)2, Na3P04.
99. В банку был налит раствор гидроксида бария. Из бюретки по каплям прибавляли раствор серной кислоты. По мере прибавления серной кислоты лампа светила все более тускло. Через некоторое время лампа совсем погасла. Почему гаснет лампа? Что будет наблюдаться при дальнейшем прибавлении кислоты? Будут ли наблюдаться те же явления, если серную кислоту заменить соляной?
Лампа гаснет, потому что уменьшается количество ионов. При добавлении избытка серной кислоты лампа будет гореть все более интенсивно
Ю. В. Ходаков сборник задач и упражнений по химии для средней школы учебное пособие
| Вид материала | Сборник задач |
Содержание10-12. Почему в домашних и производственных условиях для Сохранения продуктов питания пользуются холодильниками? Ответ поясните. |
Подобный материал:
- В. С. Виноградов Сборник упражнений по грамматике испанского языка, 2144.78kb.
- В. И. Гараджа религиоведение учебное пособие, 5104.37kb.
- Общий курс физики т-1 Механика: учебное пособие М.: Физматлит, 2002. Сивухин Д. В.,, 679.32kb.
- Учебное пособие для учащихся 5 класса, 1780.81kb.
- Учебное пособие состоит из 12 уроков и раздела обобщающих упражнений. Вприложении, 2084.52kb.
- Учебное пособие по курсу » Электроника и микроэлектроника» для студентов, обучающихся, 437.7kb.
- Ненаглядное пособие по тригонометрии, 141.71kb.
- Гузей Л. С., Сорокин В. В., Суровцева, 181.64kb.
- Пособие для учителей. М.: Просвещение, 1972. 240с., 63.53kb.
- Учебное пособие по дисциплине «Сестринское дело в хирургии» составлено в соответствии, 2118.11kb.
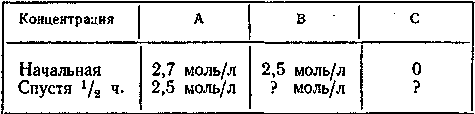
10-4. Химическая реакция протекает по уравнению А + В = С. Данные опыта следующие:
Рассчитать: а) концентрации, помеченные в таблице вопросительным знаком, б) среднюю скорость реакции за данный промежуток времени.
10-5. Изменится ли скорость реакции между водородом и кислородом, если в их смесь, сохранив условия (какие?), ввести азот? Ответ поясните.
10-6. Химическая реакция происходит в растворе согласно уравнению А + В = С. Как изменится ее скорость, если: а) концентрацию А увеличить в 2 раза, оставив концентрацию В прежней; б) концентрацию В увеличить в 2 раза, оставив концентрацию А прежней; в) концентрацию обоих веществ увеличить в 2 раза; г) концентрацию одного из веществ увеличить в два раза, а другого— уменьшить в два раза; д) увеличить в два раза давление на реагирующую смесь, предполагая, что в этом последнем случае реагируют между собой в смеси газообразные вещества?
10-7. При повышении температуры на 10°С скорость химической реакции возрастает в 2 раза. При 20°С она равна 0,04 моль/л ■ ч. Какова будет скорость этой реакции при: а) 40°С; б) 10°С; в) 0°С?
10-8. При 30°С скорость химической реакции равна 0,01 моль/(л-мин). Какова она будет при: а) 0°С; б) 60°С, если при повышении температуры на 10°С она возрастает в 3 раза?
10-9. При 40°С скорость химической реакции 0,2 моль/л-ч. Постройте график, выражающий зависимость скорости реакции От температуры, если при возрастании температуры на 10°С скорость реакции увеличивается в 2 раза.
10-10. При 50°С скорость химической реакции равна 0,05 моль/ (л • мин). Постройте график, выражающий зависимость скорости реакции от температуры, если при возрастании температуры на 10°С скорость реакции увеличивается в 3 раза.
10-11. В каком случае реакция протекает с большей скоростью: а) при горении водорода на воздухе или взрыве смеси водорода с воздухом; б) при образовании гидрокарбоната натрия действием оксида углерода (IV) на раствор гидроксида натрия при обычной температуре или при повышенной температуре?
10-12. Почему в домашних и производственных условиях для Сохранения продуктов питания пользуются холодильниками? Ответ поясните.
10-13. Может ли степень измельчения взятых веществ влиять на скорость их взаимодействия? Свой ответ обоснуйте.
10-14. Некоторые реакции, раз начавшись, идут все с возрастающей скоростью, что иногда приводит к взрыву (например, разложение взрывчатых веществ). Укажите, какие факторы могут явиться причиной такого явления.
10-15. Какова относительная скорость прямой реакции по сравнению с обратной в состоянии равновесия для процессов:
10-16. Является ли реакция распада пероксида водорода обратимой?
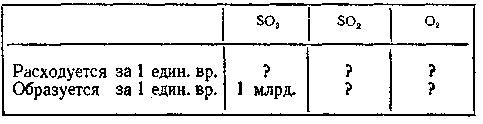
10-17. Реакция 2S02 + 02 «*■ 2S03 достигла состояния равновесия. За единицу времени в реагирующей смеси вновь возникает, предположим, 1 млрд. молекул оксида серы (VI). Сколько за этот же промежуток времени расходуется молекул оксида серы (IV) и молекул кислорода? Сколько распадется молекул оксида серы (VI)? Сколько образуется молекул оксида серы (IV) и молекул кислорода? Заполните таблицу
и убедитесь, что состав смеси не изменится.
10-18. Почему железная окалина при нагревании в непрерывном токе водорода восстанавливается в металлическое железо полностью, хотя восстановление водородом железной окалины относится к обратимым реакциям?
10-19. При сжигании угля образуется углекислый газ и при этом наблюдается обратимая реакция:
При каких условиях образуется минимальное количество угарного газа?
10-120. Изменится ли состояние равновесия Н2 + С122НС1
если смесь газов сжать?
10-21. Смесь водорода с кислородом можно хранить при обычной температуре неопределенно долго. Можно ли сказать, что здесь достигнуто состояние равновесия? Чтобы правильно ответить на этот вопрос, учтите представление о скорости реакции.
10-22. Изменится’ли давление в замкнутой системе, если при нормальных условиях смешать равные объемы хлора и водорода и облучить ультрафиолетовыми лучами? Ответ поясните.
10-23. В какую сторону смещаются равновесия при повышении температуры:
10-24. Можно ли рассматривать как равновесную реакцию восстановление оксида меди (II) водородом? Ответ поясните.
10-25. Почему железные опилки при нагревании в непрерывном потоке водяного пара до конца окисляются в железную окалину,
хотя окисление железа водяным паром относится к обратимым реакциям?
10-28. Если через смесь азота с водородом пропускать искровой заряд, то образуется лишь незначительное количество аммиака. Но если при этом газовая смесь находится над серкой кислотой, то реакция идет до конца. Укажите, что является причиной такого изменения в ходе процесса.
10-27. Что получится при действии раствора гидроксида натрия на смесь равных объемов оксида азота (II) и оксида азота (III), реагирующих согласно уравнению:
10-28. В какую сторону сместятся равновесия
при повышении давления?
10-29. Как изменятся равновесия:
2) 2N0 + 024±2N02 + Q при понижении температуры?
10-30. Как повлияет: а) повышение давления; б) повышение температуры; в) увеличение концентрации кислорода на равновесие системы:
10-31. Сместится ли равновесие системы и в какую сторону при понижении давления:
10-32. В какую сторону сместится, равновесие системы: 302203 + Q
а) при повышении температуры; б) при повышении давления?
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Диссоциация оснований, кислот и солeй
11-1. Какие из перечисленных ниже жидкостей проводят электрический ток: а) спирт; б) водный раствор поваренной соли; в) дистиллированная вода; г) водный раствор сахара?
11-2. Какие из перечисленных ниже жидкостей проводят электрический ток: а) 100-процентная серная кислота; б) водный раствор азотной кислоты; в) раствор азота в воде?
11-3. Безводный жидкий фтороводород не проводит тока, а водный раствор его ток проводит. Чем это можно объяснить?
11-4. Почему соляную кислоту приходится хранить не в стальных, а в стеклянных или керамических сосудах, между тем как для безводной серной кислоты пригодны железные контейнеры?
11-5. Раствор хлороводорода в бензоле не проводит электрического тока и не действует на цинк. Чем это можно объяснить?
11-6. Какие ионы содержатся в водных растворах: а) нитрата калия; б) хлорида кальция; в) сульфата натрия?
11-7. Как называются и чем отличаются между собой частицы, изображенные символами: а) СГ, С1, С12; б) S03, S03 2_ ; в) Na, Na + ; г) S, S 2 -?
11-8. Можно ли приготовить водный раствор, который в качестве растворенного вещества содержал бы только: a) S03; б) S0§ — ; в) Na; г) Na + ; д) С1
; е) С12; ж) Са 2+ ? Ответ поясните.
11-9. Можно ли приготовить раствор, содержащий в растворенном виде только: а) серу; б) ион S 2- ; в) фосфор; г) ион Р 3
? Дайте обоснованный ответ. .
11-10. Какие ионы содержатся в водных растворах: а) бромида калия; б) едкого кали; в) азотной кислоты; г) фторида натрия?
11,-11. Какие ионы содержатся в водных растворах: а) нитрата алюминия; б) сульфата алюминия; в) иодоводорода?
11-12. Напишите и прочитайте уравнения электролитической диссоциации в водных растворах следующих веществ: а) сульфата калия; б) хлорида кальция; в) бромоводорода.
11-13. Напишите и прочитайте уравнения электролитической диссоциации в водных растворах следующих веществ: а) нитрата цинка; б) хлорида бария; в) бромида калия.
— 11-14. Изобразите при помощи уравнений электролитическую диссоциацию веществ, формулы которых Ва (ОН)2, К3Р04, КС103, КС1, NaHS04. Прочитайте написанные уравнения.
11-15. Составьте уравнения электролитической диссоциации: а) сульфата меди; б) хлорида кальция; в) гидроксида натрия. Прочитайте уравнения.
11-16. Составьте уравнения электролитической диссоциации:
а) сульфата серебра; б) гидроксида кальция; в) соляной кислоты. Прочитайте уравнения.
11-17. Напишите уравнения электролитической диссоциации веществ, формулы которых: a) FeCl3; б) FeCl2; в) растворимого минерала карналлита KCl-MgCl2. Прочитайте уравнения.
11-18. Изобразите уравнениями последовательные ступени электролитической диссоциации: а) мышьяковой кислоты H3As04;
б) сероводорода в водном растворе.
11-19. Изобразите уравнениями последовательные ступени диссоциации угольной кислоты.
11-20. Изобразите уравнениями последовательные ступени диссоциации сернистой кислоты H2S03.
11-21. Изобразите уравнениями последовательные стадии диссоциации селеновой кислоты H2Se04.
11-22. Как’практически осуществить процессы, выражающиеся следующими уравнениями:
в) Си 2+ + 20Н- -> Си (ОН)2
11-23. Как практически осуществить реакции, схематически изображаемые уравнениями:
3) Mg (OH)2 -*Mg 2 + + 20Н-
11-24. Как практически осуществить реакцию, представленную уравнением:
11-25. Опишите подробно опыты, иллюстрирующие следующие превращения:
1) Mg + Pb 2+ -*Mg 2 + + Pb
2) Си + 2Ag+ -*Cu 2 + + 2Ag
3) Hg + 2Ag+->Hg 2 + + 2Ag
-_. 11-26. На сколько ионов распадается при полной диссоциации молекула каждого из электролитов, формулы которых: a) H2S04; б) Sr (OH)2; в) Н3Р04?
11-27. Как практически осуществить реакцию, сначала представленную уравнением 1, а затем уравнением 2:
11-28. Напишите формулы веществ, которые при растворении в воде диссоциируют на ионы: а) Ва 2+ и ОН»; б) Са 2+ и N03
11-29. Напишите формулы веществ, диссоциирующих в воде на ионы: а) А1 3+ и S04 2
11-30. Напишите формулы веществ, диссоциирующих в воде на ионы: а) К + и Сг04 2
11-31. В воде одного источника были обнаружены следующие ионы: Na+, K + , Fe 2 +, Ca 2 +, Mg 2 +, Cl
. Растворением каких солей в дистиллированной воде можно получить раствор, содержащий те же ионы? Имеет ли задача только одно решение? Ответ поясните.
11-32. Какие из перечисленных ниже веществ при электролитической диссоциации образуют ионы хлора: а) хлорид калия;
б) бертолетова соль КС103; в) перхлорат калия КС104; г) нашатырь NH4C1? При помощи какого раствора можно доказать присутствие ионов хлора в растворах указанных вами солей?
11-33. Раствор хлорцда калия бесцветен, а раствор марганцовокислого калия КМп04 окрашен в фиолетово-красный цвет. Каким ионом вызвана окраска раствора соли КМп04?
11-34. К какому классу относится вещество, если его водный раствор хорошо проводит электрический ток и не окрашивает фиолетового лакмуса ни в красный, ни в синий цвет?
11-35. Хлорид меди СиС12 ядовит. С каким ионом связана токсичность этой соли?
11-36. Напишите формулы: а) четырех бесцветных катионов; б) четырех бесцветных анионов; .в) известных вам окрашенных катионов.
11-37. Почему раствор иодида калия, хотя и содержит иод, не окрашивает крахмал в синий цвет?
11-38. Каковы различия в свойствах между атомом водорода и ионом водорода?
11-39. Придают ли окраску раствору: а) ионы кальция; б) ионы меди; в) анионы серной кислоты; г) анионы азотной кислоты; д) ионы серебра?
11-40. Придают ли окраску раствору: а) ионы иода; б) ионы брома; в) ионы калия; г) ионы С03 2
11-41. Растворы некоторых солей соляной кислоты имеют окраску. Катионы или анионы придают цвет этим солям? Приведите примеры.
11-42. Растворы некоторых солей натрия имеют окраску. Чем она обусловлена — катионами или анионами? Из чего вы это заключаете?
11-43. Растворы хлорида бария и мышьяковой кислоты H3As04 ядовиты. Какими ионами обусловлена ядовитость каждого из этих соединений?
11-44. Выпишите названия известных вам минеральных удобрений и формулы анионов и катионов, заключающих в себе питательный элемент.
11-45. Во всех ли случаях растворение вещества сопровождается возникновением ионов? Ответ мотивируйте, приведя примеры.
11-46. Зная число молей в 1 л воды и что число ионов водорода в этом объеме воды равно 6,02-10 18 , найдите, сколько молекул воды приходится на одну молекулу воды, распавшейся на ионы.
11-47. В лаборатории имеется 98-процентная серная кислота. Как правильно называть такую кислоту — концентрированная или сильная кислота?
11-48. От каких факторов зависит степень диссоциации электролита в водном растворе? Ответ поясните примерами.
11-49. Как влияет повышение концентрации электролита в растворе на степень диссоциации?
11-50. Как влияет температура на степень диссоциации?
11-51. Приведите примеры сильных, средних и слабых электролитов.
11-52. Имеется 1 л раствора, содержащего 1 моль нитрата калия. Степень диссоциации соли в этом растворе равна 70%. Сколько граммов электролита диссоциировано на иокы?
11-53. Считая, что степень диссоциации соляной кислоты в растворе, содержащем 0,1 моль в 1 л, равна 90%, найдите, сколько граммов водорода находится в виде ионов в 2 л кислоты.
11-54. В растворе уксусной кислоты содержится е виде ионов 0,001 г водорода и 0,1 моль недиссоциированкой кислоты. Какова степень диссоциации уксусной кислоты в этом растворе?
11-55. Производились исследования с раствором, в 1 л которого содержалось по 1 моль бромида натрия и сульфата калия. Как приготовить раствор в точности такого же количественного состава, если вместо бремида натрия взять бромид калия?
11-56. В литре раствора содержится 1 моль нитрата калия и 1 моль хлорида натрия. Из каких двух других солей и как можно приготовить раствор точно такого количественного состава?
11-57. В 1 л раствора содержится 2 моль хлорида натрия и 1 моль серной кислоты. Из каких двух веществ и как можно приготовить раствор точно такого же состава?
11-58. Средняя концентрация солей в морской воде выражается следующими числами (по массе): хлорид натрия — 2,91%, сульфат кальция — 0,13%, хлорид магния — 0,41%, сульфат калия — 0,09%, сульфат магния — 0,18%. Каких катионов больше всего в морской воде?
11-59. При применении цинка в качестве микроудобрения его вносят из расчета 15—20 кг сульфата цинка ZnS04-7H20 на гектар. Сколько это составляет в пересчете на ионы Zn 2+ ?
11-60. Для предпосевной обработки семян применяется раствор, содержащий 0,02% медного купороса. Вычислите, сколько (в процентах) это составляет в пересчете на ион Cu 2+ .
11-61. В каких количественных отношениях нужно взять массу хлорида калия и массу сульфата калия, чтобы получить растворы с одинаковым содержанием ионов К + ?
11-62. В каких количественных отношениях нужно взять массу сульфата магния и массу сульфата алюминия, чтобы получить растворы с одинаковым содержанием ионов SO — ?
11-63. Анализом было установлено, что раствор содержит 0,69 г/л Na + и 1,86 г/л N03
. Одинаковое или разное количество этих двух видов ионов содержится в указанном растворе?
11-64. Анализом было найдено, что в 1 л раствора сульфата натрия содержится 0,1 моль ионов S04 2- . Сколько граммов ионов Na + содержится в литре этого раствора?
11-65. Анализом было найдено, что в 1 л раствора, полученного растворением смеси бромида калия и бромида натрия, содержится 3 моль ионов Вг
и 1 моль ионов К + . Сколько граммов ионов Na + было в этом растворе?
11-66. Под картофель на четыре одинаковые делянки внесли эквивалентные количества сульфата калия, хлорида калия, сульфата натрия, хлорида натрия. Наибольший прирост урожая получился на первой делянке, меньший — на второй, на третьей прироста урожая не получилось, а на четвертой урожай снизился. Какое влияние на урожай картофеля в данном случае имели: а) катионы калия; б) катионы натрия; в) анионы хлора; г) анионы серной кислоты? Ответы обоснуйте.
водородных соединений и гидроксидов
от заряде з и радиусов ионов
11-67. Какое вещество, состоящее из двух элементов, подходит одновременно под определения кислоты и основания?
11-68, Какие из веществ, формулы которых КОН, НС103, НСlO4, KHS04, H20, образуют при диссоциации ионы водорода и гидроксида? Напишите соответствующие уравнения реакций.
11-69. Что представляют собой ионы водорода с точки зрения теории строения атомов? Как их открывают в водном растворе?
11-70. Изобразите электронную схему строения иона гидроксида (так, как ранее изображались электронные схемы строения молекулы воды и пр.). Как можно обнаружить ионы гидроксида в водном растворе?
11-71. Какие из соединений: аммиак, сероводород, фосфин, селеноводород — при растворении в воде способны присоединять протоны и какие их отщепляют?
11-72. Как меняется сила бескислородных кислот в зависимости от радиуса аниона?
11-73. Как зависит сила бескислородной кислоты от заряда аниона?
11-74. От каких факторов зависит сила кислородсодержащих кислот?
11-75. Какая из кислородсодержащих кислот хлора самая сильная: хлористая НС102, хлорноватая НС103, хлорноватистая НС10 или хлорная НС104 и почему? Проверьте свои рассуждения по справочнику.
11-76. Из трех кислот, формулы которых НС103; HN03; HBr03, укажите самую сильную и самую слабую. Ответ мотивируйте.
11-77. Какая из кислот, формулы которых H2C03; H2Si03 и •H2S03, самая сильная и почему? Ответ поясните.
11-78. От каких факторов зависит степень диссоциации оснований? Ответ поясните примерами.
11-79. Какое из оснований: Са(ОН)2; Mg(OH)2; NaOH; Ba(OH)2— самое сильное и какое самое слабое? Ответ мотивируйте.
11-80. Из четырех оснований: Ва(ОН)2; Sr(OH)2; Ca(OH)3; Mg(OH)2 — укажите самое сильное основание. Объясните почему.
11-81. Какое из оснований самое сильное и какое самое слабое: RbOH; NaOH; КОН или LiOH? Ответ поясните.
11-82. Какое из пяти оснований самое сильное: А1(ОН)3; Са(ОН)2; Mg(OH)2; NaOH; КОН? Дайте мотивированный ответ.
Реакции ионного обмена
11-83. В литре воды растворены 1 моль хлорида калия и 1 моль-иодида натрия. Из каких двух других солей и как можно приготовить раствор точно такого же состава?
11-84. В литре воды растворены 2 моль бромида калия и 1 моль сульфида натрия. Из каких двух других солей и как можно приготовить раствор точно такого же состава?
11-85. В литре воды растворены 1 моль сульфата магния и 2 моль хлорида натрия. Из каких двух других солей может быть приготовлен раствор точно такого же состава и какое количество каждой из них нужно для этого взять?
11-86. Укажите известные вам способы превращения атомов меди в ионы меди и ионов меди в атомы меди. Приведите соответствующие уравнения реакций.
11-87. Какие ионы могут присутствовать в растворе, если при введении ионов S04 2- выпадает осадок, а при введении ионов Сl образование осадка не наблюдается?
11-88. Напишите ионные уравнения реакций между растворенными в воде: а) гашеной известью и азотной кислотой; б) азотной кислотой и гидроксидом калия; в) серной кислотой и гидроксидом лития.
11-89. Напишите ионные уравнения реакций между растворенными в воде: a) H2Se04 (сильная кислота) и КОН; б) НС104 (сильная кислота) и NaOH.
11-90. Напишите ионные уравнения реакций между растворенными в воде: а) сульфатом меди и гидроксидом лития; б) хлоридом меди (II) и гидроксидом калия.
11-91. Напишите ионные уравнения реакций между растворенными в воде: а) сульфатом железа (II) и гидроксидом лития, б) сульфатом железа (III) и гидроксидом натрия.
11-92. Напишите иjнные уравнения реакций между растворенными в воде: а) нитратом магния и едким натром; б) сернокислым магнием и гидроксидом лития; в) хлоридом магния и гидроксидом кальция.
11-93. Напишите ионные уравнения реакций между растворенными в воде: а) сульфатом меди и хлоридом бария; б) сульфатом алюминия и хлоридом бария; в) сульфатом натрия и нитратом бария.
11-94. Напишите ионные уравнения реакций между растворами следующих солей: а) нитратом серебра и бромидом натрия; б) нитратом серебра и бромидом кальция; в) нитратом серебра и бромидом меди (II).
«Формирование и развитие системы 27.3.5 специализированных классов, лицеев и т.п. обеспечивающих профессиональную ориентацию учащихся средней школы Руководитель научно-образовательного . »
21. Дайте сравнительную характеристику свойств азотной и фосфорной кислот, сопоставив их физические и химические (окислительновосстановительные реакции и реакции обмена) свойства.
22. В насыщенный углекислым газом раствор приливают фиолетовый лакмус. Что наблюдается? Почему?
23. Какова высшая и низшая степень окисления у кремния? Почему они совпадают по численному значению? Приведите по одному примеру соединений кремния с этими степенями окисления.
24. Карборунд – соединение кремния с углеродом. Это тугоплавкое вещество, по твёрдости сопоставимо с алмазом. Какие степени окисления проявляют элементы в этом веществе? Какой тип кристаллической решётки?
Задания по теме «Неметаллы»
1. Составьте уравнения реакций по схеме: Х Н2 Y; X + Y = Z. Вещества Х и Y содержат водород: а) в различных степенях окисления; б) в одной и той же степени окисления +1.
3. Бромоводород в химических реакциях может выполнять различные функции: сильной кислоты, летучей кислоты, окислителя, восстановителя, осадителя. Приведите по одному примеру реакции, в которой бромоводород выполняет эти функции. Запишите уравнения реакций.
4. Соединения галогенов в степенях окисления +1, +3, +5 склонны к реакциям диспропорционирования (при нагревании). Также они легко разлагаются с выделением кислорода (при нагревании, в особенности в присутствии катализаторов). Напишите уравнения реакций диспропорционирования и разложения следующих соединений: KClO;
5. Наибольшее практическое значение из кислородсодержащих соединений галогенов имеет бертолетова соль (хлорат калия), она используется в производстве спичек и смесей для фейерверков. Напишите уравнения реакций бертолетовой соли с серой, фосфором.
Осуществите превращения: KCl KOH KClO KCl HCl 6.
7. Приведите два уравнения реакции, в одном из которых элементарная сера является окислителем, а в другом – восстановителем.
8. Как очистить сульфат бария от примеси карбоната бария?
9. Как из сульфата бария получить сульфат магния?
10. Приведите примеры трёх кислых солей, отличающихся друг от друга степенью окисления серы.
11. Напишите уравнения реакций, иллюстрирующих схему: S+6 S+6 S-2 S-2 S0 S+4 S+4 S+4.
12. Приведите примеры реакций, где молекулярный азот бывает окислителем и восстановителем.
13. Как относятся к нагреванию следующие соли аммония: хлорид, сульфат, дихромат, нитрат, нитрит, карбонат? Напишите уравнения реакций.
14. Закончите уравнения реакций, протекающих с количеством кислоты, достаточным для солеобразования с продуктами гидролиза соединений: Mg3N2 + H2SO4 = …; AlN + HNO3 ….
15. Какие продукты могут образоваться при обработке фосфида магния: а) раствором соляной кислоты; б) водой. Запишите уравнения реакций.
16. Запишите уравнения реакции с водой а) PCl5 б) POCl3. В результате реакций образуется в каждом случае две кислоты, в которых сохраняется степень окисления элементов.
17. Запишите уравнения реакций в ионной и молекулярной формах (по одному уравнению в каждом случае):
а) Ca2+ + PO43 = …; б) Al3+ + PO43 = …; в) OH + HPO42 = …; г) H+ + HPO42 = ….
18. Действие некоторых конструкций огнетушителей основано на реакции гидрокарбоната натрия с серной кислотой. Напишите уравнение этой реакции.
19. Совместное пребывание каких ионов приведет к необратимой химической реакции: а) Na+ и SiO32-; б) H+ и SiO32-; в) Ag+ и SiO32-; г) K+ и SiO32-?
25. Как осуществить превращения:
Теоретические вопросы и задания по теме «Классификация химических реакций»
1. Приведите примеры реакций неорганических веществ, которые невозможно отнести ни к реакциям соединения, ни к реакциям разложения, ни к реакциям замещения, ни к реакциям обмена.
2. В чём отличие реакций соединения в неорганической химии и реакций присоединения в органической химии?
3. В чём отличие реакций разложения в органической химии и реакций отщепления в органической химии?
4. В чём отличие реакций замещения в неорганической химии и органической химии?
5. Приведите примеры гомогенных реакций, протекающих в газовой фазе и гомогенных реакций, протекающих в жидкой фазе.
6. Приведите пример гетерогенных реакций, в которых есть граница раздела фаз: жидкость – твёрдое вещество, газ – жидкость, газ – твёрдое вещество, твёрдое вещество – твёрдое вещество, жидкость – жидкость.
7. Приведите примеры каталитической реакции и реакции, протекающей без участия катализатора.
8. Приведите пример обратимой и необратимой реакций.
9. Приведите пример экзотермической и эндотермической реакций.
10. Приведите пример реакции соединения, которая является гомогенной обратимой и протекает в газовой фазе с участием катализатора и выделением теплоты.
11. Классифицируйте по всем перечисленным признакам следующие процессы: а) горение водорода в кислороде; б) реакция этерификации между этанолом и уксусной кислотой; в) взаимодействие в водном растворе сульфата натрия и хлорида бария.
Теоретические вопросы и задания по теме «Скорость химической реакции»
1. Что такое скорость химической реакции? В каких единицах измеряется скорость химической реакции?
2. Какие факторы влияют на скорость химической реакции?
3. Как математически выражается зависимость скорости химической реакции от концентраций реагирующих веществ?
4. В двух одинаковых сосудах при одинаковых условиях находятся одинаковые количества веществ, которые реагируют между собой. В первом сосуде это вещества А и В, во втором – вещества Х и У. Будет ли одинаковой скорость химической реакции в этих сосудах? Ответ обоснуйте.
5. В двух одинаковых сосудах при одинаковых условиях находятся вещества А и В, которые реагируют между собой. В первом сосуде с(А) = 1 моль моль моль /л, с(В) = 1 моль/л. Будет ли /л, с(В) = 2 /л ; во втором сосуде с(А) = 2 одинаковой скорость химической реакции в этих сосудах? Ответ обоснуйте.
6. Для каких реакций справедливо правило Вант-Гоффа: для экзотермических, для эндотермических или для любых?
7. Каков физический смысл энергии активации?
8. Что такое переходное состояние (переходный комплекс)?
9. Каков механизм действия катализатора?
10. Приведите примеры технического использования гомогенного и гетерогенного катализа в неорганической и органической химии.
11. Почему нельзя кипятить бельё, замоченное в тёплом растворе стирального порошка, содержащего ферменты?
Теоретические вопросы по теме «Тепловой эффект химической реакции»
1. Какие реакции называются: а) эндотермическими; б) экзотермическими?
2. Что называется тепловым эффектом реакции? В каких единицах он выражается?
3. Какой знак имеет тепловой эффект для: а) эндотермических реакций; б) экзотермических реакций?
4. Что такое термохимическое уравнение?
5. Почему реакцию между азотом и кислородом не относят к реакциям горения?
6. Может ли энергия химической реакции выделяться не в виде теплоты?
7. Может ли разрыв химической связи проходить с выделением энергии, а образование химической связи — с поглощением энергии?
Теоретические вопросы по теме «Химическое равновесие»
1. Как называются реакции, протекающие в противоположных направлениях?
2. Почему химическое равновесие называют динамическим?
3. Сформулируйте принцип смещения химического равновесия.
4. Какие внешние факторы и как влияют на смещение химического равновесия?
5. Влияет ли катализатор на химическое равновесие?
6. Можно ли подбором соответствующего катализатора добиться увеличения доли выхода целевого продукта реакции?
7. Сформулируйте правила смещения химического равновесия в гомогенных и гетерогенных реакциях. В какую сторону сместится равновесие реакции: CO2(г) + C(кр) = 2CO(г), если добавить угля?
Задания по теме «Химическое равновесие»
1. В какую сторону сместится равновесие гомогенной газофазной реакции CO + H2O = CO2 + H2 при повышении давления?
2. В какую сторону сместится равновесие экзотермической обратимой реакции H2(г) + S(г) = H2S(г), если: а) понизить давление; б) понизить температуру; в) уменьшить концентрацию сероводорода.
3. Как скажется на состоянии химического равновесия в системе HF + ОН- = F- + Н2О а) добавление фторида калия; б) увеличение концентрации плавиковой кислоты; в) уменьшение температуры? Дайте обоснование влиянию каждого из факторов.
4. Как скажется на состоянии химического равновесия в системе Н2S + OH HS + H2O: а) добавление гидросульфида натрия; б) увеличение концентрации щёлочи; в) увеличение температуры? Дайте обоснование влиянию каждого из факторов.
5. Как скажется на состоянии химического равновесия в гомогенной газофазной системе С3Н6 + Н2 = С3Н8 а) увеличение давления; б) увеличение концентрации водорода; в) увеличение температуры? Дайте обоснование влиянию каждого из факторов.
6. Как скажется на состоянии химического равновесия в системе СО(г) + 2Н2(г) = СН3ОН(г) + Q а) уменьшение давления; б) уменьшение концентрации водорода; в) уменьшение температуры? Дайте обоснование влиянию каждого из факторов.
7. Как скажется на состоянии химического равновесия в гомогенной газофазной системе СН3СН2ОН = С2Н4 + H2O – Q а) увеличение концентрации спирта; б) вывод воды из реакционной смеси; в) уменьшение температуры?
Дайте обоснование влиянию каждого из факторов.
8. Предложите все возможные способы увеличения выхода продукта обратимой реакции 2СО(г) + О2(г) = 2СО2(г) + 568 кДж.
Рассмотрим равновесную систему С(т) + СО2(г) = 2СО(г) – 119,8 9.
кДж. Какое влияние на положение равновесия окажет: а) добавление углекислого газа; б) добавление угля; в) подвод теплоты к системе; г) сжатие системы; д) введение катализатора; е) удаление угарного газа; ж) введение в систему щёлочи.
Теоретические вопросы по теме «Теория электролитической диссоциации»
1. Какие вещества называются электролитами, а какие – неэлектролитами? Приведите примеры.
2. Что называется электролитической диссоциацией?
3. Сформулируйте основные положения теории электролитической диссоциации.
4. Что такое ионы? Какие ионы называются катионами, какие – анионами? Приведите примеры простых и сложных катионов и анионов.
5. Покажите в чём причина различия в механизмах диссоциации электролитов с ионной и ковалентными связями.
6. Что называется степенью электролитической диссоциации и от чего она зависит?
7. Какие электролиты называются сильными, а какие слабыми? Приведите примеры.
8. Что такое кислоты, основания, соли с точки зрения теории электролитической диссоциации?
9. Что называется водородным показателем? Каково значение водородного показателя в нейтральной среде, в кислой среде, в щелочной среде?
10. Какие реакции называются ионными реакциями?
11. Могут ли ионные реакции быть окислительно-восстановительными, приведите примеры?
12. Какое уравнение отражает сущность реакции ионного обмена?
13. Формулы каких веществ в ионных уравнениях записывают в виде ионов?
14. В каких случаях реакции обмена в растворах электролитов являются необратимыми, в каких – обратимыми, а в каких – не протекают?
Задания по теме «Теория электролитической диссоциации»
1. Почему водный раствор серной кислоты проводит электрический ток, а безводная серная кислота не проводит?
2. Какие из ниже перечисленных жидкостей обладают заметной электрической проводимостью: а) спирт ; б) водный раствор поваренной соли; в) дистиллированная вода; г) водный раствор сахара; д) 100%ная серная кислота; е) водный раствор азотной кислоты; ж) раствор азота в воде; з) водный раствор гидросульфата натрия; и) раствор хлороводорода в бензоле? Какие ионы обусловливают следующие свойства азотной кислоты: а) в растворе азотной кислоты лакмус имеет красную окраску; б) с раствором азотной кислоты реагирует медь.
3. На сколько ионов распадается при полной диссоциации молекула электролита: а) H2SO4; б) Sr(OH)2; в) H3PO4
4. Напишите формулы электролитов, в водном растворе которых содержатся ионы: а) Fe3+ и SO42-; б) Ca2+ и NO3-; в) K+ и CrO42-.
5. Как практически осуществить процессы, выражающиеся следующими схемами: а) HCl = H+ + Cl; б) Cu + Cl2 = CuCl2; в) Cu2+ + 2OH= Cu(OH)2
6. Запишите приведённые ниже ионные уравнения. Приведите примеры двух уравнений в молекулярной форме, соответствующих этому ионному уравнению: а) ион водорода + гидроксид ион = …; б) карбонат ион + ион водорода = …; в) ион серебра + гидроксид ион = ….
7. По какому признаку можно обнаружить взаимодействие между гидроксидом натрия и соляной кислотой, если у вас нет индикаторной бумажки? Является ли этот признак общим для всех реакций нейтрализации?
8. В каком молярном соотношении нужно взять сульфат магния и сульфат алюминия, чтобы получить растворы с одинаковым содержанием сульфат ионов?
9. В 1 л воды растворены 1 моль хлорида калия и 1 моль иодида натрия. Из каких двух других солей можно приготовить раствор точно такого же состава?
10. К раствору смеси двух солей добавили избыток соляной кислоты.
После окончания реакции в растворе кроме ионов Н+ и Cl оказались только ионы Na+. Какие соли могли находиться в исходном растворе?
11. Как можно установить в сульфате бария примеси: а) карбоната бария; б) хлорида бария?
12. Как очистить азотную кислоту от примеси соляной кислоты?
13. Приведите пример растворимой в воде соли, при обработке которой как кислотой, так и щелочью (при нагревании) образуются газообразные продукты реакции. Напишите уравнения реакций
14. Приведите пример растворимой в воде соли, при обработке которой как хлоридом бария, так и избытком щёлочи образуется осадок. Напишите уравнения реакций.
15. Можно ли назвать амфотерными ионы HCO3 ; HPO42 ; HSO3 ?
16. Какими способами можно кислую соль превратить в среднюю и наоборот? Приведите уравнения реакций.
17. Изменится ли степень диссоциации сероводородной кислоты, если к ней добавить соляную кислоту?
18. К раствору, содержащему смесь карбоната калия и хлорида натрия, добавили избыток соляной кислоты, а затем – избыток нитрата серебра.
Какие ионы остались в растворе. Ответ подтвердите ионными уравнениями реакций.
19. Имеются 4 соли: силикат натрия, карбонат натрия, сульфат натрия и сульфат кальция. Как с помощью раствора соляной кислоты можно различить эти соли?
Теоретические вопросы по теме «Окислительно-восстановительные реакции»
1. Какие реакции называются окислительно-восстановительными?
2. Что такое процесс окисления и процесс восстановления?
3. Что называется окислителем и что восстановителем?
4. Чем внутримолекулярные окислительно-восстановительные реакции отличаются от межмолекулярных? Приведите по одному примеру тех и других.
5. Охарактеризуйте, как влияет среда на направленность протекания окислительно-восстановительных реакций на примере соединений марганца и хрома.
6. Как проявляется окислительно-восстановительная двойственность пероксида водорода?
7. Как влияет концентрация азотной и серной кислот на характер их взаимодействия с металлами?
8. Приведите несколько примеров растворения простых веществ неметаллов в щёлочи. Какие реакции называются реакциями диспропорционирования (дисмутации).
9. Что такое реакция конпропорционирования (конмутации)?
10. Почему все реакции замещения являются окислительновосстановительными?
11. Приведите пример окислительно-восстановительной реакции разложения и реакции разложения, протекающей без изменения степеней окисления элементов.
12. Приведите пример окислительно-восстановительной реакции соединения и реакции соединения, протекающей без изменения степеней окисления элементов.
Задания по теме «Окислительно-восстановительные реакции»
1. В технологии получения меди оксид меди (I) нагревают с сульфидом меди (I). При этом восстанавливается металл. Какой еще продукт реакции образуется? Напишите уравнение реакции.
2. Смесь сухого сероводорода и сухого оксида серы (IV) пропустили через воду, при этом образовался осадок свободной серы. Составьте уравнение реакции между указанными веществами. Какое из веществ окисляется, какое восстанавливается?
3. Почему оксид углерода(II), оксид серы(VI), оксид фосфора(V) не могут быть окислены кислородом, а оксид углерода(II), оксид серы(IV), оксид фосфора(III) могут быть окислены кислородом? Запишите уравнения реакций. Составьте электронный баланс.
4. При взаимодействии раствора азотистой кислоты с раствором йодоводородной кислоты один из продуктов реакции газообразный оксид азота. Какой из оксидов азота (оксид азота(II) или оксид азота(IV)) образуется в этой реакции? Запишите уравнение реакции, составьте уравнения электронного баланса, расставьте коэффициенты с помощью уравнений электронного баланса.
5. Запишите два уравнения реакций, в одной из которых газообразный водород будет окислителем, а в другой – восстановителем.
6. Рассмотрите окислительно-восстановительную сущность реакций растворения магния в водном растворе: а) соляной кислоты; б) серной кислоты; в) ортофосфорной кислоты. Какая частица играет роль восстановителя в этих процессах?
7. За счёт каких элементов сероводород, йодид калия и аммиак относят к типичным восстановителям?
8. Какой элемент в бромоводородной кислоте может выполнять функцию окислителя, а какой функцию восстановителя? В какой из приведённых схем бромоводородная кислота окислитель, а в какой – восстановитель:
а) MnO2 + HBr MnBr2 + Br2 + H2O; б) Zn + HBr ZnBr 2 + H2.
9. Приведите примеры двух реакций, в которых реагирует несолеобразующий оксид СО. Протекают ли они без изменения степени окисления или являются окислительно-восстановительными?
10. При растворении железа в растворе бромоводородной кислоты образуется соль Fe2+, а при нагревании железа в броме – соль Fe3+. Составьте уравнения реакций и расставьте коэффициенты методом электронного баланса.
11. Приведите пример окислительно-восстановительной реакции, в которой два элемента окислителя входят в состав одного соединения.
Составьте уравнение реакции, приведите схему электронного баланса.
12. Приведите пример окислительно-восстановительной реакции, в которой два элемента восстановителя входят в состав одного соединения.
Составьте уравнение реакции, приведите схему электронного баланса.
13. Приведите примеры двух реакций с одним и тем же простым веществом, в одной из которых оно реагирует с окислителем, а в другой с восстановителем.
14. Приведите примеры двух реакций с одним и тем же сложным веществом, в одной из которых оно реагирует с окислителем, а в другой с восстановителем.
15. Используя метод электронного баланса или ионно-электронного баланса, составьте уравнение реакции:
а) NН3 + КClO N2 + КCl + ….
б) NН3 + Br2 N2 + NH4Br.
в) Cl2 + NН3H2O NH4Cl + N2 + …
г) KMnO4 + NН3 MnO2 + N2 + ….
д) Zn + KNO3 + … NН3 + K2ZnO2 + ….
е) SO2 + KMnO4 + … MnSO4 + … + H2SO4.
ж) Аl + K2Cr2O7 + … … + Cr2(SO4)3 + K2SO4 + H2O Определите окислитель и восстановитель.
17. Используя метод электронного или ионно-электронного баланса, составьте уравнения следующих ОВР, протекающих в водном растворе:
KMnO4 + Na2SO3 + H2SO4 а.
KMnO4 + Na2SO3 + H2O б.
KMnO4 + Na2SO3 + NaOH в.
Na2SO3 + K2Cr2O7 + H2SO4 г.
Cr(OH)3 + Cl2 + KOH д.
H2SO4(раствор) + Zn е.
H2SO4(конц.) + Zn ж.
HNO3 (конц.) + Cu з.
HNO3 (раствор) + Cu и.
HNO3 (конц.) + As2S3 л.
HNO3 (конц.) + Cu2S м.
KMnO4 + H2O2 + H2SO4 н.
Na2S2O3 + H2O2 о.
CrCl3 + H2O2 + NaOH п.
FeSO4 + K2Cr2O7 + H2SO4 р.
KI + PbO2 + HNO3 с.
C2H5OH + KMnO4 + H2SO4 CН3СНO + … т.
C6H12O6 + KMnO4 + H2O у.
I2 + MnO2 + H2SO4 MnSO4 + … х.
FeO + HNO3 (конц.) ц.
Cl2 + KOH (на холоду) ч.
MnO2 + HCl (конц.) ш.
Теоретические вопросы по теме «Гидролиз солей»
1. Какую среду показывают водные растворы различных солей? Почему?
2. Что называется гидролизом соли?
3. Какие соли гидролизуются по катиону, по аниону, по катиону и аниону? Приведите примеры таких солей
4. Какие соли не гидролизуются? Почему?
5. Какие соли гидролизуются ступенчато? Приведите примеры таких солей.
6. Запишите примеры реакций гидролиза в органической химии. Чем в органической химии реакции гидролиза отличаются от реакций гидратации?
Задания по теме «Гидролиз солей»
1. Изменится ли окраска фенолфталеина в растворе сульфида калия?
Составьте молекулярное и ионное уравнения гидролиза этой соли.
2. В одну пробирку налили раствор карбоната натрия, в другую – бромида меди (II). Какую окраску будет иметь лакмус в этих растворах?
Подтвердите ответ ионными уравнениями гидролиза.
3. Составьте молекулярные и ионные уравнения гидролиза солей:
нитрата меди (II); фосфата натрия; карбоната аммония; сульфата никеля, сульфата цезия; ацетата меди (II) сульфата алюминия. Растворы каких солей имеют рН 7? В растворах каких солей метилоранж имеет жёлтый цвет?
4. Составьте молекулярные и ионные уравнения гидролиза солей:
нитрата марганца (II); сульфида натрия; карбоната калия; сульфата натрия, сульфита цезия; ацетата калия сульфата цинка. Растворы каких солей имеют рН 7?
5. Почему в растворе гидрокарбоната натрия лакмус окрашивается с синий цвет, а в растворе гидросульфата натрия – в красный?
6. Смешали равные объёмы 1 М растворов сульфата калия и хлорида цинка. Расположите все ионы, существующие в этом растворе в ряд по увеличению их молярной концентрации.
7. Почему водный раствор сульфида натрия имеет довольно ощутимый запах «тухлых яиц»?
8. Почему раствор сульфида натрия при длительном стоянии в открытом сосуде перестаёт давать качественную реакцию (какую?) на сульфид-ионы?. Какое вещество останется в сосуде, если из него выпарить воду?
9. С помощью какого одного реактива можно различить растворы сульфата калия, сульфата цинка и сульфита калия?
10. В трех пробирках находятся растворы соды, сульфата алюминия и сульфата меди (II). Как распознать эти реактивы, не используя других реактивов?
11. Напишите полные уравнения реакций, протекающих в водных растворах, соответствующие превращениям:
Cr2S3 HCl X 1 Na CO X 2 KOH X 3 KOH X 4 ;
Теоретические вопросы по теме «Электролиз»
1. Что называется электролизом?
2. Как называются электроды электролизёра? Какие процессы на них протекают?
3. В чём принципиальное различие электролиза растворов электролитов от электролиза расплавов электролитов?
4. Какие катодные процессы могут протекать при электролизе растворов электролитов?
5. Какие анодные процессы могут протекать при электролизе растворов электролитов?
6. Приведите пример электролиза с растворимым анодом. Запишите уравнения катодного и анодного процесса.
Задания по теме «Электролиз»
1. Напишите уравнения электролиза с инертными электродами водных растворов: а) йодида калия; б) сульфата кальция; в) фосфата калия; г) нитрата свинца (II); д) бромида олова (II).
2. Напишите уравнения реакций, протекающих на катоде и аноде, а также общее уравнение электролиза водного раствора: а) нитрата бария на инертных электродах; б) фтороводородной кислоты на инертных электродах;
в) сульфата ртути (II) на инертных электродах; г) иодида лития на инертных электродах;
3. Напишите уравнения реакций, протекающих на катоде и аноде, а также общее уравнение электролиза расплава гидроксида натрия на инертных электродах.
4. Напишите уравнения электролиза расплава и водного раствора хлорида бария с графитовыми электродами. Чем отличаются эти процессы?
5. Напишите уравнения катодных трёх катодных процессов, которые протекают при электролизе водного раствора хлорида хрома (III).
6. Проводится электролиз водного раствора гидроксида лития на инертных электродах. Будет ли при электролизе изменяться: а) количество гидроксида лития; б) концентрация раствора? Ответ мотивируйте.
7. Какие процессы будут протекать при электролизе: а) водного раствора хлорида меди (II) с инертными электродами; б) водного раствора сульфата никеля (II) с никелевыми электродами?
8. В какой последовательности восстанавливаются данные металлы (железо, золото, медь, серебро) при электролизе растворов их солей?
9. Сравните, какие продукты будут находиться в растворе в результате электролиза водного раствора нитрата свинца (II) с инертными электродами в двух случаях: а) соль полностью подвергнута электролизу, и после этого электроды были вынуты из раствора; б) соль полностью подвергнута электролизу, и после этого в течение некоторого времени электроды остаются в растворе.
Объясните, по каким причинам при проведении электролиза 10.
раствора хлорида натрия, объём газа, выделяющегося на катоде больше объёма газа, выделяющегося на аноде (при одинаковых условиях).
Некоммерческая организация «Ассоциация московских вузов»
Московский государственный технический университет «МАМИ»
Состав научно-образовательного коллектива:
Е.О.Забенькина, доцент кафедры «Химия» к.х.н.
Д.В.Панкратов, ассистент кафедры «Химия»
Оглавление Теоретические вопросы по теме «Теория Бутлерова. Углеводороды». 86 Задания по теме «Теория Бутлерова. Углеводороды»
Вопросы и задания к теме «Ароматические соединения»
Теоретические вопросы по теме «Кислородсодержащие органические вещества»
Задания по теме «Кислородсодержащие органические вещества». 92 Вопросы и задания по теме «Углеводы»
Теоретические вопросы по теме «Азотсодержащие органические вещества»
Задания по теме «Азотсодержащие органические вещества»
Теоретические вопросы по теме «Основы координационной химии». 98 Теоретические вопросы по теме «Теория Бутлерова. Углеводороды»
1.Что легче определить: химический состав или строение органического вещества? Почему?
2.Из перечисленных ниже признаков выберите те, которые характерны для изомеров: свойства одинаковые или разные; химическое строение одинаковое или различное; количественный состав молекул одинаковый или различный.
3.Могут ли быть изомеры у вещества СОСl2? Дайте обоснованный ответ.
4. Какие частицы образуются при гомолитическом разрыве ковалентной связи? Имеют ли они какие-нибудь заряды?
5. Какие виды изомерии характерны для алканов, алкенов и алкинов?
6. Как связаны между собой строение углеродного скелета алканов и их реакционная способность?
7. Какие основные стадии можно выделить в реакции галогенирования алканов? Почему для её проведения требуется освещение?
8. Предложите два способа получения этана.
9. Чем принципиально отличаются механизмы реакций этана и этилена с хлором?
10. Как меняется пространственное строение этилена в результате присоединения хлороводорода?
11. Чем отличаются по химическим свойствам алкины от алкенов?
12. Перечислите способы получения алкенов и алкинов.
13. Покажите сходство бензола с предельными и непредельными углеводородами.
14. Чем отличаются по химическим свойствам гомологи бензола от самого бензола?
Задания по теме «Теория Бутлерова. Углеводороды»
1. Сколько веществ представлено формулами:
Cl Cl H Cl H Cl
А) Н–C – C–H Б) H–C – C–H В) H–C – С–Н Г) ClCH2 – CH2Cl HH Cl H H Cl
2. Сколько существует структурных изомеров октана, главная цепь которых состоит из пяти атомов?
3. Вещество А является гомологом 2-метилпропана и отличается от него на две группы СН2. Вещество Б имеет в своём составе четвертичный атом углерода и является изомером вещества А. Запишите структурные формулы веществ А и Б, назовите их по систематической номенклатуре.
4. Определите строение предельного углеводорода, если при его радикальном хлорировании образовалась смесь трёх монохлорпроизводных.
5. Какие продукты образуются при нагревании смеси бромметана и бромэтана с избытком металлического натрия?
6. Укажите промежуточное вещество при синтезе бутана по схеме:
7. Укажите промежуточные вещества Х и У при синтезе метана по схеме: бутан Х У метан.
8. Назовите вещество, которое можно получить трехстадийным синтезом по схеме: С4Н10 С4Н10 С4Н9Br С4Н8.
9. В реакции каталитической изомеризации предельного углеводорода образовался единственный продукт. Назовите его.
10. Выберите среди предложенных молекул те, для которых возможно существование геометрических изомеров, и напишите для них цис-форму: а) 3-метилпентен-1; б) 3-метилпентен-2; в) 1-хлор-3-метилпентен-1;
г) 2-хлор-3-метилпентен-1; д) 1,3-диметилциклобутан
11. Напишите структурные формулы всех алкенов состава С8Н16, образующихся при каталитическом дегидрировании 2,2,4-триметилпентана, и назовите их по систематической номенклатуре.
12. Предложите способ получения бутена-2 из бутена-1.
13. Напишите уравнение реакции присоединения бромоводорода к 3,3,3-трифторпропену.
14. Составьте уравнение полимеризации углеводорода С4Н8 с разветвлённым углеродным скелетом.
15. Напишите продукты последовательного присоединения хлороводорода к бутадиену – 1,3. Если возможно образование нескольких продуктов, напишите их формулы и назовите по систематической номенклатуре.
16. Напишите структурные формулы всех ацетиленовых углеводородов, образующих при каталитическом гидрировании 2метилпентан.
17. Приведите формулу углеводорода, в молекуле которого все четыре атома углерода находятся в sp-гибридном состоянии. Назовите его по систематической номенклатуре.
18. Какие соединения получаются при действии: а) спиртового раствора гидроксида калия на 2,2-дибромбутан; б) водного раствора гидроксида калия на 2,2-дибромбутан.
19. Какие два вещества вступили в реакцию, если в результате образовались только следующие продукты: а) бутин-1 и хлорид меди (I); б) бутин-2, бромид натрия и вода?
20. Предложите способ определения положения тройной связи в пентине.
21. Как из карбида алюминия получить карбид (ацетиленид) серебра?
22. Назовите по систематической номенклатуре продукты реакций между бензолом и: а) хлором на свету; б) недостатком хлора в присутствии хлорида алюминия; в) избытком хлора в присутствии хлорида алюминия.
23. Напишите уравнения реакций нитрования следующих веществ:
C6H5 – COOH; C6H5 – C2H5; C6H5 – OH; C6H5 – Cl; C6H5 – NH2.
24. Приведите пример арена, при окислении которого перманганатом калия образуется двухосновная кислота.
25. Какие вещества зашифрованы символами Х и У в цепочке превращений: метан Х У гексахлорциклогексан?
Вопросы и задания к теме «Ароматические соединения»
1. Сколько соединений изображают приведённые формулы?
OH CH3 H3C
2. Предложите три способа получения толуола. Напишите уравнения реакций.
3. Предложите два способа получения этилбензола из бензола.
4. Ароматизацией какого углеводорода может быть получен 1,2 – диметилбензол?
5. Исходя из углерода и любых неорганических реактивов получите 1,4диметилбензол. Укажите условия протекающих реакций.
6. Как из бензола получить: а) 1-хлор-2-нитробензол, б) 1-хлор-3нитробензол? Напишите уравнения реакций и укажите условия их протекания.
7. Предложите схему получения 4-нитробензойной кислоты из изопропилбензола в две стадии. Укажите условия реакций.
8. Назовите по систематической номенклатуре продукты реакций между бензолом и: а) хлором на свету; б) недостатком хлора в присутствии хлорида алюминия; в) избытком хлора в присутствии хлорида алюминия.
9. Как можно различить бензол и толуол?
10. Чем отличаются по химическим свойствам гомологи бензола от самого бензола? Приведите необходимые уравнения реакций.
11. При действии смеси концентрированных азотной и серной кислот на 1,3дихлорбензол получена смесь моно- и динитропроизводных. Напишите структурные формулы каждого из полученных изомеров.
12. Напишите продукты нитрования следующих веществ:
C6H5 – COOH; C6H5 – C2H5; C6H5 – OH; C6H5 – Cl; C6H5 – NH2.
13. Назовите по систематической номенклатуре продукты реакций между бензолом и: а) хлором на свету; б) недостатком хлора в присутствии хлорида алюминия; в) избытком хлора в присутствии хлорида алюминия.
14. Обладают ли какие-нибудь ароматические углеводороды способностью обесцвечивать бромную воду?
15. Некоторое органическое вещество обесцвечивает раствор перманганата калия, вступает в реакцию с хлором, но не реагирует с хлороводородом.
Что это за вещество?
16. Два изомерных ароматических углеводорода состава С9Н8 обесцвечивают бромную воду, а при окислении образуют бензойную кислоту. Известно, что один из них при взаимодействии с аммиачным раствором оксида серебра даёт осадок, а другой такого осадка не даёт. Определите строение этих углеводородов.
17. Приведите пример арена, при окислении которого перманганатом калия образуется двухосновную кислоту.
18. Вещество А при действии нитрирующей смеси образует соединение Б, применяемое как мощное взрывчатое средство. При окислении вещества А перманганатом калия образуется бензойная кислота. Что это за вещества – А и Б? В каком агрегатном состоянии находятся они при комнатной температуре?
19. Какие вещества зашифрованы символами Х и У в цепочке превращений:
метан Х У гексахлорциклогексан?
20. Использую только неорганическое сырьё, получите полистирол. Где он используется?
Теоретические вопросы по теме «Кислородсодержащие органические вещества»
1. Почему с увеличением молекулярной массы одноатомных спиртов растворимость их в воде понижается?
2. Соединения какого класса органических веществ являются межклассовыми изомерами спиртов?
3. Сравните кислотные свойства воды и предельных одноатомных спиртов.
4. Каким образом характер дегидратации спиртов зависит от температуры процесса?
5. Какая реакция иллюстрирует особые свойства многоатомных спиртов в отличие от одноатомных?
6. Объясните следующие свойства диэтилового эфира:
а) кипит при температуре значительно ниже этанола,
б) плохо, но все же растворяется в воде.
7. Чем объясняется растворимость фенола в воде? Как вы полагаете, будет ли фенол растворяться в спирте?
8. Почему фенолы проявляют большие кислотные свойства, чем спирты? Какой реакцией это можно подтвердить?
9. Укажите основные отличительные свойства спиртов и фенолов.
10. В чём причина большей реакционной способности бензольного ядра у фенолов по сравнению с ароматическими углеводородами? Какой реакцией это можно подтвердить?
11. Какие качественные реакции на альдегиды вам известны?
12. Укажите основные отличия химических свойств альдегидов и кетонов.
13. К какому типу реакций относится реакция образования фенолформальдегидной смолы?
14. Объясните, почему: а) уксусная кислота кипит при более высокой температуре, чем этиловый спирт (118° и 78°С),
б) низшие карбоновые кислоты хорошо растворимы в воде.
15. Какие свойства являются общими для карбоновых кислот и неорганических кислот? В каких реакциях проявляются свойства карбоновых кислот, отличные от свойств неорганических кислот.
16. Приведите уравнения реакций, характеризующих особые свойства муравьиной кислоты. С чем связано её отличие от других карбоновых кислот?
17. К какому классу веществ относятся жиры? С помощью каких реакций это можно доказать?
18. В чём разница в характере щелочного и кислотного гидролиза жиров?
19. Каково практическое значение процессов гидролиза жиров и гидрирования жиров?
20. Как объяснить, почему одноатомные спирты и одноосновные карбоновые кислоты, содержащие, подобно глюкозе шесть атомов углерода в молекуле, в воде не растворяются, а глюкоза в воде хорошо растворима?
21. Какие реакции подтверждают тот факт, что глюкоза – вещество с двойственной химической функцией?
Задания по теме «Кислородсодержащие органические вещества»
1. Напишите уравнение реакции этилового спирта с муравьиной кислотой в условиях кислотного катализа.
2. Приведите схемы реакций внутримолекулярной и межмолекулярной дегидратации этилового спирта в присутствии серной кислоты. Укажите условия, назовите получившиеся соединения.
3. Напишите уравнения реакций дегидрирования спиртов (катализатор
— медь, 200-300 °С): а) 1-пропанола, б) 2-пропанола, в) 3-метил-1бутанола, г) 3-метил-2-бутанола.
4. Напишите уравнения реакций этиленгликоля со следующими реагентами: а) натрием, б) бромоводородом, взятым в избытке, в) уксусной кислотой (серная кислота — катализатор), г) серной кислотой как катализатором д) свежеосаждённым гидроксидом меди (II).
5. Напишите структурную формулу соединения C4H10O, которое реагирует с металлическим натрием с выделением водорода, а при окислении образует кетон.
6. Напишите структурные формулы всех изомерных ароматических соединений состава С7Н8О. Определите, к какому классу органических соединений принадлежит каждый из изомеров.
7. Расположите в ряд по возрастанию кислотности вещества: С6Н5ОН, С2Н5ОН, СН3СООН, Н2О, Н2СО3.
8. Приведите пример реакции, характерной для фенолов и нехарактерной для спиртов.
9. Среди перечисленных ниже веществ выберите изомеры пентанонаа) пентаналь, б) метилэтилкетон, в) пентанол-2, г) циклопентанол, д) 2,2диметилпропаналь, е) пентандиол-1,3.
10. Напишите уравнения реакции гидролиза 1,1-дибром-3метилпентана.
11. Напишите схему реакции гидрирования ацетона. Назовите полученный продукт.
12. Напишите уравнение реакции ацетальдегида с аммиачным раствором оксида серебра.
13. Вещество Х состава С4Н8О при окислении образует 2метилпропионовую кислоту, а при восстановлении – 2-метилпропанол-1.
Определите строение вещества Х и напишите уравнения указанных реакций.
14. Напишите структурные формулы всех предельных одноосновных кислот состава С7Н14О2, содержащих в главной цепи шесть атомов углерода.
Назовите кислоты по систематической номенклатуре.
15. Расположите в ряд по увеличению кислотности следующие соединения: CH3COOH; HCOOH; CCl3COOH; Cl2CHCOOH; ClCH2COOH;
16. Как можно доказать присутствие муравьиной кислоты в уксусной кислоте?
17. Осуществите превращения: ацетат натрия уксусная кислота хлоруксусная кислота.
18. Напишите уравнения реакций пропионовой кислоты со следующими реагентами: а) цинком, б) раствором едкого натра, в) гидрокарбонатом натрия, г) хлором в присутствии каталитических количеств фосфора.
19. Допишите приведенные ниже уравнения реакций декарбоксилирования. Назовите образующиеся соединения:
а) CH3COONa + NaOH … ;
20. Приведите химические реакции, которые доказывают наличие в молекуле глюкозы: а) нормальной цепи углеродных атомов; б) альдегидной группы; в) пяти гидроксильных групп; г) глюкозидного (полуацетального) гидроксила.
21. Фруктоза в слабощелочной среде даёт реакцию серебряного зеркала. Объясните причину такого поведения фруктозы.
22. Как распознать при помощи одного реактива глицерин, уксусный альдегид и глюкозу? Напишите уравнения реакций.
23. Каким образом можно различить глюкозу и сахарозу.
24. С помощью каких реакций можно осуществить следующие превращения: сахароза глюкоза глюконовая кислота?
25. Если к раствору сахарозы прилить «известковое молоко» и смесь взболтать, то происходит растворение осадка. Как объяснить это явление?
26. Как отличить крахмал от целлюлозы по химическим свойствам?
27. Приведите примеры двух реакций этерификации с участием целлюлозы.
Вопросы и задания по теме «Углеводы»
1. Как объяснить, почему одноатомные спирты и одноосновные карбоновые кислоты, содержащие, подобно глюкозе шесть атомов углерода в молекуле, в воде не растворяются, а глюкоза в воде хорошо растворима?
2. Какие реакции подтверждают тот факт, что глюкоза – вещество с двойственной химической функцией?
3. Какая реакция, характерная для альдегидов, не свойственна глюкозе?
4. С помощью каких реакций можно доказать наличие в молекуле глюкозы:
а) альдегидной группы; б) пяти гидроксильных групп.
5. Как можно получить из глюкозы четыре разные калиевые соли?
6. Как можно различить а) глюкозу и сорбит; б) глюкозу и фруктозу?
7. Как распознать при помощи одного реактива глицерин, уксусный альдегид и глюкозу? Напишите уравнения реакций.
8. Как распознать при помощи одного реактива глицерин, альдегид, уксусную кислоту, глюкозу? Ответ подтвердите уравнениями реакций.
9. Из глюкозы и фруктозы можно получить одно и то же вещество, содержащее 6 атомов углерода в молекуле. Что это за вещество?
10. Полученное из глюкозы соединение Х в реакции с натрием образует соединение состава C3H4Na2O3, с карбонатом кальция – C6H10CaO6, с этанолом в присутствии серной кислоты – C5H10O3. Назовите соединение Х и напишите уравнения реакций.
11. Составьте уравнения реакций молочной кислоты: а) с натрием; б) с гидроксидом натрия.
12. Как, не определяя числовых значений молекулярных масс, найти разницу в молекулярных массах: а)глюкозы и рибозы; б) рибозы и дезоксирибозы.
13. Напишите формулу вещества, которое будет образовываться при окислении рибозы. Будет ли оно растворяться в воде? Почему?
14. Каким образом можно различить глюкозу и сахарозу.
15. Какие моносахариды принимают участие в образовании: а) сахарозы; б) мальтозы; в) лактозы. Составьте уравнения реакций их гидролиза.
16. Как можно убедиться в том, что сахароза не гидролизуется в стакане горячего чая?
17. С помощью каких реакций можно осуществить следующие превращения:
сахароза глюкоза глюконовая кислота?
18. Из сахарозы, не используя других углеродсодержащих соединений, получите уксусную кислоту.
19. Каким образом из древесных отходов можно получить искусственный каучук? Приведите уравнения реакций.
20. Сок зелёного яблока даёт реакцию с йодом; сок спелого яблока восстанавливает аммиачный раствор оксида серебра. Как объяснить эти явления?
21. Если учесть, что крахмал при гидролизе со 100%-ным выходом даёт глюкозу, то больше или меньше образуется по массе глюкозы по сравнению с исходным крахмалом?
22. Получите молочную кислоту, исходя из крахмала.
23. Как объяснить клеящее действие варёного картофеля?
24. Дайте определение следующим терминам: а) углеводы; б) моносахариды;
в) дисахариды; г) полисахариды; д) альдозы; е) кетозы; ж) альдогексозы;
з) кетопентозы. Проиллюстрируйте эти термины примерами конкретных соединений.
25. Приведите структурные формулы изомерных тетроз. Сколько пространственных изомеров соответствует каждому структурному изомеру? Приведите их проекционные формулы и назовите. Укажите, какие из них принадлежат к D-ряду.
26. Удельное вращение альфа-D-маннозы +29.3°, а бета- D-маннозы -17.0°. В водном растворе оба изомера постепенно изменяют удельное вращение до величины +14.2°. Объясните этот факт. Рассчитайте процентное содержание альфа и бета-аномеров в растворе с удельным вращением +14.2°.
27. Напишите реакции глюкозы со следующими соединениями: а) Br2(H2O);
б) HNO3; в) NaBH4; В какой форме реагирует г) [Ag(NH3)2]OH; е) (CH3CO)2O; глюкоза в каждой реакции? ж) CH3OH (катализатор — HCl).
Теоретические вопросы по теме «Азотсодержащие органические вещества»
1. Сравните основные свойства аммиака, метиламина и диметиламина.
2. Почему анилин обладает более слабыми основными свойствами, чем метиламин?
3. В чём заключается сходство в свойствах аммиака, алифатических и ароматических аминов?
4. Приведите примеры аминокислот, у которых преобладают: а) кислотные; б) основные свойства.
5. Приведите в общем виде уравнение реакции образования соединений с пептидной связью.
6.Какую роль в структуре белков играют: а) водородные связи; б) цистеиновые остатки?
7.Почему кожа желтеет при попадании на неё концентрированной азотной кислоты?
8.Перечислите биологические функции белков.
9.Какую роль играют водородные связи в построении белковой молекулы?
10. Что такое денатурация белков? Чем она может быть вызвана?
11. Перечислите основные отличия РНК от ДНК.
Задания по теме «Азотсодержащие органические вещества»
1. Напишите структурные формулы всех третичных аминов состава С5Н13N и назовите их.
2. Назовите соединения: а) CH3-CH(CH3)CH2CH2NH2; б) CH3-CH2CH2-NH-CH(CH3)2; в) (CH3-CH2-CH2)3N; г) CH3-CH(CH3)-CH(CH3)-N(CH3)2;
д) H2N-(CH2)6-NH2; е) CH3-CH(OH)-CH(CH3)-CH2-CH2-NH2
3. Объясните следующие факты: а) 1-пентиламин кипит при более высокой температуре (130°C), чем н-пентан (36°C), но при более низкой, чем 1-пентанол (138°C); б) триэтиламин имеет температуру кипения, близкую к температуре кипения триэтилметана (соответственно т. кип. 89.5 и 93.3°C); в) этиламин и диэтиламин хорошо растворяются в воде, а триэтиламин — плохо.
4. Следующие соединения расположите в порядке возрастания их основных свойств: а) CH3CH2OH; б) CH3CH2NH2; в) NH3; г) (CH3)2NH; д) (CH3CH2)2O.
5. Напишите уравнения реакций аминов с кислотами, приводящие к образованию солей: а) бромида метиламмония; б) гидросульфата диэтиламмония; в) хлорида триэтиламмония; г) йодида изопропиламмония.
6. Какие амины получаются при восстановлении: а) 2-нитробутана; б) 4-нитротолуола; в) 2-метил-2-нитропропана?
7. Расположите в порядке возрастания основности следующие вещества: метиламин, аммиак, анилин, диметиламин.
8. Как распознать с помощью качественных реакций бензол, анилин и фенол?
9. Сколько существует аминопропионовых кислот? Напишите их структурные формулы.
10. Напишите уравнения реакций, доказывающих амфотерность аланина.
11. Составьте уравнение реакций глицината аммония: а) с избытком щёлочи; б) с избытком соляной кислоты.
12. Сколько дипептидов может быть получено из цистеина и аланина? Приведите структурные формулы этих дипептидов.
13. Сколько трипептидов может быть получено сочетанием трёх различных аминокислотных остатков?
14. К какому классу соединений относится вещество:
CH2 (ОН)– CH(NH2) – CO – NH – CH2 – CO – NH – CH(CH2-C6H5) – COOH Напишите продукты его гидролиза: а) избытком водного раствора гидроксида натрия; б) избытком водного раствора соляной кислоты.




















2016 www.nauka.x-pdf.ru — «Бесплатная электронная библиотека — Книги, издания, публикации»
Материалы этого сайта размещены для ознакомления, все права принадлежат их авторам.
Если Вы не согласны с тем, что Ваш материал размещён на этом сайте, пожалуйста, напишите нам, мы в течении 1-2 рабочих дней удалим его.
http://geum.ru/next/art-159076.leaf-6.php
http://nauka.x-pdf.ru/17tehnicheskie/679531-3-formirovanie-razvitie-sistemi-2735-specializirovannih-klassov-liceev-obespechivayuschih-professionalnuyu-orientaciyu-uchasch.php