Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A — (анион)
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы
Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Правила составления уравнений диссоциации электролитов
1. При диссоциации сильных электролитов ставится знак « = » (равенства) или « ® » ( одна стрелочка). Этот знак обозначает полную диссоциацию.
2. При диссоциации слабых ( и средней силы) электролитов – знак « Û » (обратимости). Этот знак обозначает частичную диссоциацию.
Правила написания ионных уравнений
В ионных уравнениях на ионы расписываются:
1. сильные кислоты;
3. растворимые соли.
| Сильные электролиты | Слабые электролиты |
 Основания: Са(OH)2 = Ca 2+ + 2OH — Кислоты: HCl = H + +Cl — Соли: Na2CO3=2Na + +CO3 2 — KH2PO4=K + +H2PO4 — анион слабой кислоты H2PO4 — ÛH + +HPO4 2 — HPO4 2 — ÛH + +PO4 3 — AlOHCl2ÛAlOHCl2 = AlOH 2+ +2Cl — осадок растворимая катион слабого часть основания AlOH 2+ ÛAl 3+ +OH — Основания: Са(OH)2 = Ca 2+ + 2OH — Кислоты: HCl = H + +Cl — Соли: Na2CO3=2Na + +CO3 2 — KH2PO4=K + +H2PO4 — анион слабой кислоты H2PO4 — ÛH + +HPO4 2 — HPO4 2 — ÛH + +PO4 3 — AlOHCl2ÛAlOHCl2 = AlOH 2+ +2Cl — осадок растворимая катион слабого часть основания AlOH 2+ ÛAl 3+ +OH — | Основания: Fe(OH)2 ÛFeOH + + OH — 1 ступень FeOH + ÛFe 2+ +OH — 2 ступень Кислоты: H2CO3ÛH + +HCO3 — I ступень HCO3 — ÛH + +CO3 2 — II ступень Амфотерные гидроксиды: 1.  Zn(OH)2ÛZnOH + +OH — по осн. ZnOH + ÛZn 2+ +OH — типу 2. H2ZnO2ÛH + +HZnO2 — по кисл. HZnO2 — ÛH + +ZnO2 2 — типу Вода: H2OÛH + +OH — Zn(OH)2ÛZnOH + +OH — по осн. ZnOH + ÛZn 2+ +OH — типу 2. H2ZnO2ÛH + +HZnO2 — по кисл. HZnO2 — ÛH + +ZnO2 2 — типу Вода: H2OÛH + +OH — |
КОНЦЕНТРАЦИЯ РАСТВОРОВ
Важнейшей характеристикой количественного содержания компонентов в системе является концентрация растворов.
Концентрацией растворовназывают определенное массовое (или объемное) содержание растворенного вещества в определенном массовом (или объемном) количестве растворителя или раствора.
Существуют несколько методов выражения концентрации растворов. Рассмотрим самые распространенные из них:
| Методы выражения концентрации растворов | Обозначение и размерность применяемых величин |
Массовая доля растворенного вещества – это отношение массы растворенного вещества к общей массе раствора: 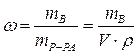 | 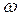 — массовая доля растворенного вещества, безразмерная величина — массовая доля растворенного вещества, безразмерная величина |
| mВ — масса растворенного вещества, г | |
| mР-РА — масса раствора, г | |
| V — объем раствора, мл | |
| ρ -плотность раствора, г/мл | |
Процентная концентрация: 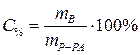 | С% — процентная концентрация, % |
| m В — масса растворенного вещества, г | |
| mР-РА — масса раствора, г | |
Молярная концентрация, или молярность,– число молей растворенного вещества в 1 дм 3 (1 литр) раствора:  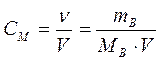 | СМ — молярная концентрация , или молярность; иногда обозначают М |
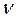 — количество (число моль) растворенного вещества, моль — количество (число моль) растворенного вещества, моль | |
| V — объем раствора, дм 3 (л) | |
| mВ — масса растворенного вещества, г | |
| МВ — молярная масса растворенного вещества, г/моль |
При решении задач необходимо обращать особое внимание на размерность применяемых величин и обязательно приводить их в соответствие друг другу. Поэтому при подстановке численных значений в формулы надо указывать размерность величин. Решение задач оформлять обязательнов соответствии с приведенными примерами (см. стр. 67 – 71).
ГИДРОЛИЗ СОЛЕЙ
Гидролиз– это процесс взаимодействия соли с водой, в результате которого происходит смещение ионного равновесия воды и изменение значения рН раствора. Возможность и характер протекания гидролиза определяется природой основания и кислоты, образующих соль.
Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются. Их водные растворы нейтральны.
В гидролизе участвуют ионы слабого основания и/или слабой кислоты.
· Гидролиз солей, образованных сильной кислотой и слабым основанием,например, NH4Cl:
NH4Cl = NH4 + +Cl —
Гидролизу подвергается катион слабого основания NH4 + :
NH4 + + HOH Û NH4OH + H + (ионы H + в избытке).
NH4Cl + H2O Û NH4OH + HCl – кислая среда (рН + + SO3 2 —
Гидролизу подвергается анион слабой кислоты SO3 2 — :
1-я ступень: SO3 2 — +HOH Û HSO3 — +OH — (ионы OH — в избытке).
Молекулярное уравнение 1-й ступени:
Na2SO3 + H2O Û NaHSO3 + NaOH – щелочная среда (рН > 7).
При обычных условиях гидролиз протекает главным образом по первой ступени.
· Гидролиз солей образованных слабым основанием и слабой кислотой ((NH4)2CO3, Al2S3 и т.д.), гидролизуются как по катиону, так и по аниону. В этом случае гидролиз соли протекает до конца: в уравнении происходит замена знака “Û” на “=”, а рН среды определяется силой кислоты и основания:
NH4ClO = NH4 + + ClO —
NH4 + + ClO — + HOH = NH4OH + HClO
K(HClO) = 3×10 -8 -5 , так как основание является более сильным электролитом, чем кислота, среда слабощелочная рН > 7.
· Совместный гидролиз двух солей Если в растворе одновременно присутствуют ионы, связывающие Н + и ОН — , то в соответствии с принципом Ле Шателье равновесие смещается в сторону усиления процесса гидролиза. Гидролиз может протекать необратимо с образованием малорастворимого и газообразного веществ.
В качестве примера можно рассмотреть совместный гидролиз следующих солей:
2Al 3+ + 3S 2 — + 6H2O = 2Al(OH)3 + 3H2S
7.ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ
РЕАКЦИИ (ОВР)
Окислительно-восстановительными называются реакции, в результате которых изменяются степени окисления элементов, входящих в состав реагирующих веществ. Например:
Уравнения диссоциации
Диссоциация кислот, щелочей и солей
Кислоты — при диссоциации образуют ионы водорода* (и анионы кислотных остатков):
HBr → H + + Br − (бромид-ион)
Щелочи — при диссоциации образуют ионы металлов и гидроксид-ионы:
NaOH → Na + + OH −
Соли — при диссоциации образуют ионы металлов и анионы кислотных остатков:
NaCl → Na + + Cl −
Как записывать уравнения электролитической диссоциации
Величина заряда иона равна валентности, ставится перед знаком заряда:
BaS → Ba 2 + + S 2 − (сульфид-ион)
Число ионов показываем с помощью коэффициентов, а не индексов:
K 2 S → 2 K + + S 2−
Кислотный остаток при диссоциации пишем целиком (не теряем индекс):
Na NO3 → Na + + NO 3 − (нитрат-ион)
При этом число ионов кислотного остатка также показываем с помощью коэффициентов:
Сa(NO3) 2 → Сa 2+ + 2 NO3 −
* Это интересно!
В учебниках часто приходится встречать утверждение, что ион водорода — это гидратированный протон: H3O + .
На самом деле такие частицы в растворах кислот не обнаружены. Протон при гидратации присоединяет две молекулы воды и формула иона водорода полностью должна была бы записываться так: H5O2 + .
http://lektsii.org/7-23698.html
http://staminaon.com/ru/chemistry/chemistry_9-49.htm








