Как проверить выполнение уравнения клапейрона опытным путем
Лабораторная работа № 201
ИЗУЧЕНИЕ ГАЗОВЫХ ЗАКОНОВ
Цель работы: изучение газовых законов;
проверка уравнения Клапейрона.
Приборы и принадлежности:
колба с термометром,
электрическая плитка со штативом.
Основные теоретические сведения
Согласно молекулярно-кинетической теории все вещества состоят из молекул, находящихся в непрерывном хаотическом движении, которые взаимодействуют между собой. Термодинамическое состояние некоторых простейших газов (Н2, N 2 , O 2 , инертные газы и др.) можно описывать с помощью модели идеального газа при некоторых условиях.
Идеальный газ — это теоретическая модель газа, в которой пренебрегается размерами молекул и взаимодействием между ними. Столкновение молекул газа между собой и стенками сосуда считается абсолютно упругим. Молекула между двумя последовательными столкновениями движется по прямой траектории.
Термодинамическим процессом называется изменение состояния термодинамической системы (например, идеального газа), связанное с изменением термодинамических параметров. Такими параметрами являются: давление р, температура Т, объем V , масса m и др.
Состояние идеального газа описывается уравнением Клапейрона-Менделеева:

где 
Моль — единица измерения количества вещества в СИ. Соответствует количеству вещества, содержащему столько структурных единиц (атомов, молекул, ионов, электронов или любых других частиц), сколько содержится атомов в 12 г изотопа углерода 
Опытным путем был открыт целый ряд законов, описывающих поведение идеальных газов.
Закон Бойля-Мариотта. Для неизменного числа молекул газа при постоянной температуре произведение давления газа на его объем есть величина постоянная:
pV = const при T = const, N = const.

Для двух состояний системы закон Бойля-Мариотта запишется:
р 1 V 1 = р 2 V 2 или
где индексы 1 и 2 относятся к произвольным состояниям. На рисунке состояния 1 и 2 можно представить в виде двух точек, лежащих на одной изотерме.
Законы Гей-Люссака и Шарля.
1. При постоянных давлении р и числе молекул N отношение объема идеального газа к абсолютной температуре остается постоянным, т.е.
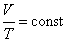
2. При постоянных объеме V и числе молекул N отношение давления идеального газа р к абсолютной температуре Т остается постоянным, т.е.

Термодинамический процесс перехода газа из одного состояния в другое, протекающий при постоянном давлении, называется изобарным. На диаграмме в координатах V , T (рис. 201.2 а) этот процесс изображается прямой, называемой изобарой. Термодинамический процесс перехода газа из одного состояния в другое, протекающий при постоянном объеме, называется изохорным. На диаграмме в координатах р, T (рис. 201.2 б) он изображается прямой, называемой изохорой.
 |
Для двух состояний газа законы Гей-Люссака и Шарля можно представить в следующем виде:
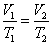

где индексы 1 и 2 относятся к произвольным состояниям. На рисунке точки 1 и 2 лежат на одной изобаре или изохоре.
Закон Авогадро. Моли любых газов при одинаковых температурах и давлениях занимают одинаковые объемы. При нормальных условиях ( ро = 1,013 × 10 5 Па и То = 273,15 К) этот объем равен V o = 22,41 × 10 — 3 м 3 = 22,41 л .
Закон Дальтона. Давление смеси идеальных газов равно сумме парциальных давлений, создаваемых компонентами газовой смеси:
где р1, р2, . . . , р n — парциальные давления. Парциальным называется давление, создаваемое однородным газом, если бы он один целиком занимал объем, равный объему смеси при той же температуре.
Закон Клапейрона (объединенный газовый закон). Если изменяются параметры р, V и Т, а число молекул N газа остается неизменным, то состояние идеального газа описывается уравнением Клапейрона:

Для двух состояний газа закон Клапейрона имеет вид:

Описание рабочей установки и метода измерений
Для проверки уравнения Клапейрона (201.2) воздух в закрытой колбе 3 (см. рис. 201.3) нагревают с помощью электроплитки 6 от комнатной температуры до
40 ¸ 50 o C , регистрируя изменение высоты столба воды в коленах водяного манометра 8 через каждые 4 ¸ 6 ° С. В зависимости от числа опытов n , т.е. в зависимости от числа состояний системы, уравнение (201.2) запишем:

где р0 и V 0 — первоначальные давление и объем воздуха в колбе при комнатной температуре То . Нагревание воздуха в закрытой колбе до температуры Т1 сопровождается ростом давления:
где r — плотность воды ( r = 1000 кг/м 3 ), h — разность уровней воды в коленах манометра. Для удобства измерения h начало миллиметровой шкалы совмещают с первоначальным уровнем воды в коленах манометра. Тогда h = 2 h 1 и
Объем воздуха при температуре Т1 также увеличивается, вытесняя столб жидкости в манометре на величину h 1 ( c м. рис. 3):
где S — площадь внутреннего сечения стеклянных трубок манометра.
Таким образом, используя формулы (201.4) и (201.5), найдем численные значения отношений выражения (201.3), которые согласно закону Клапейрона, должны быть равны друг другу.
где n — число опытов или число состояний системы.
Подготовка экспериментальной установки к работе. Колбу 3 с термометром 4 помещают в химический стакан 5, установленный на электроплитке 6, и закрепляют с помощью регулировочного винта 1 лапки штатива 2 (для устойчивого положения, когда колба будет находиться в воде). Для равномерного нагревания воздуха в колбе воду в стакан наливают так, чтобы колба почти полностью находилась в воде (см. рис. 201.3). В открытой колбе, т.е. когда зажим 7 открыт, уровень воды в обоих коленах манометра 8 должен совпадать с нулем миллиметровой шкалы 9. Кроме того, шкалу манометра можно перемещать, ослабив регулировочные винты 10, на несколько миллиметров вверх или вниз для более точного совмещения нуля шкалы с первоначальным уровнем воды.
Порядок выполнения работы
и обработка результатов измерений
1. Ослабить зажим 7 и проверить, совпадает ли уровень воды в коленах манометра с нулем шкалы.
2. Записать в таблицу 201.1 начальные значения параметров состояния воздуха в колбе: То и p о определяют с помощью термометра и барометра, находящихся в лаборатории, объем колбы V о и площадь S внутреннего сечения трубок манометра необходимо выяснить у преподавателя, ведущего занятия, или лаборанта. Давление ро, измеренное с помощью барометра в миллиметрах ртутного столба необходимо перевести в паскали ( 1 мм рт.ст. = 133 Па).
3. Перекрыть с помощью зажима 7 доступ воздуха в колбу и включить электрический нагреватель 6.
4. Воздух в закрытой колбе нагревают от комнатной температуры до 40 – 50 ° С (по указанию преподавателя) и через каждые 4 — 5 ° С, в зависимости от цены деления термометра, фиксируют по шкале манометра значения h 1 , h 2 , h 3 , …, hn соответствующие температурам Т1, Т2, Т3, …, Tn . Данные измерений занести в таблицу 201.2.
Внимание! По окончании измерений немедленно ослабить зажим 7 и выключить электроплитку.
6. Используя выражения (201.6) осуществляют проверку закона Клапейрона (201.3). Результаты вычислений занести в таблицу 201.2.
Физический практикум. Лабораторная работа. Уравнение состояния идеального газа. 10-й класс
Разделы: Физика
Класс: 10
Образовательные цели урока:
- приобретение навыков работы с физическими приборами,
- закрепление знаний, приобретенных в процессе учебной деятельности,
- совершенствование навыков в исследовательской деятельности.
- Организационный момент
- Изучение устройства и принципа действия приборов.
- Ознакомление с правилами техники безопасности.
- Повторение теоретического материала по данной теме.
- Формирование плана выполнения работы.
- Осуществление экспериментальной части работы.
- Запись результатов эксперимента.
- Математические расчеты. Оформление работы. Выводы.
Методические цели урока.
- Формирование коммуникативных отношений во время коллективной работы в группах.
- Овладение приемами безопасного обращения с физическими приборами.
- Развитие интереса к исследовательской деятельности.
- Закрепление знаний, приобретенных на уроках физики.
- Использование знаний, умений и навыков в повседневной деятельности учащихся.
Уравнение состояния идеального газа. 10-й класс.
Цель: подтвердить справедливость уравнения Клапейрона.
Ответить на вопросы:
- В чем заключается сущность уравнения состояния идеального газа.
- Записать математическое выражение уравнения Клапейрона.
- Какие физические величины остаются неизменными при выполнении опытов?
- Какие параметры газа изменяются в процессе выполнения работы?
Приборы и материалы:
- Калькулятор.
- Гофрированный металлический сосуд переменного объема.
- Жестяная банка объемом 3 литра.
- Манометр.
- Термометр спиртовой (бытовой).
- Соединительный резиновый шланг.
Порядок выполнения работы:
- Начертить в тетради таблицу № 1.
- Расположить приборы на рабочем столе.
- Соединить манометр с гофрированным сосудом с помощью резинового шланга.
- На манометре закрыть выпускной кран.
- Записать.
а) величину атмосферного давления в классе 
б) объем гофрированного сосуда 
в) температуру воздуха в градусах Цельсия.
- Пользуясь формулой
, вычислить абсолютную температуру воздуха в гофрированном сосуде (абсолютную температуру воздуха в кабинете физики).
- Записать значение абсолютной температуры
- Вычислить выражение
до значения третьего десятичного знака и округлить до сотых долей.
- Результаты измерений и вычислений занести в таблицу № 1.
 |  |  |  |
Начертить в тетради таблицу № 2.
- Пользуясь рычагом, прикрепленным к винту гофрированного сосуда, уменьшаем его объем, устанавливая указатель против цифры 8. (Выпускной кран на манометре закрыт).
- Из водопроводного крана набираем в банку горячую воду (температура порядка 50 градусов Цельсия).
- Гофрированный сосуд опускаем в банку с горячей водой.
- Термометр помещаем в воду.
- Наблюдаем за показаниями термометра до того момента, когда температура перестанет повышаться.
- Фиксируем температуру воды в градусах Цельсия (температуру воздуха в гофрированном сосуде).
- Вычисляем абсолютную температуру по формуле
.
- Записываем значение абсолютной температуры
.
- Обращаем внимание на манометр. Записываем показание манометра
.
- Вычисляем выражение
до значения третьего десятичного знака и округляем его до сотых долей.
- Записываем результаты измерений и вычислений в таблицу № 2.
 |  |  |  |
- Сравниваем результаты вычислений первого и второго опытов и записываем вывод.
Вывод: (выбрать правильный):
а) в результате проведенной лабораторной работы мы убедились, что для данной массы газа произведение давления на объем деленное на абсолютную температуру не остается постоянной величиной. Уравнение Клапейрона не выполняется для реальных газов (воздуха).
б) в результате проведенной лабораторной работы мы убедились, что для данной массы газа произведение давления на объем деленное на абсолютную температуру остается постоянной величиной. Уравнение Клапейрона выполняется для реальных газов (воздуха).
В результате многократно проведенной лабораторной работы мы убедились, что для данной массы газа произведение давления на объем деленное на абсолютную температуру остается постоянной величиной. Уравнение Клапейрона выполняется для реальных газов (воздуха).
Для двух опытов: 

Работа физического практикума выполняется группой учеников в составе 2–4 человек в течение одного часа. Особое внимание следует уделить соблюдению техники безопасности и сохранности физических приборов.
- Учебное оборудование для кабинетов физики общеобразовательных учреждений / Ю. И. Дик, Ю. С. Песоцкий и др., под ред. Г. Г. Никифорова. – М.: Дрофа, 2005.
- Факультативный курс физики 10 кл. Учеб. Пособие для учащихся \О. Ф. Кабардин, В. А. Орлов и др., под ред. А. В. Пономарева. – М.: Просвещение 1987.
- Демонстрационный эксперимент по физике в старших классах средней школы. Т. 1. Механика, теплота. Под ред. А.А.Покровского. Пособие для учителей. – М., Просвещение.1971.
- Мякишев Г. Я., Буховцев Б. Б., Сотский Н.Н. Физика. Учеб. для 10 кл. общеобразоват. учреждений. – М.: Просвещение, 2005.
Уравнение Клапейрона-Менделеева
Что такое уравнение Клапейрона-Менделеева
Идеальный газ — это газ, в котором пренебрегают взаимодействием молекул газа между собой.
Идеальными считают разреженные газы. Особенно близкими к идеальным считают гелий и водород.
Идеальный газ — это упрощенная математическая модель, которая широко применяется для описания свойств и поведения реальных газов при атмосферном давлении и комнатной температуре.
Давление, объем и температура — это основные параметры состояния системы, и они связаны друг с другом. Соотношение, при котором определяется данная связь, называется уравнением состояния данного газа.
Существует эквивалентная макроскопическая формулировка идеального газа — это такой газ, который одновременно будет подчиняться закону Бойля-Мариотта и Гей-Люссака, то есть:
p V = c o n s t * T
В представленном выше уравнении состоянии газа под const подразумевается количество молей.
Свойства классического и квазиклассического идеального газа описываются уравнением состояния идеального газа, которое называется уравнением Менделеева-Клапейрона, ниже представлена формула Менделеева-Клапейрона.
p V = m M R T = n R T , где m — масса газа, M — молярная масса газа, R = 8 , 314 Д ж / ( м о л ь * К ) — универсальная газовая постоянная, T — температура (К), n — количество молей газа.
Таким образом давление и объем прямо пропорциональны количеству молей и температуре.
Также уравнение Клапейрона-Менделеева можно записать в ином виде:
p V = N k T , где N — это количество молекул газа массой m , k = 1 , 38 * 10 — 23 Д ж / К — постоянная Больцмана, которая определяет «долю» газовой постоянной, приходящуюся на одну молекулу и определяется по формуле:
N = m N A M , где
N A = 6 . 02 * 10 23 м о л ь — 1 ; — это постоянная Авогадро.
Какое значение имеет универсальная газовая постоянная
Универсальная газовая постоянная (R) — это величина, которая является константой, численно равная работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 K.
Значение данной константы находится как произведение постоянной Больцмана ( k = 1 , 38 * 10 — 23 Д ж / К ) на число Авогадро ( N A = 6 . 02 * 10 23 м о л ь — 1 \) . Таким образом универсальная газовая постоянная принимает следующее значение: R = 8 , 314 Д ж / ( м о л ь * К ) .
Постоянную Больцмана используют в формулах, описывающих изучаемое явление или поведение рассматриваемого объекта с микроскопической точки зрения, тогда как универсальная газовая постоянная более удобна при расчетах, касающихся макроскопических систем, когда число частиц задано в молях.
Связь с другими законами состояния идеального газа
С помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса и один трех макропараметров (давление, температура или объем) — остаются неизменными.
Количественные зависимости между двумя параметрами газа при фиксированном третьем параметре называют газовыми законами, которые связывают эти параметры.
Изопроцессы — это термодинамические процессы, во время протекания которых количество вещества и один из макропараметров состояния: давление, объем, температура или энтропия — остается неизменным.
В зависимости от того, какой параметр остается неизменным различают разные процессы, которые выражаются законами, являющимися следствием уравнения состояния газа:
- изотермический процесс (T=const);
- изохорный процесс (V=const);
- изобарный процесс (p=const).
Изотермический процесс (T=const)
Процесс изменения состояния термодинамической системы при постоянной температуре называют изотермическим.
Для поддержания температуры газа постоянной необходимо, чтобы он мог обмениваться теплотой с большой системой — термостатом. Им может служить атмосферный воздух, если температура его заметно не меняется на протяжении всего процесса.
Согласно уравнению Клапейрона-Менделеева, в любом состоянии с неизменной температурой произведение давления газа на объем одно и то же, то есть постоянно:
Этот закон был открыт экспериментально английским ученым Бойлем и несколько позднее французским ученым Мариоттом. Именно поэтому он называется закон Бойля-Мариотта.
Закон Бойля-Мариотта справедлив для любых газов, а также для смеси газов (например, для воздуха).
Зависимость давления газа от объема при постоянной температуре изображается графической кривой — изотермой. Изотерма для различных температур представлена в координатах pV на рис.1. и представляет собой гиперболу.
Рис.1. Изотерма в pV — координатах.
Изохорный процесс (V=const)
Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным.
Из уравнения состояния следует, что отношение давлений газа данной массы при постоянно объеме равно отношению его абсолютных температур:
p 1 p 2 = T 1 T 2
Газовый закон был установлен экспериментально в 1787 г. французским физиком Ж. Шарлем и носит название закона Шарля: давление данной массы газа при постоянном объеме прямо пропорционально абсолютной температуре.
Так, если в качестве одного из состояний газа выбрать состояние газа при нормальных условиях, тогда
p = p 0 T T 0 = p 0 γ T
Коэффициент γ называют температурным коэффициентом давления газа. Он одинаков для всех газов.
Зависимость давления газа от температуры при постоянном объеме изображается графически прямой, которая называется изохорой (Рис.2).
Рис.2 Изображение изохоры в pT-координатах.
Изобарный процесс (p=const)
Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным.
Из уравнения Клапейрона-Менделеева вытекает, что отношение объемов газа данной массы при постоянном давлении равно отношению его абсолютных температур.
V 1 V 2 = T 1 T 2
Если в качестве второго состояния газа выбрать состояние при нормальных условиях (нормальном атмосферном давлении, температуре таяния льда) следует:
V = V 0 T T 0 = V 0 α T
Этот газовый закон был установлен экспериментально в 1802 г французским ученым Гей-Люссаком.
Закон Гей-Люссака: объем данной массы газа при постоянном давлении прямо пропорционален абсолютной температуре.
Коэффициент α называют температурным коэффициентом объемного расширения газов.
Зависимость объема газа от температуры при постоянном давлении изображается графической прямой, которая называется изобарой (Рис.3).
Рис. 3. Изобара в VT-координатах.
Использование универсального уравнения для решения задачи
В реальности проводятся различные физико-химические процессы. Рассмотрим каким образом уравнение состояния идеального газа и законы, связанные с ним находят применение для решения физических и химических задач.
Определить давление кислорода в баллоне объемом 1 м 3 при температуре t = 27 C o . Масса кислорода 1 кг.
Так как в уравнении даны объем и температура — два из трех макроскопических параметров, а третий (давление) нужно определить, то мы можем использовать уравнение Клапейрона-Менделеева:
p V = n R T = m M R T
Не забываем перевести температуру в Кельвины:
T = t + 273 = 27 + 273 = 300 K
Молярная масса кислорода известна из таблицы Менделеева:
M ( O 2 ) = 2 * 16 = 32 г / м о л ь = 32 * 10 — 3 к г / м о л ь
Выразим из уравнения состояния давления и поставим все имеющиеся данные:
p = n R T V = m R T M V = 1 * 8 . 31 * 300 32 * 10 — 3 * 1 = 77 . 906 П а = 78 к П а
Ответ: p = 78 кПа.
Каким может быть наименьший объем баллона, содержащего кислород массой 6,4 кг, если его стенки при t = 20 C o выдерживают p = 1568 Н / с м 2 ?
Используем уравнение Менделеева-Клапейрона, из которого выражаем объем кислорода, который нужно найти:
p = n R T V = m R T M V
Молярная масса кислорода предполагается равной:
M ( O 2 ) = 2 * 16 = 32 г / м 3
Не забываем перевести температуру в Кельвины:
T = t + 273 = 20 + 273 = 293 K
Переводим давление: p = 15680000 Па
Выражаем из уравнения Клапейрона-Менделеева объем и подставляем значения, данные в условиях задачи:
V = n R T p = m R T M p = 6 . 4 * 8 . 31 * 293 15680000 * 32 * 10 — 3 = 3 . 1 * 10 — 2 м 3 = 31 л .
Используя уравнение состояния идеального газа, доказать, что плотность любого газа равна половине плотности водорода ( ρ Н 2 ) , взятого при тех же условиях, умноженной на относительную молекулярную массу этого газа M_r, то есть ρ = ρ Н 2 * M r 2 .
Согласно уравнению Менделеева-Клапейрона:
p = n R T V = m R T M V
Плотность — это величина, характеризующая массу некоторого объема и находится по формуле:
ρ = m V и л и V = m ρ
Тогда p m ρ = n R T = m R T M
Откуда выражаем плотность газа:
Для водорода эта формула запишется следующим образом:
ρ H 2 = p M H 2 R T
По условию задачи водород и любой другой газ находятся при одинаковых условиях, откуда следует, что:
ρ H 2 M H 2 = p R T
Поставим последнее выражение в выражение для плотности любого газа:
ρ = M * ρ H 2 M H 2
Молярная масса водорода, исходя из таблицы Менделеева равна 2 г/моль и тогда. Молекулярная масса численно равная молярной и представляет собой массу молекулы в атомных единицах, поэтому в дальнейшем мы совершили переход к молекулярной массе.
ρ = M r * ρ H 2 2
Вывод: плотность любого газа равна половине плотности водорода ( ρ Н 2 ) , взятого при тех же условиях, умноженной на относительную молекулярную массу этого газа M_r, то есть ρ = ρ Н 2 * M r 2 .
Рассмотрим несколько задач на законы, связанные с уравнение Клапейрона-Менделеева, то есть на изотермические, изохорные, изобарные процессы.
При уменьшении давления газа в 2,5 раза его объем увеличился на 12 л. Какой объем занимал газ в начальном состоянии, если температура на протяжении всего процесса оставалась постоянной?
По условию задачи температура в ходе всего процесса оставалась постоянной, откуда следует, что у нас изотермический процесс, и мы можем воспользоваться для решения законом Бойля-Мариотта.
p 1 V 1 = p 2 V 2 , г д е p 1 – давление газа в начальном состоянии (до расширения), V 1 — объем газа в начальном состоянии, p 2 = p 1 2 . 5 — давление газа в конечном состоянии (после расширения), V 2 = V 1 + ∆ V — объем газа в конечном состоянии.
Откуда можем найти начальный объем:
p 1 V 1 = p 1 2 . 5 ( V 1 + ∆ V ) = p 1 2 . 5 V 1 + p 1 2 . 5 ∆ V
V 1 ( p 1 — p 1 2 . 5 ) = p 1 2 . 5 ∆ V
p 1 2 . 5 V 1 ( 2 . 5 — 1 ) = p 1 2 . 5 ∆ V
V 1 = ∆ V 1 , 5 = 8 л
Ответ: первоначальный объем газа был равен 8 л.
Газ находится в баллоне при температуре 400 К. До какой температуры нужно нагреть газ, чтобы его давление увеличилось в 1,5 раза?
Так как нагревание газа по условиям данной задачи происходит при постоянном объеме, значит перед нами изохорный процесс.
При изохорном процессе:
p 1 T 1 = p 2 T 2
T 2 = p 2 T 1 p 1
p 2 p 1 = 1 . 5 T 2 = 1 . 5 * T 1 = 1 . 5 * 400 = 600 K
При 27°C объем газа равен 600 мл. Какой объем займет газ при 57°C, если давление будет оставаться постоянным?
Так как давление по условию остается постоянным, то можем использовать закон Гей-Люссака.
V 1 V 2 = T 1 T 2
V_2 – искомый объем
Для правильного расчета необходимо перевести температуры из Цельсий в Кельвины:
T 1 = 273 + 27 = 300 K
T 2 = 273 + 57 = 330 K
T 2 V 1 T 1 = V 2
V 2 = ( 600 * 330 ) / 300 = 660 м л
Газ в трубе плавильной печи охлаждается от температуры t 1 = 1150 ° С д о t 2 = 200 ° С . Во сколько раз увеличивается плотность газа при этом? Давление газа не меняется.
Так как по условию задания давления газа не изменяется, значит перед нами изобарный процесс. Для решения воспользуемся законом Гей-Люссака:
V 1 V 2 = T 1 T 2
Перейдем к абсолютной температуре:
T 1 = 1150 + 273 = 1423 K
T 2 = 200 + 273 = 473 K
Масса газа: m = ρ 1 V 1 = ρ 2 V 2
Использование этих формул приводит к следующему:
http://urok.1sept.ru/articles/534005
http://wika.tutoronline.ru/fizika/class/10/uravnenie-klapejronamendeleeva



 , вычислить абсолютную температуру воздуха в гофрированном сосуде (абсолютную температуру воздуха в кабинете физики).
, вычислить абсолютную температуру воздуха в гофрированном сосуде (абсолютную температуру воздуха в кабинете физики).
 до значения третьего десятичного знака и округлить до сотых долей.
до значения третьего десятичного знака и округлить до сотых долей. .
.