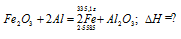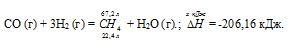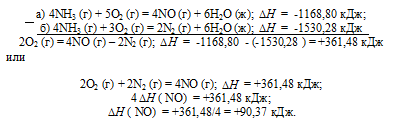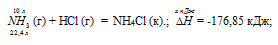КАК ВЫЧИСЛИТЬ ТЕПЛОВОЙ ЭФФЕКТ РЕАКЦИИ И СОСТАВИТЬ ЕЕ ТЕРМОХИМИЧЕСКОЕ УРАВНЕНИЕ
Вычислить тепловой эффект реакции важно для того, чтобы правильно организовать многие процессы на промышленных производствах. Это необходимо там, где используется подача энергии или где, наоборот, требуется ее отведение. Поскольку одни виды энергии могут превращаться в другие, то применение теплового эффекта химического взаимодействия позволяет превратить внутреннюю энергию веществ в работу (механическую, электрическую и т.д.).
С выделением или поглощением тепла идут процессы в живых организмах. Точный расчет тепловых эффектов превращения белков, жиров, углеводов и других веществ позволяет организовать правильную диету спортсменам, людям с теми или иными заболеваниями.
Содержание:
Что такое тепловой эффект химической реакции
Химические реакции практически всегда сопровождаются какими-либо тепловыми явлениями.
Так, горение, нейтрализация кислоты щелочью, реакция металла (например, магния) с хлором и т.д. происходят с выделением достаточного количества тепла. А вот, чтобы разложить мел (карбонат кальция), необходимо все время его нагревать. Если нагревание (то есть подвод тепла) прекратить, то и реакция тоже прекратится. Это говорит о том, что разложение карбоната кальция идет с поглощением тепла.
В чем же дело? Любое вещество является продуктом взаимодействия частиц (атомов или ионов). В ходе образования вещества энергия взаимодействия как бы прячется в химических связях (ковалентных, ионных). Это так называемая внутренняя энергия, которая частично высвобождается в ходе химического взаимодействия. Она же – тепловой эффект реакции. Измеряя его, можно судить о том, как изменилась внутренняя энергия вещества.
Тепловой эффект химической реакции обозначают буквой Q и измеряют в кДж (или в ккал в случае, когда речь идет об обеспечении энергией живых организмов).
Если в результате химического взаимодействия теплота выделяется, то это экзотермические реакции (+Q) ; если теплота поглощается – эндотермические (-Q) .
Как вычислить тепловой эффект реакции и
составить термохимическое уравнение
Взаимодействие веществ принято отражать (записывать) с помощью химического уравнения. Если в таком уравнении указан тепловой эффект, то тогда уравнение будет называться термохимическим .
Например, обычное уравнение реакции:
А это уже термохимическое уравнение данной реакции:
Уравнение говорит о том, что при взаимодействии 1 моля PbO с 1 молем СО, идущем с образованием 1 моля Pb и 1 моля CO2, выделяется 64 кДж теплоты.
Особенности термохимических уравнений:
1) указывается агрегатное состояние веществ (однако, если все вещества находятся в одном агрегатном состоянии, то его могут не указывать);
2) указывается тепловой эффект реакции в соответствии с ее стехиометрией (то есть, в соответствии с правильно расставленными коэффициентами);
3) тепловой эффект записывается в левой части уравнения;
4) если речь идет о горении вещества, то уравнение составляется по отношению к 1 молю этого вещества; тепловой эффект такой реакции называется теплотой сгорания:
5) если речь идет об образовании вещества, то уравнение также составляется по отношению к 1 молю этого вещества; тепловой эффект такой реакции будет называться теплотой образования:
А теперь разберем несколько задач, требованием которых является составление термохимического уравнения.
Что нужно сделать для решения таких задач?
1) записать условие задачи;
2) составить уравнение реакции;
3) вычислить ее тепловой эффект;
4) записать полученное значение теплового эффекта в уравнение реакции.
Пример 1. Кальций массой 8 г сгорает с выделением 127 кДж теплоты. Напишите термохимическое уравнение (тху) реакции.
Пример 2. При разложении 6,86 г оксида ртути (II) тратится 3,64 кДж тепловой энергии. Напишите термохимическое уравнение (тху) реакции.
Пример 3. Реакция 6 г углерода с водородом приводит к выделению 37,42 кДж теплоты. Напишите термохимическое уравнение (тху) реакции образования метана.
Расчеты по термохимическим уравнениям
В термохимических расчетах чаще используются уже готовые термохимические уравнения. Требуется найти массы/объемы образующихся/исходных веществ, количество выделившейся/поглощенной теплоты.
Рассмотрим несколько примеров.
Пример 4. По термохимическому уравнению: N2(г.) + O2(г.) = 2NO(г.) – 180,7 кДж вычислите тепловой эффект реакции, в которой участвует азот объемом 5,6 л (при н.у.).
Поскольку реакция эндотермическая, то поглотится 45,2 кДж энергии.
Пример 5. Тепловой эффект реакции горения этилена составляет 1400 кДж (в расчете на 1 моль этилена). Сколько этилена (при н.у.) необходимо сжечь, чтобы получить 560 кДж теплоты?
Пример 6. Пользуясь термохимическим уравнением сгорания пропана
определите количество выделившейся теплоты, если в реакцию вступит кислород: а) массой 16 г; б) объемом 67,2 л; в) количеством вещества 2,5 моль. Сколько оксида углерода (IV) по объему и по массе получится, если при горении пропана выделится 277,5 кДж теплоты?
Если вы готовитесь к выпускному экзамену ( ЕГЭ по химии ), то имейте ввиду, что вычислить тепловой эффект реакции требует задание № 27 (версия 2022 года ).
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Пожалуйста, оцените публикацию 
Как рассчитать количество теплоты, тепловой эффект и теплоту образования
Количество теплоты
Задание 81.
Вычислите количество теплоты, которое выделится при восстановлении Fe2O3 металлическим алюминием, если было получено 335,1 г железа. Ответ: 2543,1 кДж.
Решение:
Уравнение реакции:
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Рассчитаем тепловой эффект реакции, используя следствие из закона Гесса, получим:



Вычисление количества теплоты, которое выделяется при получении 335,1 г железа, про-изводим из пропорции:
(2 . 55,85) : -847,7 = 335,1 : х; х = (0847,7 . 335,1)/ (2 . 55,85) = 2543,1 кДж,
где 55,85 атомная масс железа.
Ответ: 2543,1 кДж.
Тепловой эффект реакции
Задание 82.
Газообразный этиловый спирт С2Н5ОН можно получить при взаимодействии этилена С2Н4 (г) и водяных паров. Напишите термохимическое уравнение этой реакции, предварительно вычислив ее тепловой эффект. Ответ: -45,76 кДж.
Решение:
Уравнение реакции имеет вид:
С2Н4 (г) + Н2О (г) = С2Н5ОН (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Рассчитаем тепловой эффект реакции, используя следствие из закона Гесса, получим:




= -235,1 -[(52,28) + (-241,83)] = — 45,76 кДж
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 

Если в результате реакции выделяется теплота, то
Ответ: — 45,76 кДж.
Задание 83.
Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений:
Решение:
Уравнение реакции восстановления оксида железа (II) водородом имеет вид:
ЕеО (к) + Н2 (г) = Fe (к) + Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:



Теплота образования воды определяется уравнением
а теплоту образования оксида железа (II) можно вычислить, если из уравнения (б) вычесть уравнение (а).




Ответ: +27,99 кДж.
Задание 84.
При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерод СS2 (г). Напишите термохимическое уравнение этой реакции, предварительно вычислите ее тепловой эффект. Ответ: +65,43 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы . Значение приводят обычно в правой части уравнения, отделяя его запятой или точкой c запятой. Приняты следующие сокращенные обозначения агрегатного состояния вещества: г — газообразное, ж — жидкое, к —- кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно, например, О2, Н2 и др.
Уравнение реакции имеет вид:
2H2S (г) + CO2 (г) = 2Н2О (г) + СS2 (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:






Термохимическое уравнение будет иметь вид:
2H2S (г) + CO2 (г) = 2Н2О (г) + СS2 (г); 
Ответ: +65,43 кДж.
Tермохимическое уравнение реакции
Задание 85.
Напишите термохимическое уравнение реакции между СО (г) и водородом, в результате которой образуются СН4 (г) и Н2О (г). Сколько теплоты выделится при этой реакции, если было получено 67,2 л метана в пересчете на нормальные условия? Ответ: 618,48 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы . Значение приводят обычно в правой части уравнения, отделяя его запятой или точкой c запятой. Приняты следующие сокращенные обозначения агрегатного состояния вещества: г — газообразное, ж — кое, к — кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно, например, О2, Н2 и др.
Уравнение реакции имеет вид:
СО (г) + 3Н2 (г) = СН4 (г) + Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:





Термохимическое уравнение будет иметь вид:
22,4 : -206,16 = 67,2 : х; х = 67,2 (-206,16)/22?4 = -618,48 кДж; Q = 618,48 кДж.
Ответ: 618,48 кДж.
Теплота образования
Задание 86.
Тепловой эффект какой реакции равен теплоте образования. Вычислите теплоту образования NO, исходя из следующих термохимических уравнений:
а) 4NH3 (г) + 5О2 (г) = 4NO (г) + 6Н2O (ж); 
б) 4NH3 (г) + 3О2 (г) = 2N2 (г) + 6Н2O (ж); 
Ответ: 90,37 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование NO из простых веществ можно представить так:
Дана реакция (а), в которой образуется 4 моль NO и дана реакция (б), в которой образуется 2 моль N2. В обеих реакциях участвует кислород. Следовательно, для определения стандартной теплоты образования NO составим следующий цикл Гесса, т. е. нужно вычесть уравнение (а) из уравнения (б):
Таким образом, 1/2N2 + 1/2O2 = NO; 
Ответ: 618,48 кДж.
Задание 87.
Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлороводорода. Напишите термохимическое уравнение этой реакции, предварительно вычислив ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 л аммиака в пересчете на нормальные условия? Ответ: 78,97 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы . Значение приводят обычно в правой части уравнения, отделяя его запятой или точкой c запятой. Приняты следующие кое, к —- кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно, например, О2, Н2 и др.
Уравнение реакции имеет вид:
NH3 (г) + НCl (г) = NH4Cl (к).; 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствиие из закона Гесса:





Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при реакции 10 л аммиака по этой реакции, определим из про-порции:
22,4 : -176,85 = 10 : х; х = 10 (-176,85)/22,4 = -78,97 кДж; Q = 78,97 кДж.
Энергетика химических процессов. Закон Гесса
Материалы портала onx.distant.ru
Тепловой эффект процесса
Количество выделенной (или поглощенной) теплоты Q в данном процессе называют тепловым эффектом процесса. Экзотермической является реакция, протекающая с выделением теплоты, а эндотермической – с поглощением теплоты из окружающей среды.
Для лабораторных и промышленных процессов наиболее типичен изобарный режим (Р=const). Поэтому обычно рассматривают тепловой эффект при Р,Т = const, т.е. изменение энтальпии процесса ΔН.
Следует отметить, что абсолютные значения энтальпии Н определить не представляется возможным, так как не известна абсолютная величина внутренней энергии.
Для экзотермической реакции (Q > 0) ΔН 0.
Термохимические уравнения
Химические уравнения, в которых дополнительно указывается величина изменения энтальпии реакции, а также агрегатное состояние веществ и температура, называются термохимическими уравнениями.
В термохимических уравнениях отмечают фазовое состояние и аллотропные модификации реагентов и образующихся веществ: г – газообразное, ж – жидкое, к – кристаллическое; S(ромб), S(монокл), С(графит), С(алмаз) и т.д.
Важно подчеркнуть, что с термохимическими уравнениями можно проводить алгебраические операции сложения, вычитания, деления, умножения.
Закон Гесса
Изменение энтальпии (внутренней энергии) химической реакции зависит от вида, состояния и количества исходных веществ и продуктов реакции, но не зависит от пути процесса.
Следствия из закона Гесса
- Изменение энтальпии реакции равно сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ (суммирование проводится с учетом стехиометрических коэффициентов).
- Изменение энтальпии реакции равно сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции (суммирование проводится с учетом стехиометрических коэффициентов).
Стандартные термодинамические величины
Стандартные термодинамические величины – это такие величины, которые относятся к процессам, все ингредиенты которых находятся в стандартных состояниях.
Стандартным состоянием вещества, находящегося в конденсированной фазе (кристаллической или жидкой), является реальное состояние вещества, находящегося при данной температуре и давлении 1 атм.
Следует подчеркнуть, что стандартное состояние может иметь место при любой температуре.
Обычно тепловой эффект (изменение энтальпии) реакции приводится для температуры 25 о С (298,15 К) и давления 101,325 кПа (1 атм), т.е. указывается стандартная энтальпия ΔН о 298.
Стандартные энтальпии образования и сгорания
Стандартная энтальпия образования ΔН о f,298 (или ΔН о обр,298) – это изменение энтальпии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества присутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Например , ΔН o f,298(Н2О(ж)) = — 285,83 кДж/моль соответствует изменению энтальпии в процессе
при Т = 298,15 К и Р = 1 атм.
Стандартная энтальпия образования простых веществ равна нулю по определению (для наиболее устойчивых их модификаций при данной температуре).
Стандартной энтальпией сгорания ΔН o сгор,298 называют энтальпию сгорания вещества (обычно 1 моль), находящегося в стандартном состоянии с образованием СО2(г), Н2О(ж) и других веществ, состав которых должен быть специально указан. Все продукты сгорания также должны находиться в стандартном состоянии.
Примеры решения задач
Задача 1. Используя справочные термодинамические данные вычислить ΔН o 298 реакции:
Решение. Решим задачу, используя оба следствия из закона Гесса. Ниже для исходных веществ и продуктов реакции приведены значения энтальпий образования и сгорания в кДж/моль (энтальпия сгорания сероводорода до SO2(г) и H2O(ж)):
| Вещество | H2S(г) | O2(г) | SO2(г) | H2O(ж) |
| ΔН o f,298 | -20,60 | 0 | -296,90 | -285,83 |
| ΔН o сгор,298 | -562,10 | 0 | 0 | 0 |
Cогласно первому следствию закона Гесса энтальпия этой реакции ΔН о х.р. равна:
В соответствии со вторым следствием закона Гесса получаем:
ΔН о х.р.,298 = 2ΔН о сгор,298(H2S(г)) = 2(-562,10) = — 1124,20 кДж.
Задача 2. Вычислите ΔН о 298 реакции N2(г) + 3H2(г) = 2NH3(г), используя следующие данные:
Определите стандартную энтальпию образования NH3(г).
Решение. Поскольку с термохимическими уравнениями можно производить все алгебраические действия, то искомое уравнение получится, если:
- разделить на два тепловой эффект первого уравнения и изменить его знак на противоположный, т.е:
- умножить на 3/2 второе уравнение и соответствующую ему величину δН o , изменив ее знак на противоположный:
Таким образом, тепловой эффект реакции N2(г) + 3H2(г) = 2NH3(г) равен:
Δ Н о 298 = (- ΔН о 1/2) + (- 3/2·ΔН о 2) = 765,61 + (- 857,49) = — 91,88 кДж.
Поскольку в рассматриваемой реакции образуется 2 моль NH3(г), то
ΔН о f,298(NH3(г)) = — 91,88/2 = — 45,94 кДж/моль.
Задача 3. Определите энтальпию процесса
если при 298,15 К энтальпия растворения CuSO4(к) в n моль Н2О с образованием раствора CuSO4(р-р, nH2O) равна –40, а энтальпия растворения CuSO4·5H2O(к) с образованием раствора той же концентрации равна +10,5 кДж/моль.
Решение. Составляем цикл Гесса:
ΔН о 1 = ΔН о 2 + ΔН о х (по закону Гесса). Отсюда получаем:
ΔН о х = ΔН о 1 – ΔН о 2 = – 40,0 – 10,5 = -50,5 кДж.
Другой вариант решения.
По закону Гесса: ΔН о 1 = ΔН о х+ ΔН о 3, т.е. при сложении уравнений (2) и (3) получим уравнение (1).
Задача 4. Вычислите энтальпию образования химической связи С= С в молекуле этилена, если его стандартная энтальпия образования равна 52,3 кДж/моль, энтальпия возгонки графита составляет 716,7 кДж/моль, энтальпия атомизации водорода равна +436,0 кДж/моль, энтальпия образования связи С–Н равна –414,0 кДж/моль.
Решение. Составляем цикл Гесса:
ΔН о (С = С) = 52,3 — 2·716,7 — 2·436,0 + 4·414,0 = — 597,1 кДж/моль.
Задачи для самостоятельного решения
1. Составьте уравнение реакции, для которой ΔН о соответствует стандартной энтальпии образования ВaCl2·2H2O(к).
http://buzani.ru/zadachi/khimiya-shimanovich/912kolichestvo-teploty-teplovoj-effekt
http://chemege.ru/energy-zakon-gessa/