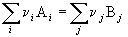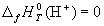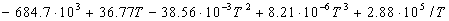КАК ВЫЧИСЛИТЬ ТЕПЛОВОЙ ЭФФЕКТ РЕАКЦИИ И СОСТАВИТЬ ЕЕ ТЕРМОХИМИЧЕСКОЕ УРАВНЕНИЕ
Вычислить тепловой эффект реакции важно для того, чтобы правильно организовать многие процессы на промышленных производствах. Это необходимо там, где используется подача энергии или где, наоборот, требуется ее отведение. Поскольку одни виды энергии могут превращаться в другие, то применение теплового эффекта химического взаимодействия позволяет превратить внутреннюю энергию веществ в работу (механическую, электрическую и т.д.).
С выделением или поглощением тепла идут процессы в живых организмах. Точный расчет тепловых эффектов превращения белков, жиров, углеводов и других веществ позволяет организовать правильную диету спортсменам, людям с теми или иными заболеваниями.
Содержание:
Что такое тепловой эффект химической реакции
Химические реакции практически всегда сопровождаются какими-либо тепловыми явлениями.
Так, горение, нейтрализация кислоты щелочью, реакция металла (например, магния) с хлором и т.д. происходят с выделением достаточного количества тепла. А вот, чтобы разложить мел (карбонат кальция), необходимо все время его нагревать. Если нагревание (то есть подвод тепла) прекратить, то и реакция тоже прекратится. Это говорит о том, что разложение карбоната кальция идет с поглощением тепла.
В чем же дело? Любое вещество является продуктом взаимодействия частиц (атомов или ионов). В ходе образования вещества энергия взаимодействия как бы прячется в химических связях (ковалентных, ионных). Это так называемая внутренняя энергия, которая частично высвобождается в ходе химического взаимодействия. Она же – тепловой эффект реакции. Измеряя его, можно судить о том, как изменилась внутренняя энергия вещества.
Тепловой эффект химической реакции обозначают буквой Q и измеряют в кДж (или в ккал в случае, когда речь идет об обеспечении энергией живых организмов).
Если в результате химического взаимодействия теплота выделяется, то это экзотермические реакции (+Q) ; если теплота поглощается – эндотермические (-Q) .
Как вычислить тепловой эффект реакции и
составить термохимическое уравнение
Взаимодействие веществ принято отражать (записывать) с помощью химического уравнения. Если в таком уравнении указан тепловой эффект, то тогда уравнение будет называться термохимическим .
Например, обычное уравнение реакции:
А это уже термохимическое уравнение данной реакции:
Уравнение говорит о том, что при взаимодействии 1 моля PbO с 1 молем СО, идущем с образованием 1 моля Pb и 1 моля CO2, выделяется 64 кДж теплоты.
Особенности термохимических уравнений:
1) указывается агрегатное состояние веществ (однако, если все вещества находятся в одном агрегатном состоянии, то его могут не указывать);
2) указывается тепловой эффект реакции в соответствии с ее стехиометрией (то есть, в соответствии с правильно расставленными коэффициентами);
3) тепловой эффект записывается в левой части уравнения;
4) если речь идет о горении вещества, то уравнение составляется по отношению к 1 молю этого вещества; тепловой эффект такой реакции называется теплотой сгорания:
5) если речь идет об образовании вещества, то уравнение также составляется по отношению к 1 молю этого вещества; тепловой эффект такой реакции будет называться теплотой образования:
А теперь разберем несколько задач, требованием которых является составление термохимического уравнения.
Что нужно сделать для решения таких задач?
1) записать условие задачи;
2) составить уравнение реакции;
3) вычислить ее тепловой эффект;
4) записать полученное значение теплового эффекта в уравнение реакции.
Пример 1. Кальций массой 8 г сгорает с выделением 127 кДж теплоты. Напишите термохимическое уравнение (тху) реакции.
Пример 2. При разложении 6,86 г оксида ртути (II) тратится 3,64 кДж тепловой энергии. Напишите термохимическое уравнение (тху) реакции.
Пример 3. Реакция 6 г углерода с водородом приводит к выделению 37,42 кДж теплоты. Напишите термохимическое уравнение (тху) реакции образования метана.
Расчеты по термохимическим уравнениям
В термохимических расчетах чаще используются уже готовые термохимические уравнения. Требуется найти массы/объемы образующихся/исходных веществ, количество выделившейся/поглощенной теплоты.
Рассмотрим несколько примеров.
Пример 4. По термохимическому уравнению: N2(г.) + O2(г.) = 2NO(г.) – 180,7 кДж вычислите тепловой эффект реакции, в которой участвует азот объемом 5,6 л (при н.у.).
Поскольку реакция эндотермическая, то поглотится 45,2 кДж энергии.
Пример 5. Тепловой эффект реакции горения этилена составляет 1400 кДж (в расчете на 1 моль этилена). Сколько этилена (при н.у.) необходимо сжечь, чтобы получить 560 кДж теплоты?
Пример 6. Пользуясь термохимическим уравнением сгорания пропана
определите количество выделившейся теплоты, если в реакцию вступит кислород: а) массой 16 г; б) объемом 67,2 л; в) количеством вещества 2,5 моль. Сколько оксида углерода (IV) по объему и по массе получится, если при горении пропана выделится 277,5 кДж теплоты?
Если вы готовитесь к выпускному экзамену ( ЕГЭ по химии ), то имейте ввиду, что вычислить тепловой эффект реакции требует задание № 27 (версия 2022 года ).
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Пожалуйста, оцените публикацию 
Тепловой эффект химической реакции. Термохимические уравнения
Тепловой эффект химической реакции. Термохимические уравнения.
Химические реакции протекают либо с выделением теплоты, либо с поглощением теплоты.
Экзотермические реакции протекают с выделением теплоты (теплота указывается со знаком «+»). Эндотермические реакции – с поглощением теплоты (теплота Q указывается со знаком «–»).
Тепловой эффект химической реакции – это изменение внутренней энергии системы вследствие протекания химической реакции и превращения исходных веществ (реагентов) в продукты реакции в количествах, соответствующих уравнению химической реакции.
При протекании химических реакций наблюдаются некоторые закономерности, которые позволяют определить знак теплового эффекта химической реакции:
- Реакции, которые протекают самопроизвольно при обыных условиях, скорее всего экзотермические. Для запуска экзотермических реакций может потребоваться инициация – нагревание и др.
Например, после поджигания горение угля протекает самопроизвольно, реакция экзотермическая:
- Реакции образования устойчивых веществ из простых веществ экзотермические, реакции разложения чаще всего – эндотермические.
Например, разложение нитрата калия сопровождается поглощением теплоты:
- Реакции, в ходе которых из менее устойчивых веществ образуются более устойчивые, чаще всего экзотермические. И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты. Устойчивость можно примерно определить по активности и стабильности вещества при обычных условиях. Как правило, в быту нас окружают вещества сравнительно устойчивые.
Например, горение амиака (взаимодействие активных, неустойчивых веществ — аммиака и кислорода) приводит к образованию устойчивых веществ – азота и воды. Следовательно, реакция экзотермическая:
Количество теплоты обозначают буквой Q, измеряют в кДж (килоджоулях) или Дж (джоулях).
Количество теплоты, выделяющейся в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
В термохимии используются термохимические уравнения . Это уравнение реакции с указанием количества теплоты, выделившейся в ней (на число моль вещества, равное коэффициентам в уравнении).
Например, рассмотрим термохимическое уравнение сгорания водорода:
Из термохимического уравнения видно, что 484 кДж теплоты выделяются при сгорании 2 моль водорода, 1 моль кислорода. Также можно сказать, что при образовании 2 моль воды выделяется 484 кДж теплоты.
Теплота образования вещества – количество теплоты, выделяющееся при образовании 1 моль данного вещества из простых веществ.
Например, при сгорании алюминия:
теплота образования оксида алюминия равна 1675 кДж/моль. Если мы запишем термохимическое уравнение без дробных коэффициентов:
теплота образования Al2O3 все равно будет равна 1675 кДж/моль, т.к. в термохъимическом уравнении приведен тепловой эффект образования 2 моль оксида алюминия.
Теплота сгорания – количество теплоты, выделяющееся при горении 1 моль данного вещества.
Например, при горении метана:
теплота сгорания метана равна 802 кДж/моль.
Разберемся, как решать задачи на термохимические уравнения (задачи на термохимию) из ЕГЭ. Для этого разберем несколько примеров термохимических задач.
1. В результате реакции, термохимическое уравнение которой:
получено 98 л (н.у.) оксида азота (II). Определите количество теплоты, которое затратили при этом (в кДж). (Запишите число с точностью до целых.).
Решение.
Из термохимического уравнения видно, что на образование 2 моль оксида азота (II) потребуется 180 кДж теплоты. 2 моль оксида азота при н.у. занимают объем 44,8 л. Составляем простую пропорцию:
на получение 44,8 л оксида азота (II) затрачено 180 кДж теплоты,
на получение 98 л оксида азота затрачено х кДж теплоты.
Отсюда х= 180*98/44,8 = 393,75 кДж. Округляем ответ до целых, как требуется в условии: Q=394 кДж.
Ответ: потребуется 394 кДж теплоты.
2. В результате реакции, термохимическое уравнение которой
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
Решение.
Из термохимического уравнения видно, что при образовании 2 моль воды выделится 484 кДж теплоты. Масса 2 моль воды равна 36 г. Составляем простую пропорцию:
при образовании 36 г воды выделится 484 кДж теплоты,
при образовании х г воды выделится 1452 кДж теплоты.
Отсюда х= 1452*36/484 = 108 г.
Ответ: образуется 108 г воды.
3. В результате реакции, термохимическое уравнение которой
израсходовано 80 г серы. Определите количество теплоты, которое выделится при этом (в кДж). (Запишите число с точностью до целых).
Решение.
Из термохимического уравнения видно, что при сгорании 1 моль серы выделится 296 кДж теплоты. Масса 1 моль серы равна 32 г. Составляем простую пропорцию:
при сгорании 32 г серы выделится 296 кДж теплоты,
при сгорании 80 г серы выделится х кДж теплоты.
Отсюда х= 80*296/32 = 740 кДж.
Ответ: выделится 740 кДж теплоты.
Как рассчитать тепловой эффект реакции по уравнению
Термохимия изучает тепловые эффекты химических реакций. Во многих случаях эти реакции протекают при постоянном объеме или постоянном давлении. Из первого закона термодинамики следует, что при этих условиях теплота является функцией состояния. При постоянном объеме теплота равна изменению внутренней энергии:
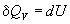
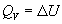
а при постоянном давлении — изменению энтальпии:
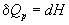
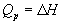
Эти равенства в применении к химическим реакциям составляют суть закона Гесса:
Тепловой эффект химической реакции, протекающей при постоянном давлении или постоянном объеме, не зависит от пути реакции, а определяется только состоянием реагентов и продуктов реакции.
Другими словами, тепловой эффект химической реакции равен изменению функции состояния.
В термохимии, в отличие от других приложений термодинамики, теплота считается положительной, если она выделяется в окружающую среду, т.е. если H . RT, (3.4)
где n — изменение числа молей газов в реакции.
Для того, чтобы облегчить сравнение энтальпий различных реакций, используют понятие «стандартного состояния». Стандартное состояние — это состояние чистого вещества при давлении 1 бар (= 10 5 Па) и заданной температуре. Для газов — это гипотетическое состояние при давлении 1 бар, обладающее свойствами бесконечно разреженного газа. Энтальпию реакции между веществами, находящимися в стандартных состояниях при температуре T, обозначают 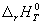
Из закона Гесса вытекают важные следствия, которые позволяют рассчитывать энтальпии химических реакций.
Следствие 1. Стандартная энтальпия химической реакции
равна разности стандартных энтальпий образования продуктов реакции и реагентов (с учетом стехиометрических коэффициентов):
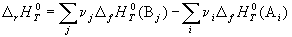
Стандартной энтальпией (теплотой) образования вещества 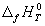
Понятия «энтальпия образования» используют не только для обычных веществ, но и для ионов в растворе. При этом за точку отсчета принят ион H + , для которого стандартная энтальпия образования в водном растворе полагается равной нулю:
Следствие 2. Стандартная энтальпия химической реакции
равна разности энтальпий сгорания реагентов и продуктов реакции (с учетом стехиометрических коэффициентов):
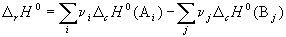
(c означает «combustion»). Стандартной энтальпией (теплотой) сгорания вещества называют энтальпию реакции полного окисления одного моля вещества. Это следствие обычно используют для расчета тепловых эффектов органических реакций.
Следствие 3. Энтальпия химической реакции равна разности энергий разрываемых и образующихся химических связей.
Энергией связи A- B называют энергию, необходимую для разрыва связи и разведения образующихся частиц на бесконечное расстояние:
AB(г) A(г) + B(г).
Энергия связи всегда положительна.
Большинство термохимических данных в справочниках приведено при температуре 298 К. Для расчета тепловых эффектов при других температурах используют уравнение Кирхгофа:
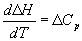
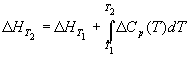
где Cp — разность изобарных теплоемкостей продуктов реакции и исходных веществ. Если разница T2 — T1 невелика, то можно принять Cp = const. При большой разнице температур необходимо использовать температурную зависимость Cp(T) типа:
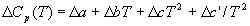
где коэффициенты a, b, c и т.д. для отдельных веществ берут из справочника, а знак обозначает разность между продуктами и реагентами (с учетом коэффициентов).
ПРИМЕРЫ
Пример 3-1. Стандартные энтальпии образования жидкой и газообразной воды при 298 К равны -285.8 и -241.8 кДж/моль, соответственно. Рассчитайте энтальпию испарения воды при этой температуре.
Решение. Энтальпии образования соответствуют следующим реакциям:
H2(г) + ЅO2(г) = H2O(ж), H1 0 = -285.8;
H2(г) + ЅO2(г) = H2O(г), H2 0 = -241.8.
Вторую реакцию можно провести в две стадии: сначала сжечь водород с образованием жидкой воды по первой реакции, а затем испарить воду:
H2O(ж) = H2O(г), H 0 исп = ?
Тогда, согласно закону Гесса,
H1 0 + H 0 исп = H2 0 ,
откуда H 0 исп = -241.8 — (-285.8) = 44.0 кДж/моль.
Ответ. 44.0 кДж/моль.
Пример 3-2. Рассчитайте энтальпию реакции
а) по энтальпиям образования; б) по энергиям связи, в предположении, что двойные связи в молекуле C6H6 фиксированы.
Решение. а) Энтальпии образования (в кДж/моль) находим в справочнике (например, P.W.Atkins, Physical Chemistry, 5th edition, pp. C9-C15): fH 0 (C6H6(г)) = 82.93, fH 0 (C(г)) = 716.68, fH 0 (H(г)) = 217.97. Энтальпия реакции равна:
rH 0 = 82.93 — 6 716.68 — 6 217.97 = -5525 кДж/моль.
б) В данной реакции химические связи не разрываются, а только образуются. В приближении фиксированных двойных связей молекула C6H6 содержит 6 связей C- H, 3 связи C- C и 3 связи C=C. Энергии связей (в кДж/моль) (P.W.Atkins, Physical Chemistry, 5th edition, p. C7): E(C- H) = 412, E(C- C) = 348, E(C=C) = 612. Энтальпия реакции равна:
rH 0 = -(6 412 + 3 348 + 3 612) = -5352 кДж/моль.
Разница с точным результатом -5525 кДж/моль обусловлена тем, что в молекуле бензола нет одинарных связей C- C и двойных связей C=C, а есть 6 ароматических связей C C.
Ответ. а) -5525 кДж/моль; б) -5352 кДж/моль.
Пример 3-3. Пользуясь справочными данными, рассчитайте энтальпию реакции
Решение. Сокращенное ионное уравнение реакции имеет вид:
По закону Гесса, энтальпия реакции равна:
rH 0 = 4 fH 0 (H2O(ж)) + 2 fH 0 (NO(г)) + 3 fH 0 (Cu 2+ (aq)) — 2 fH 0 (NO3 — (aq))
(энтальпии образования меди и иона H + равны, по определению, 0). Подставляя значения энтальпий образования (P.W.Atkins, Physical Chemistry, 5th edition, pp. C9-C15), находим:
rH 0 = 4 (-285.8) + 2 90.25 + 3 64.77 — 2 (-205.0) = -358.4 кДж
(в расчете на три моля меди).
Пример 3-4. Рассчитайте энтальпию сгорания метана при 1000 К, если даны энтальпии образования при 298 К: fH 0 (CH4) = -17.9 ккал/моль, fH 0 (CO2) = -94.1 ккал/моль, fH 0 (H2O(г)) = -57.8 ккал/моль. Теплоемкости газов (в кал/(моль . К)) в интервале от 298 до 1000 К равны:
Решение. Энтальпия реакции сгорания метана
при 298 К равна:
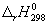
Найдем разность теплоемкостей как функцию температуры:
Cp = Cp(CO2) + 2 Cp(H2O(г)) — Cp(CH4) — 2 Cp(O2) =
= 5.16 — 0.0094T (кал/(моль . К)).
Энтальпию реакции при 1000 К рассчитаем по уравнению Кирхгофа:
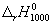
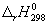
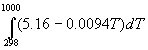
(1000-298) — 0.0094 (1000 2 -298 2 )/2 = -192500 кал/моль.
Ответ. -192.5 ккал/моль.
ЗАДАЧИ
3-1. Сколько тепла потребуется на перевод 500 г Al (т.пл. 658 о С, H 0 пл = 92.4 кал/г), взятого при комнатной температуре, в расплавленное состояние, если Cp(Alтв) = 0.183 + 1.096 10 -4 T кал/(г К)?
3-2. Стандартная энтальпия реакции CaCO3(тв) = CaO(тв) + CO2(г), протекающей в открытом сосуде при температуре 1000 К, равна 169 кДж/моль. Чему равна теплота этой реакции, протекающей при той же температуре, но в закрытом сосуде?
3-3. Рассчитайте стандартную внутреннюю энергию образования жидкого бензола при 298 К, если стандартная энтальпия его образования равна 49.0 кДж/моль.
3-4. Рассчитайте энтальпию образования N2O5(г) при T = 298 К на основании следующих данных:
2NO(г) + O2(г) = 2NO2(г), H1 0 = -114.2 кДж/моль,
4NO2(г) + O2(г) = 2N2O5(г), H2 0 = -110.2 кДж/моль,
N2(г) + O2(г) = 2NO(г), H3 0 = 182.6 кДж/моль.
3-5. Энтальпии сгорания -глюкозы, -фруктозы и сахарозы при 25 о С равны -2802,
-2810 и -5644 кДж/моль, соответственно. Рассчитайте теплоту гидролиза сахарозы.
3-6. Определите энтальпию образования диборана B2H6(г) при T = 298 К из следующих данных:
B2H6(г) + 3O2(г) = B2O3(тв) + 3H2O(г), H1 0 = -2035.6 кДж/моль,
2B(тв) + 3/2 O2(г) = B2O3(тв), H2 0 = -1273.5 кДж/моль,
H2(г) + 1/2 O2(г) = H2O(г), H3 0 = -241.8 кДж/моль.
3-7. Рассчитайте теплоту образования сульфата цинка из простых веществ при T = 298 К на основании следующих данных:
ZnS = Zn + S, H1 0 = 200.5 кДж/моль,
2ZnS + 3O2 = 2ZnO + 2SO2, H2 0 = -893.5 кДж,
2SO2 + O2 = 2SO3, H3 0 = -198.2 кДж/моль,
ZnSO4 = ZnO + SO3, H4 0 = 235.0 кДж/моль.
3-8. Найдите rH 0 298 для реакции
если известны теплоты сгорания метана ( cH 0 (CH4) = -890.6 кДж/моль), хлорметана ( cH 0 (CH3Cl) = -689.8 кДж/моль), водорода ( cH 0 (H2) = -285.8 кДж/моль) и теплота образования HCl ( fH 0 (HCl) = -92.3 кДж/моль)).
3-9. Рассчитайте тепловой эффект реакции
при T = 298 K, если известны следующие данные:
H2O(г) = H2O(ж), H1 0 = -44 кДж/моль,
1/2N2 + 3/2H2 = NH3, H2 0 = -46.2 кДж/моль,
H2 + 1/2O2 = H2O(ж), H3 0 = -285.8 кДж/моль,
NO = 1/2N2 + 1/2O2, H4 0 = -91.3 кДж/моль.
3-10. При взаимодействии 10 г металлического натрия с водой rH298 = -79.91 кДж, а при взаимодействии 20 г оксида натрия с водой rH298 = -76.76 кДж. Вода берется в большом избытке. Рассчитайте теплоту образования оксида натрия fH 0 298(Na2O), если fH 0 298(H2Oж) = -285.8 кДж/моль.
3-11. Энергия связи в молекуле H2 равна 432.1 кДж/моль, а энергия связи в молекуле N2 равна 945.3 кДж/моль. Какова энтальпия атомизации аммиака, если энтальпия образования аммиака равна -46.2 кДж/моль?
3-12. Рассчитайте стандартный тепловой эффект реакции нейтрализации
NaOH + HCl = NaCl + H2O,
протекающей в водном растворе при 298 К.
3-13. Рассчитайте стандартный тепловой эффект реакции
3-14. Напишите уравнение Кирхгофа для реакции, протекающей при постоянном объеме.
3-15. Зависимость теплового эффекта реакции CH3OH(г) + 3/2O2 = CO2 + 2H2O(г) от температуры выражается уравнением:
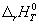
Рассчитайте изменение теплоемкости Cp для этой реакции при 500 К.
3-16. Стандартная энтальпия образования Al2O3(тв) при 298 К равна -1675 кДж/моль. Рассчитайте стандартную энтальпию образования Al2O3(тв) при 800 К, если даны мольные теплоемкости (в Дж/(моль . К)):
3-17. Энтальпия диссоциации карбоната кальция при 900 о С и давлении 1 атм равна 178 кДж/моль. Выведите уравнение зависимости энтальпии реакции от температуры и рассчитайте количество теплоты, поглощенное при разложении 1 кг карбоната кальция при 1000 о С и 1 атм, если даны мольные теплоемкости (в Дж/(моль . К)):


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
http://chemege.ru/termochemistry/
http://www.chem.msu.su/rus/teaching/eremin1/1-3.html