Теория электролитической диссоциации
Темы кодификатора ЕГЭ: Электролитическая диссоциация электролитов вводных растворах. Сильные и слабые электролиты.
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
Поместим в пробирку несколько кристаллов хлорида натрия и добавим воду. Через некоторое время кристаллы растворятся. Что произошло?
Хлорид натрия – вещество с ионной кристаллической решеткой. Кристалл NaCl состоит из ионов Na + и Cl — . В воде этот кристалл распадается на структурные единицы-ионы. При этом распадаются ионные химические связи и некоторые водородные связи между молекулами воды. Попавшие в воду ионы Na + и Cl — вступают во взаимодействие с молекулами воды. В случае хлорид-ионов можно говорить про электростатическое притяжение дипольных (полярных) молекул воды к аниону хлора, а в случае катионов натрия оно приближается по своей природе к донорно-акцепторному (когда электронная пара атома кислорода помещается на вакантные орбитали иона натрия). Окруженные молекулами воды ионы покрываются гидратной оболочкой. Диссоциация хлорида натрия описывается уравнением:
NaCl = Na + + Cl –
При растворении в воде соединений с ковалентной полярной связью, молекулы воды, окружив полярную молекулу, сначала растягивают связь в ней, увеличивая её полярность, затем разрывают её на ионы, которые гидратируются и равномерно распределяются в растворе. Например, соляная ксилота диссоциирует на ионы так: HCl = H + + Cl — .
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
Nпродисс — это число продиссоциировавших молекул,
Nисх — это исходное число молекул.
По степени диссоциации электролиты делят на делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α
1. Слабые кислоты, в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH4OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).
Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).
Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты.
Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na + и PO4 3– :
Диссоциация слабых электролитов : многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
HCO3 – ↔ H + + CO3 2–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH –
Mg(OH) + ⇄ Mg 2+ + OH –
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K + + HCO3 – (α=1)
HCO3 – ⇄ H + + CO3 2– (α + + Cl – (α=1)
MgOH + ⇄ Mg 2+ + OH – (α 1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.
3. Под действием внешнего электрического поля положительно заряженные ионы двигаюися к положительно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к отрицательному электроду – аноду. Их называют анионами.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.
Примеры .
1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3
Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе:
а) K2S ⇄ 2K + + S 2– , при полном распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не получится никак;
б) Ba(ClO3)2 ⇄ Ba 2+ + 2ClO3 – , опять при распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не образуется никак;
в) NH4NO3 ⇄ NH4 + + NO3 – , при распаде 1 моль нитрата аммония образуется 2 моль ионов максимально, больше 2 моль ионов не образуется никак;
г) Fe(NO3)3 ⇄ Fe 3+ + 3NO3 – , при полном распаде 1 моль нитрата железа (III) образуется 4 моль ионов. Следовательно, при неполном распаде 1 моль нитрата железа возможно образование меньшего числа ионов (неполный распад возможен в насыщенном растворе соли). Следовательно, вариант 4 нам подходит.
Теория электролитической диссоциации
О чем эта статья:
Что такое электролитическая диссоциация
Как известно, электрический ток — это направленное движение свободных электронов или ионов, т. е. заряженных частиц. В растворах электролитов, проводящих ток, за это отвечают свободные ионы.
В 1882 году шведский химик С. Аррениус при изучении свойств растворов электролитов обратил внимание, что они содержат больше частиц, чем было в сухом веществе. Например, в растворе хлорида натрия 2 моля частиц, а NaCl в сухом виде содержит лишь 1 моль.
Это позволило ученому сделать вывод, что при растворении таких веществ в воде в них появляются свободные ионы. Так были заложены основы теории электролитической диссоциации (ТЭД) — в химии она стала одним из важнейших открытий.
Электролитическая диссоциация — это процесс, в ходе которого молекулы электролитов взаимодействуют с водой или другим растворителем и распадаются на ионы. Она может иметь обратимый или необратимый характер. Обратный процесс называется моляризацией.
Благодаря диссоциации растворы электролитов обретают способность проводить ток. Сванте Аррениус не смог объяснить, почему разные вещества сильно отличаются по электропроводности, но это сделал Д. И. Менделеев. Он подробно описал процесс распада электролита на ионы, который объясняется его взаимодействием с молекулами воды (или другого растворителя).
Схема электролитической диссоциации: KA ⇄ K + (катион) + A — (анион).
Уравнение диссоциации на примере хлорида натрия: NaCl ⇄ Na + + Cl — .
Механизм электролитической диссоциации
При контакте с водой или другими растворителями диссоциации подвержены все вещества с ионной связью. Также распадаться на ионы могут вещества с ковалентной полярной связью, которая под действием воды переходит в ионную, а после разрушается.
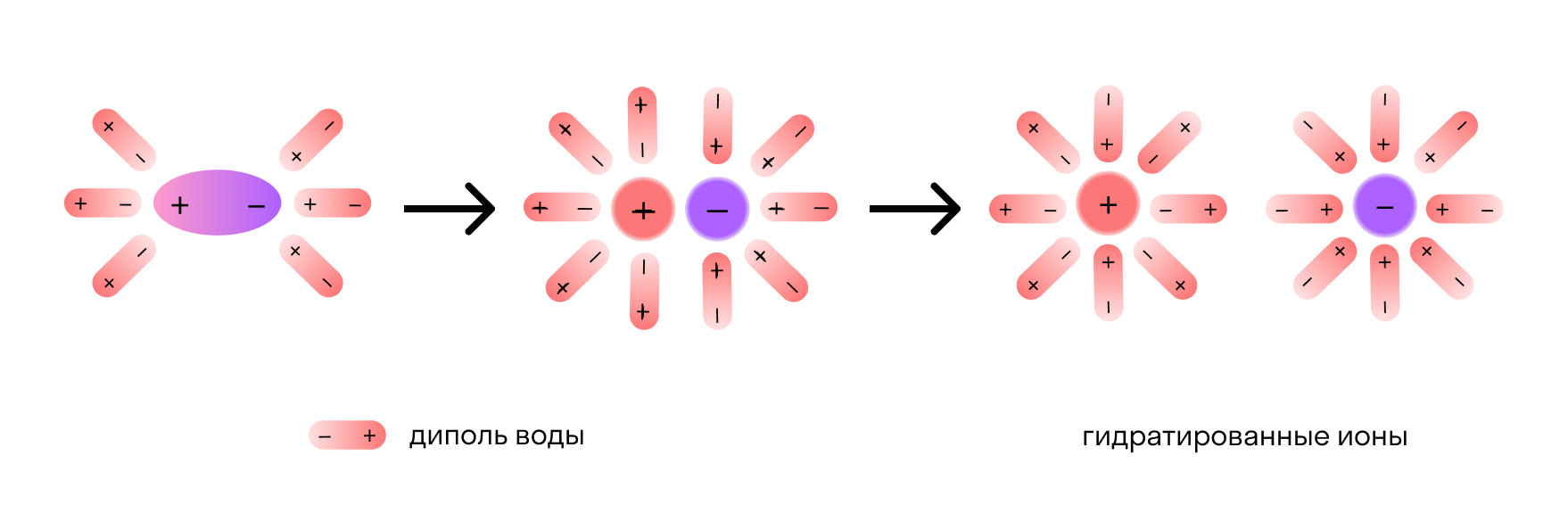
Механизм диссоциации электролитов удобно рассматривать на примере хлорида натрия NaCl. Его кристаллическая решетка образована катионами натрия Na + и анионами хлора Cl — , которые удерживаются вместе благодаря ионной связи. При растворении в воде каждый кристалл хлорида натрия окружают ее молекулы.
Отметим, что молекулы воды — это диполи. На одном конце они несут атомы водорода с частичным положительным зарядом, а на другом — атомы кислорода с частичным отрицательным. Соответственно, атомы кислорода притягиваются к катионам натрия, а атомы водорода — к анионам хлора. Эта сила электростатического притяжения ослабляет и в итоге разрывает ионную связь между натрием и хлором. Вещество диссоциирует на ионы.
После распада хлорида натрия образовавшиеся ионы Na + и Cl — окружают молекулы воды, создавая гидратную оболочку. Ионы с такой оболочкой называют гидратированными.
Если вместо воды был использован другой растворитель — например, этанол, его молекулы создают сольватную оболочку. В этом случае ионы называются сольватированными.
Сущность процесса электролитической диссоциации передает схема:
Электролиты и неэлектролиты
Хотя электролитическая диссоциация происходит независимо от действия электротока, между этими явлениями есть связь. Чем выше способность вещества распадаться на ионы при взаимодействии с растворителем, тем лучше оно проводит электроток. По такому критерию известный физико-химик М. Фарадей выделил электролиты и неэлектролиты.
Электролиты — это вещества, которые после диссоциации на ионы в растворах и расплавах проводят электроток. Обычно в их молекулах ионные или полярные ковалентные связи.
Неэлектролиты — это вещества, которые не распадаются на ионы в растворах и расплавах, а значит, не обладают проводимостью в растворенном виде. Для них характерны ковалентные неполярные или слабополярные связи.
Степень диссоциации
В зависимости от того, сколько молекул диссоциировало на ионы, вещество может быть сильным или слабым электролитом. Этот показатель называется степенью диссоциации, его измеряют от 0 до 1 либо в процентах.
Степень диссоциации — это отношение количества распавшихся на ионы молей вещества к исходному количеству молей.
Если в растворе на ионы распадаются все 100% электролита, .
По силе электролиты делятся на следующие группы:
Теория электролитической диссоциации (ТЭД)
Разделы: Химия
Цели:
воспитания:
- воспитывать аккуратность в ведении записей в тетрадях;
- приучать к поддержанию чистоты и аккуратности рабочего места;
- воспитывать умение общения в коллективе.
образования:
- сформировать представление об основных положения ТЭД;
- рассмотреть классификацию веществ в свете ТЭД;
- рассмотреть классификацию электролитов по силе;
- изучить условия протекания реакций ионного обмена до конца.
развития:
- уметь формулировать определение понятиям “электролит”, “неэлектролит”, “электролитическая диссоциация”, “катод”, “анод”, “степень диссоциации”, “реакция ионного обмена”;
- уметь классифицировать вещества по электропроводности; по силе;
- уметь составлять уравнения электролитической диссоциации;
- уметь составлять уравнения реакций ионного обмена (молекулярное, полное ионное, сокращённое ионное)
Оборудование: формулы веществ, опорные схемы; NaCl, NaOH., H2SO4 конц, С2H5OH, C12H22O11, H2O; стакан с водой, пробирки, прибор, для изучения электропроводности веществ.
Методы: словесно-наглядный, практический, словесно-поисковый, индуктивный, метод самостоятельной работы. [2].
Методика: урок-лекция, изучение нового; урок-семинар (приложение 1).
Человек живёт в мире, состоящем из огромного количества химических соединений, которые, как известно, бывают органическими и неорганическими.
Какие классы неорганических соединений мы изучили? На доске заранее вывешены формулы веществ:
| CaCl2 | H2O | HCl | H3PO4 |
| HNO3 | Na2SO4 | LiOH | |
| CuO | Ba(OH)2 | CO2 | MgBr2 |
- Какие из приведённых веществ относят к оксидам; основаниям; кислотам; солям?
- Прочитайте и назовите представленные вещества с позиции их состава.
На сегодняшнем уроке мы углубим знания о важнейших классах неорганических соединений, изучив основные положения теории электролитической диссоциации (ТЭД).
Запишите число и тему урока.
На доске заранее вывешены опорные схемы.
Чтобы владеть материалом необходимо:
| ЗНАТЬ: | УМЕТЬ: |
|
|
Впервые теорию электролитической диссоциации в своих трудах описал в 1887 г. шведский физико-химик Сванте Август Аррениус, основные идеи которой применил в биохимии, физиологии и геохимии.
Давайте эту веху в истории пометим у себя в тетрадях.
Проведём эксперимент с помощью прибора, схема которого изображена на рисунке 1. [1].
| Вещество | NaCl |
твёрдый
твёрдый
конц.
дист.
твёрдый
| Вещество | NaCl |
раствор
раствор
раствор
водопров.
раствор
Сформулируйте вывод из увиденного эксперимента.
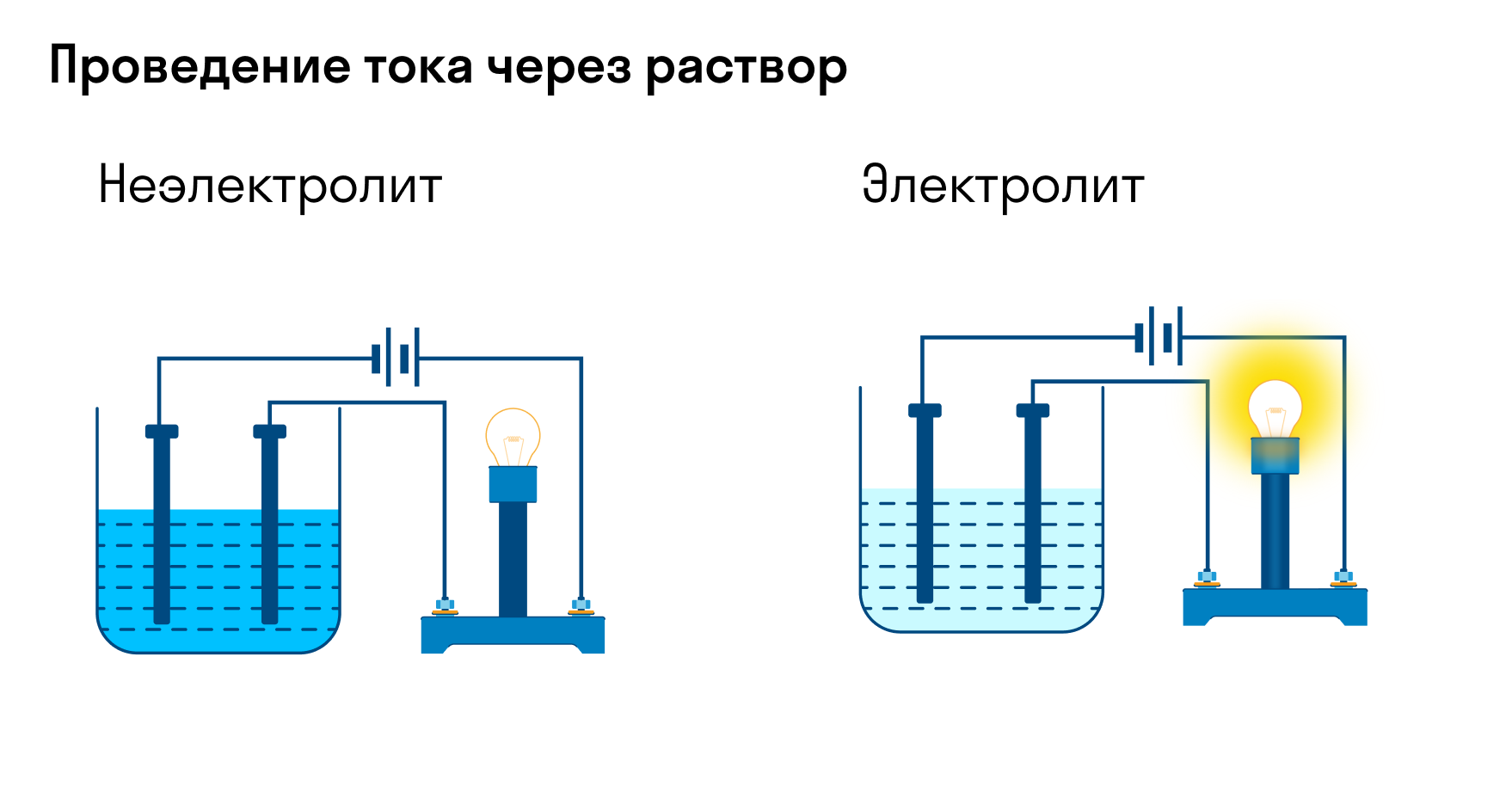
Очевидно, что многие вещества меняют свою электропроводность – способность проводить электрический ток – при их растворении в воде (или при расплавлении).
1. Если вещество проводит электрический ток, то оно относится к группе электролитов; в противном случае – неэлектролитов. Это первое положение ТЭД.
| Вещества | |
| Электролиты: | Неэлектролиты: |
| — металлы, Сграфит, Si; | |
— кислоты, основания, соли, растворимые в воде;
— проводят электрический ток.
— кислоты, основания, соли, нерастворимые в воде;
— многие органические вещества;
— не проводят электрический ток.
Все соли в расплавах – сильные электролиты!
Определите вид химической связи в приведённых веществах, заполнив таблицу?
| Вещество | NaCl | NaOH | H2SO4 | H2O | С2H5OH | C12H22O11 |
| Вид ХС | И.С. | И.С. | К.П.С. | К.П.С. | К.П.С. | К.П.С. |
Сформулируйте вывод о видах химической связи, характерных для электролитов; неэлектролитов.
Как показывает эксперимент, вода является непременным участником процесса в рассматриваемой теории.
Каково же строение молекулы воды?
Это полярная, состоящая из двух равных по величине и противоположных по знаку зарядов, молекула – диполь.
Рассмотрим, что же происходит при растворении вещества в воде на примере поваренной соли, формула которой NaCl.
Какую кристаллическую решётку имеет хлорид натрия? (Ионную).
Как показывает опыт в твёрдом состоянии хлорид натрия не проводит электрический ток. Растворим его в воде. Согласно законам электростатики разноимённые заряды притягиваются, в результате чего диполи воды разрушают кристаллическую решётку, образуя гидратированные ионы – частицы окружённые диполями воды, а высвобождающиеся ионы приобретают подвижность. Такой процесс называют электролитической диссоциацией. Это и есть второе положение ТЭД.
2. Процесс распада электролита на ионы под действием воды или при расплавлении – электролитическая диссоциация.
А что такое ионы?
Ионы – это заряженные частицы, несущие положительный (катионы) или отрицательный (анионы) заряд.
Ионы водорода и металлов имеют положительный заряд. Число положительных зарядов совпадают с валентностью атомов соответствующих химических элементов.
Гидроксид-ионы и ионы кислотных остатков имеют отрицательный заряд. Число отрицательных зарядов совпадает с валентностью кислотных остатков.
| H + (H I ), Ca 2+ (Ca II ), Al 3+ (Al III ) | OH — (HOH I ), Cl — (HCl I ), SO4 2- (H2SO4 II ), PO4 3- (H3PO4 II ) |
Процесс электролитический диссоциации можно записать при помощи уравнений.
Многоосновные кислоты, многокислотные основания, диссоциируют ступенчато. Число ступеней диссоциации равно числу атомов водорода в кислоте и числу гидроксо-групп в основании.
| H3PO4 H + + H2PO4 — |
HPO4 2- H + + PO4 3-
SrOH + OH — + Sr 2+
Соли диссоциируют полностью.
Наряду с диссоциацией протекает ассоциация.
В отсутствии тока ионы перемещаются хаотично. Вследствие электростатических сил притяжения ионы перемещаются к тому электроду, который обладает противоположным им по знаку зарядом. [3].
Запишем третье положение ТЭД.
3. В расплавах или растворах ионы движутся хаотически. При пропускании электрического тока ионы приобретают направленное движение: катионы движутся к катоду – отрицательно заряженному электроду, анионы – к аноду – положительно заряженному электроду.
Не все электролиты полностью распадаются на ионы. По степени диссоциации электролиты можно классифицировать на сильные и слабые. Количественной характеристикой диссоциации является степень диссоциации?. Данное положение является четвёртым положением ТЭД.
4. Все электролиты по степени диссоциации классифицируют на сильные и слабые.
,
Nдисс. – число продиссоциировавших молекул, Nобщ. – общее число молекул.
К какой группе относится электролит, если a = 98%; a = 0,01; a = 0,77?
Степень диссоциации возрастает при увеличении разбавления раствора, при повышении температуры раствора.
Классифицируйте вещества (формулы которых были вывешены в начале урока) на сильные и слабые электролиты.
Между растворами электролитов возможны реакции ионного обмена. В результате ионного обмена проходит обмен ионами. Реакции ионного обмена протекают до конца, если изменяется ионный состав раствора, то есть если образуется осадок или слабый электролит. Мы подошли к пятому положению ТЭД.
5. Между растворами электролитов протекают реакции ионного обмена, которые идут до конца, если образуются осадок, газ или слабый электролит (например, вода).
K2CO3 + 2HNO3 —> 2KNO3 + CO2 
2K + + CO3 2- + 2H + + 2NO3 — —> 2K + + 2NO3 — + CO2 
CO3 2- + 2H + —> CO2 
Алгоритм составления ионных уравнений – приложение 2.
Мы рассмотрели основные положения теории электролитической диссоциации. Давайте закрепим и обобщим изученный материал (приложение 3).
Задание. Даны растворы:
- I вариант – CuSO4,
- II вариант – RbOH.
Для предложенных веществ:
- Определите, к какой группе (электролиты, неэлектролиты) относится данное вещество.
- Составьте (если это возможно) уравнение электролитической диссоциации.
- Определите, какие частицы находятся в растворе, и как будут вести себя частицы при пропускании электрического тока.
- Если вещество – электролит, определите его силу.
- Составьте уравнение реакции ионного обмена с веществом из другого варианта.
Д/з: выучить записи в тетради, подготовиться к семинару по данной теме.
Семинар – лист фронтальной работы (приложение 1).
http://skysmart.ru/articles/chemistry/teoriya-elektroliticheskoj-dissocziaczii
http://urok.1sept.ru/articles/661497










 ,
,