Оксид кремния (IV)
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) SiO2 – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
Химические свойства
Оксид кремния (IV) – типичный кислотный оксид . За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочей и в расплаве с основными оксидами . При этом образуются силикаты.
Например , диоксид кремния взаимодействует с гидроксидом калия:
Еще пример : диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
2. Оксид кремния (IV) не взаимодействует с водой , т.к. кремниевая кислота нерастворима .
3. Оксид кремния (IV) реагирует при сплавлении с карбонатами щелочных металлов . При этом работает правило: менее летучий оксид вытесняет более летучий оксид из солей при сплавлении.
Например , оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ:
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом:
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
Например , оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Например , оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
Еще пример : оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
Кремний
Кремний — неметаллический элемент IVa группы периодической таблицы Д.И. Менделеева. Второй после кислорода элемент по распространенности в земной коре.
В чистом виде в природе практически отсутствует. Чаще всего встречается в виде кремнезема — SiO2 — песок, песчаник, кварц, глина.
Кремниевая (силиконовая) долина
Регион в штате Калифорния (США), отличающийся большой плотностью высоко технологичных компаний, связанных с производством компьютеров и микропроцессоров.
Кремний является природным полупроводником, используется как основной материал для производства микросхем. Кремний ближе, чем вы думаете: внутри гаджета, которым вы пользуетесь 😉
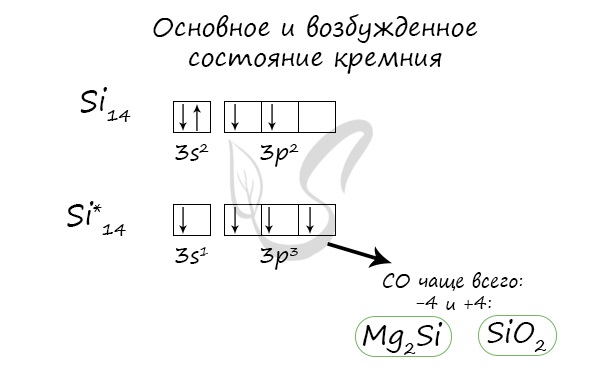
Основное и возбужденное состояние кремния
При возбуждении атома кремния электроны на s-подуровне распариваются и один из них переходит на p-подуровень.
Природные соединения
В природе кремний встречается в виде следующих соединений:
- SiO2 — кварц, кремнезем, гранит, песчаник, песок, глина
- SiO2 с примесью Fe 3+ — цитрин
- SiO2 с примесью Fe 2+ и Fe 3+ — аметист
Получение
В промышленности кремний получают путем восстановления кремнезема в электрических печах, алюминотермией.
В лабораторных условиях мелкий белый песок прокаливают с магнием:
SiO2 + Mg → (t) MgO + Si
Химические свойства
- Реакции с неметаллами
При обычных условиях без нагревания кремний реагирует только со фтором.
При нагревании кремний вступает в реакции с остальными галогенами (Cl, Br, I), углеродом, кислородом. При очень высоких температурах (1200 °C) кремний с кислородом образует оксид кремния II — несолеобразующий оксид.
Si + O2 → (t = 1200 °C) SiO
В подобных реакциях кремния проявляет свои окислительные способности.
Ca + Si → Ca2Si (силицид кальция)
Реакция с щелочами
С целью травления (удаления поверхностного слоя материала) кремниевые изделия можно погружать в раствор щелочи.
Оксид кремния IV — SiO2
Оксид кремния IV имеет атомное строение, обладает высокой прочностью и твердостью. Плавится при температуре +1730 °C градусов.
В промышленности оксид кремния IV получают нагреванием кремния в атмосфере кислорода.
В лабораторных условиях проводят реакция силиката натрия с уксусной кислотой. Кремниевая кислота сразу же распадается на SiO2, который выпадает в осадок, и воду.
- Реакции с кислотами
Химически SiO2 устойчив к действию кислот, однако вступает в реакцию с газообразным фтороводородом (газом) и плавиковой кислотой (жидкостью).
Реакции с основными оксидами и щелочами
SiO2 является кислотным оксидом, соответствует кремниевой кислоте. Вступая в реакции с основными оксидами и щелочами, образует соли данной кислоты — силикаты.
Так как чаще всего кислотные оксиды с солями не реагируют, тем более необычной кажется реакция оксида кремния IV с карбонатами.
Кремниевая кислота
Слабая, малорастворимая в воде кислота. Ее соли носят название — силикаты.
Поскольку кремниевая кислота малорастворима, то банальной реакцией SiO2 с водой ее не получить. Эту задачу решают в две стадии через ее соли — силикаты.
Кремниевая кислота слабая, нестойкая, легко распадается на воду и оксид кремния IV.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Гидроксид кремния: свойства, структурная формула и способы получения
Впервые кремний стал известен человечеству как самостоятельный химический элемент в 1825 году. Это вещество является неметаллом, который в зависимости от условий реакции может быть восстановителем и окислителем. Основные химические и физические свойства этого элемента повлияли на его распространённость в народном хозяйстве. Структурную формулу гидроксид кремния, а также сферы его использования изучают на уроках химии в 8 классе.
Краткое описание
В привычном понимании высшего гидроксид кремния не существует. Но благодаря своим физическим свойствам этот элемент получил большой спрос в промышленности. В аморфном состоянии это вещество в результате химической реакции с водяным паром (при температуре +500 °C) образует водород плюс диоксид кремния. Например, Si (аморфный) + 2H2O (пар) → SiO2 + 2H2.
Полученный диоксид кремния представляет собой слабый кислотный оксид, который после присоединения водорода может образовывать кремниевые кислоты. Для обозначения гидроксид кремния используется общая формула — H2SiO3.
В зависимости от общего количества задействованных атомов кремния, водорода и кислорода может образовываться несколько разновидностей кислот:
- Ортокремниевая (H4SiO4).
- Метакремниевая (H2SiO3).
- Поликремниевая (nSiO2∙mH2O).
- Дикремниевая (H2Si2O5, H10Si2O9).
- Пирокремниевая (H6Si2O7).
В научной среде соли кремниевых кислот (химическая формула — nSiO2∙mH2O) принято называть силикатами. Для их получения недостаточно соединить H2SiO3 с Н2О, так как даже при самой высокой температуре диоксид не вступает в реакцию с водой. Чистый кремний можно получить только в результате взаимодействия гидроокиси кремния с водородом. Записать эту химическую реакцию можно так: SiO2 + 2Н2 → Si + 2H2O.
В лабораторных условиях получить H2SiO3 можно только двумя способами:
- Использование гидролиза силанов.
- Воздействие на силикаты калия и натрия сильных кислот: Na2SiO3 + 2HCl → H2SiO3↓ + 2NaCl.
Физические характеристики
В промышленной отрасли чаще всего используется кристаллический кремний. Это связано с тем, что физические свойства этого материала позволяют выпускать различный товар с высокими эксплуатационными характеристиками. Плавиться H2SiO3 начинает при температуре +1417 °C, а закипает при +2600 °C. Материал весьма хрупкий, так как показатель его плотности не превышает 2.33 г/куб. см. Гидроксид кремния получил 7 баллов по шкале Мооса. Уровень диэлектрической проницаемости не превышает 1.17.
H2SiO3 является неметаллом, из-за чего его электрические свойства полностью зависят от присутствующих в составе примесей. В промышленной отрасли специалисты научились использовать эту особенность химического вещества в свою пользу, так как на любом этапе производства они могут смоделировать нужный тип проводника.
При комнатной температуре силициум является хрупким, но если нагреть его до отметки +800 °C, тогда не исключена пластическая деформация. Итоговые характеристики аморфного кремния могут существенно отличаться, что связано с его гигроскопичностью. Это химическое вещество может вступать в различные реакции даже при комнатной температуре.
Химические свойства
Практически во всех существующих соединениях H2SiO3 проявляет следующие степени окисления: +2, -4, +4. Вещество является химически инертным при низких температурах. Под воздействием кислорода кремний покрывается тонкой плёнкой оксида. После нагревания до отметки +400 °C элемент окисляется. С фтором H2SiO3 может взаимодействовать в обычных условиях, а вот с азотом, галогенами и углеродом вступает в химическую реакцию только под воздействием высоких температур.
Задействованные щёлочи могут перевести кремний в Na2SiO3 с последующим выделением водорода. H2SiO3 растворим практически во всех расплавленных металлах, а с некоторыми из них может формировать различные соединения, которые называются силицидами. Образуемые вещества получили большой спрос в народном хозяйстве.
Гидроксид кремния в сочетании с водородом может формировать специфические соединения, которые имеют общую формулу — SinH2n+2 (силаны). В химии используются различные кремнийорганические соединения. Например, органосилоксаны, силиконы. Но наибольшее значение имеют nSiO2∙mH2O.
В результате растворения аморфного кремния в концентрированном растворе гидроксид натрия (Si + NaOH) происходит образование средней соли — ортосиликата натрия, а также выделение газа водорода. Молекулярное уравнение реакции имеет вид: Si + 4NaOH → Na4SiO4 + 2H2. Чтобы понять, какой будет реакция взаимодействия соляной кислоты с оксидом кремния, нужно обратить внимание на следующую формулу: SiO2 + 4HCl → SiCl4 + 2H2O.
В природе широко распространены соли кремниевых кислот: различные минералы класса силикатов. Алюмосиликаты образуются в результате изоморфного замещения в их структуре небольшого процента H2SiO3 алюминием.
Способы получения
Чаще всего nSiO2∙mH2O стараются получить непрямым способом. В лабораторных условиях на силикат натрия или калия воздействуют сильной кислотой. Например, Na2SiO3 + 2HCl = H2SiO3 + 2NaCl. Но в этом случае невозможно получить идеально чистую кислоту. В водном растворе обязательно будет присутствовать высокодисперсная коллоидная система, которая через некоторое время превратится в гель.
Многие кремниевые соединения можно получить благодаря гидролизу хлорсиланов. Эту химическую реакцию можно записать так: SiH2Cl2 + 3H2O = H2SiO3 +2HCl + 2H2. Если всё сделано правильно, то nSiO2∙mH2O будут являться финальным продуктом гидролитического расщепления элементов. Методы ионного обмена и электродиализа целесообразно использовать в том случае, если речь касается промышленного производства, либо различных лабораторных экспериментов. Благодаря перенасыщенным растворам кремниевых кислот получается силикагель (SiOH). Сама технология производства состоит из нескольких этапов:
- Первым делом образуется коллоидный раствор, который после остывания превращается в однородную массу, называемую гидрогелем.
- На втором этапе происходит созревание. Учитывается не только гелеобразование, но и разжижение химического вещества.
- Полученный гель очищают, промывают от солей.
- На финальном этапе вещество высушивают и превращают в ксерогель.
В лабораторных условиях было доказано, что самый качественный силикагель можно получить после гидролиза кремниевых и ортокремниевых соединений. Этот химический процесс можно изобразить следующим образом: Na2SiO3 + H2SO4 = nSiO2 • mH2O + Na2SO4. В этой графической формуле использовался гидратированный аморфный кремнезём.
Сферы использования
H2SiO3 благодаря своим физическим и химическим характеристикам получил большой спрос в различных отраслях современной промышленности. В чистом виде аморфный и кристаллический кремний применяется в следующих сферах:
- Изготовление качественного поликремния.
- В металлургии H2SiO3 используется как легирующая добавка, которая может менять свойства металлов и их сплавов. Кремний применяется при выплавке чугуна и стали.
- Серийное производство солнечных батарей. Среди преимуществ такого получения электроэнергии можно выделить экономичность, износоустойчивость и экологическую безопасность.
- H2SiO3 часто используется в сочетании с органическими веществами. Кремнийорганические материалы применяются при изготовлении посуды, различных инструментов.
- Производство комплектующих деталей для лазерных устройств.
Кремниевые соединения являются важными элементами для кожного покрова, ногтей и волос. H2SiO3 используется для производства лекарственных препаратов и косметологических средств.
Составы на основе кремния гарантируют повышение упругости соединительных тканей. При правильном применении препараты с H2SiO3 улучшают усвоение кальция, а также нормализуют работу органов желудочно-кишечного тракта.
http://studarium.ru/article/167
http://tarologiay.ru/nauka/gidroksid-kremniya-svoystva-strukturnaya-formula-i-sposoby-polucheniya.html