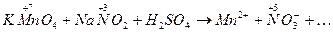Оксид азота II: получение и химические свойства
Оксиды азота
| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
Оксид азота (II)
Оксид азота (II) NO – это несолеобразующий оксид. В нормальных условиях это бесцветный ядовитый газ, плохо растворимый в воде. На воздухе коричневеет из-за окисления до диоксида азота. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Способы получения
1. В лаборатории оксид азота (II) получают действием разбавленной азотной кислоты (30%) на неактивные металлы.
Например , при действии 30 %-ной азотной кислоты на медь образуется NO:
Также NO можно получить при окислении хлорида железа (II) или иодоводорода азотной кислотой:
FeCl2 + NaNO3 + 2HCl → FeCl3 + NaCl + NO + H2O
2HNO3 + 2HI → 2NO + I2 + 2H2O
2. В природе оксид азота (II) образуется из азота и кислорода под действием электрического разряда, например, во время грозы:
3. В промышленности оксид азота (II) получают каталитическим окислением аммиака :
Химические свойства
1. Оксид азота (II) легко окисляется под действием окислителей .
Например , горит в атмосфере кислорода:
Оксид азота (II) легко окисляется под действием хлора или озона:
2NO + Cl2 → 2NOCl
2. В присутствии более сильных восстановителей проявляет свойства окислителя . В атмосфере оксида азота (II) могут гореть водород, углерод и т.п.
Например , оксид азота (II) окисляет водород и сернистый газ:
3. Как несолеобразующий оксид, при обычных условиях с основаниями, основными оксидами, амфотерными оксидами, кислотными оксидами, кислотами и амфотерными гидроксидами оксид азота (II) не реагирует:
Оксиды азота: решение уравнений ОВР методом электронного баланса
Подробно решение уравнений окислительно-восстановительных реакций (ОВР) методом электронного баланса разобраны на странице «Метод электронного баланса».
Ниже приведены примеры уравнений окислительно-восстановительных реакций оксидов азота (См. Оксиды азота).
Если в окислительно-восстановительной реакции принимают участие простые вещества, молекулы которых состоят из двух или более атомов элементов, то в электронном балансе кол-во отданных и полученных электронов определяют с учётом кол-ва атомов в молекуле: H2 0 -2e — → 2H +1 .
Уравнения окислительно-восстановительных реакций` оксидов азота
1. Уравнение реакции оксида азота (I) с барием:
В молекуле оксида азота (I) один атом азота находится в нулевой степени окисления, а второй — в степени окисления +2:
В ОВР участвует только N +2 , а N 0 без изменения степени окисления переходит в N2 0 , поэтому, оформлять уравнение ЭБ более правильно по второму варианту.
2. Уравнение реакции оксида азота (II) с медью:
3. Уравнение реакции окисления оксида азота (II):
4. Уравнение реакции оксида азота (II) с водородом:
5. Уравнение реакции оксида азота (II) с углеродом:
6. Уравнение реакции оксида азота (II) с фосфором:
7. Уравнение реакции оксида азота (II) с оксидом серы (IV):
8. Уравнение реакции оксида азота (IV) с оксидом серы (IV):
9. Уравнение реакции оксида азота (IV) с оксидом азота (II) с образованием оксида азота (III):
10. Уравнение реакции получения азотистой кислоты:
11. Уравнение реакции оксида азота (IV) с оксидом азота (II) в щелочной среде:
12. Уравнение реакции взаимодействия оксида азота (IV) с водой:
13. Уравнение термической реакции взаимодействия оксида азота (IV) с водой:
14. Уравнение реакции получения азотной кислоты:
15. Уравнение реакции взаимодействия оксида азота (IV) с гидроксидом калия на воздухе:
16. Уравнение реакции оксида азота (IV) с водородом:
17. Уравнение реакции оксида азота (IV) с калием:
18. Уравнение реакции оксида азота (IV) с кальцием:
19. Уравнение реакции оксида азота (IV) с висмутом:
20. Уравнение реакции оксида азота (IV) с цинком:
21. Уравнение реакции оксида азота (IV) с озоном:
22. Уравнение реакции оксида азота (IV) с гидроксидом натрия:
23. Уравнение реакции оксида азота (IV) с гидроксидом железа:
24. Уравнение термической реакции оксида азота (IV) с иодидом железа:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Метод электронно-ионных полуреакций
Составление уравнений ОВР данным методом рекомендуется выполнять в следующей последовательности:
· рассчитать степени окисления атомов элементов и по изменению степеней окисления определить окислитель и восстановитель;
· составить ионную схему реакции, выделить окислительно-восстановительные пары;
· составить электронно-ионные уравнения полуреакций окисления и восстановления, в которых уравнять число атомов элементов и заряд обеих частей полуреакций в определённой очерёдности:
· число атомов элементов, отличающихся от кислорода и водорода,
· число атомов кислорода,
· число атомов водорода,
· заряд обеих частей полуреакций;
· суммировать уравнения полуреакций с учётом дополнительных множителей, подобранных таким образом, чтобы уравнять число принятых и отданных электронов;
· в полученном ионном уравнении при необходимости выполнить алгебраические преобразования, и на его основе составить молекулярное уравнение.
Последовательность составления уравнений рассмотрим на конкретных примерах ОВР с заданными продуктами.
Пример 1.Реакция в кислой среде между перманганатом калия и нитритом натрия. Схема реакции:
· Составляем ионную схему реакции, записав, как в ионных уравнениях, сильные растворимые электролиты в виде ионов, а остальные вещества виде молекул:
Рассчитываем степени окисления элементов, определяем окислитель и его восстановленную форму, восстановитель и его окисленную форму – окислительно-восстановитель-ные пары:
· Составляем уравнения полуреакций. Уравниваем в левой и правой частях каждой полуреакции число атомов всех элементов. Число атомов марганца и азота одинаково в обеих частях полуреакций. Уравнивание числа атомов кислорода и водорода выполняют с учётом среды, в которой происходит реакция. Если ОВР проходит в кислой среде, для уравнивания числа атомов кислорода и водорода в уравнения полуреакций можно включать только молекулы воды и ионы водорода:
Таким образом, чтобы уравнять число атомов кислорода, а затем атомов водорода в кислой среде, необходимо в ту часть уравнения полуреакции, где недостаёт n атомов кислорода, вписать n молекул воды, а в противоположную часть 2n ионов водорода.
· Уравниваем сумму зарядов ионов в левой и правой частях полуреакций, записывая в левую часть необходимое число электронов со знаками (+) или (–).
В первой полуреакции алгебраическая сумма зарядов ионов в левой части равна -1 + 8(+1) = +7, в правой равна +2, для уравнивания зарядов необходимо к левой части прибавить 5 электронов.
MnO4 — + 8H + + 5 
В левой части второй полуреакции надо вычесть 2 элек-трона:
NO2 — + H2O — 2 
· Уравниваем число отданных и принятых электронов наименьшими множителями – коэффициентами и суммируем уравнения, умножив каждое слагаемое на соответствующий коэффициент:


NO2 — + H2O — 2 
 |
· Приводим подобные члены в суммарном уравнении
и по полученному краткому ионному уравнению дописы-ваем молекулярное уравнение:
· (Пояснить появление K2SO4 в продуктах реакции) Уравнение считается законченным, когда в продуктах реакции и исходных веществах содержится одинаковое число атомов каждого элемента.
Пример 2. Реакция между сульфатом марганца (II) и гипохлоритом калия в щелочной среде:
Уравнение составляем в той же последовательности, которая приведена для реакций в кислой среде.
· Ионная схема реакции:
Mn 2+ + SO4 2– + K + + ClO – + Na + + OH – ® MnO2 + Cl – +.
В исходных реагентах дана щелочь – NaOH, поэтому уравнения полуреакций составляем с учетом щелочной среды: число атомов кислорода и водорода уравниваем гидроксид-ионами ОН — и молекулами воды:
ClO – + H2O ® Cl – + 2OH – .
Чтобы уравнять число атомов кислорода, а затем атомов водорода в щелочной среде, необходимо в ту часть уравнения полуреакции, где недостаёт n атомов кислорода, вписать 2n гидроксид-ионов ОН-, а в противоположную часть n молекул воды.
· Уравниваем заряды левой и правой частей уравнений полуреакций:
Mn 2+ + 4OH – –2 
ClO – + H2O + 2 
т.е. первая полуреакция — окисление восстановителя, вторая восстановление окислителя.
· Суммируем уравнения полуреакций:
 |
Mn 2+ + 4OH – –2 
ClO – + H2O + 2 
 |
Mn 2+ + ClO – + 4OH – + H2O = MnO2 + Cl – + 2H2O + 2OH –
· Приводим подобные члены:
Mn 2+ + ClO – + 2OH – = MnO2 + Cl – + H2O.
Пример 3.Реакция между перманганатом калия и нитритом натрия в нейтральной среде:
Будем придерживаться рекомендованной ранее последо-вательности операций.
· В ионную схему можно не включать молекулы и ионы, не участвующие в полуреакциях:
· При составлении уравнений реакций, протекающих в нейтральной среде, необходимо иметь в виду, что в левой части уравнений полуреакций не должно быть ионов Н + и ОН — , а в правой части эти ионы можно использовать.
Соответствующие уравнения полуреакций:
MnO4 — + 2H2O + 3 
NO2 — + H2O – 2 
Таким образом, в нейтральной среде число атомов кислорода и водорода уравнивают по-разному, в зави-симости от того, в какую часть полуреакции необходимо ввести недостающие атомы. Если в правой части уравнения полуреакции недостаёт n атомов кислорода, в неё следует добавить 2n гидроксид-ионов, а в левую часть – n молекул воды. Если в левой части уравненияполуреакции недостаёт n атомов кислорода, в неё следует добавить n молекул воды, а в правую часть – 2n ионов водорода.
· Суммируем уравнения полуреакций:


NO2 — + H2O – 2 
 |
 |  |
· После объединения ионов OH — и H + в молекулы воды приводим подобные члены и получаем ионное уравнение реакции:
Представим схематически уравнивание числа атомов кислорода и водорода в различных средах, (обозначаем 
кислая среда — 
Н2О = 
щелочная среда — 
2ОН — = 
нейтральная среда 
Н2О = 
Очевидно, что для уравнивания числа атомов кислорода существует всего два отличающихся приёма: добавление в ту часть уравнения полуреакции, где недостаёт n атомов кислорода, 2n гидроксид-ионов (если это позволяет данная среда), или n молекул воды.
Дата добавления: 2015-08-08 ; просмотров: 5758 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://prosto-o-slognom.ru/chimia_ovr/zadachi_03_NO.html
http://helpiks.org/4-60651.html