Основное уравнение молекулярно-кинетической теории (Колебошин С.В.)
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
На прошлых уроках мы сформулировали понятие идеального газа и описали его микро- и макропараметры. Этот урок будет посвящён выведению соотношения между этими параметрами. Таким образом, мы выведем основное уравнение молекулярно-кинетической теории, а также рассмотрим две формы записи данного уравнения.
Как так напишите уравнение в молекулярном видео
Урок посвящен изучению темы «Реакции ионного обмена». На нём вы рассмотрите сущность реакций, протекающих между растворами кислот, солей и щелочей. На уроке будет дано определение новому понятию реакции ионного обмена.
Также будут рассмотрены условия протекания реакций ионного обмена до конца. Чтобы лучше понять, какие необходимо соблюдать условия протекания реакций ионного обмена до конца, будет проведено повторение, что собой представляют эти реакции, их сущность. Приводятся примеры на закрепление этих понятий.
Урок поможет закрепить умение составлять уравнения реакций ионного обмена в молекулярной и ионной формах, научит составлять по сокращенному ионному уравнению молекулярные.
I. Сущность реакций ионного обмена
Реакциями ионного обмена называют реакции между растворами электролитов, в результате которых они обмениваются своими ионами.
Реакции ионного обмена протекают до конца (являются практически необратимыми) в тех случаях, если образуются слабый электролит, осадок (нерастворимое или малорастворимое вещество), газ.
AgNO3 + HCl = AgCl
Реакция протекает до конца, так как выпадает осадок хлорида серебра
Сu(OH)2 + 2HCl = CuCl2 + 2H2O
Реакция идет до конца, так как образуется слабый электролит вода
Na2CO3 + 2H2SO4 = Na2SO4 + CO2
Реакция протекает до конца, так как образуется углекислый газ
Правила написания уравнений реакций в ионном виде
1. Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты.
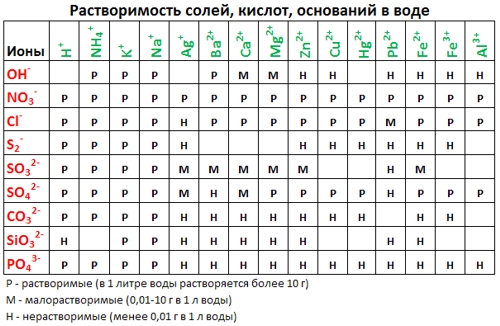
2. Пользуясь таблицей растворимости, записывают в ионном виде формулы веществ (солей, кислот, оснований), обозначенных в таблице растворимости буквой «Р» (хорошо растворимые в воде), исключение – гидроксид кальция, который, хотя и обозначен буквой «М», все же в водном растворе хорошо диссоциирует на ионы.
3. Нужно помнить, что на ионы не разлагаются металлы, оксиды металлов и неметаллов, вода, газообразные вещества, нерастворимые в воде соединения, обозначенные в таблице растворимости буквой «Н». Формулы этих веществ записывают в молекулярном виде. Получают полное ионное уравнение.
4. Сокращают одинаковые ионы до знака «равно» и после него в уравнении. Получают сокращенное ионное уравнение.
На ионы диссоциируют
Реагенты (исходные вещества)
Растворимые (P) в воде (см. ТР):
(включая Ca(OH)2 – M)
Растворимые (P) в воде (см. ТР):
Исключения – неустойчивые вещества не диссоциируют, а разлагаются на газ и воду:
Р — растворимое вещество;
М — малорастворимое вещество;
ТР — таблица растворимости.
Алгоритм составления реакций ионного обмена (РИО)
в молекулярном, полном и кратком ионном виде
1) Записываем уравнение РИО в молекулярном виде:
Взаимодействие сульфата меди (II) и гидроксида натрия:
2) Используя ТР указываем растворимость веществ воде:
— Если продукт является М или Н – оно выпадает в осадок, справа от химической формулы ставим знак ↓
— Если продукт является газом, справа от химической формулы ставим знак ↑
3) Записываем уравнение РИО в полном ионном виде. Какие вещества диссоциируют см. в таблице — ПАМЯТКЕ
Cu 2 + + SO4 2- + 2Na + + 2OH — = 2Na + + 2SO4 + Cu(OH)2↓
Полный ионный вид
4) Записываем уравнение реакции в кратком ионном виде. Сокращаем одинаковые ионы, вычёркивая их из уравнения реакции.
Помните! РИО необратима и практически осуществима, если в продуктах образуются:
Краткий ионный вид
Вывод – данная реакция необратима, т.е. идёт до конца, т.к. образовался осадок Cu(OH)2↓
Заишем еще несколько примеров РИО, идущих с образованием осадка:
Пример №1
а) Молекулярное уравнение реакции двух растворимых солей:
б) Полное ионное уравнение реакции:
2Al 3+ + 3SO4 2- + 3Ba 2+ + 6Cl — = 3BaSO4↓ + 2Al 3+ + 6Cl —
в) Cокращенное ионное уравнение реакции:
Пример №2
а) Молекулярное уравнение реакции нерастворимого основания с кислотой:
б) Полное ионное уравнение реакции:
В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
Полное ионное уравнение реакции:
2Na + + CO3 2- + 2H + + 2Cl — = 2Na + + CO2↑ + H2O + 2Cl —
Cокращенное ионное уравнение реакции:
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода (IV).
Заишем еще несколько примеров РИО, идущих с образованием газа:
Пример №1
Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой:
Полное ионное уравнение реакции:
2K + + S 2– + 2H + + 2Cl – = 2K + + 2Cl – + H2S↑
Cокращенное ионное уравнение реакции:
Пример №2
Молекулярное уравнение реакции нерастворимой соли (карбоната) с кислотой:
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.
Посмотрите видео-опыт: “Реакция нейтрализации”
Пример №1
Молекулярное уравнение реакции щелочи с кислотой:
KOH (р) + HCl (р) = KCl(р) + H2O (мд)
Полное ионное уравнение реакции:
K + + OH – + H + + Cl – = K + + Cl – + H2O
Cокращенное ионное уравнение реакции:
Пример №2
Молекулярное уравнение реакции основного оксида с кислотой:
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
CaO + 2H+ = Ca 2+ + H2O.
Пример №3
Молекулярное уравнение реакции нерастворимого основания с кислотой:
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.
V. Выполнение заданий
Задание №1. Определите, может ли осуществляться взаимодействие между растворами гидроксида калия и хлорида аммония, записать реакциив молекулярном, полном, кратком ионном виде.
— Составляем химические формулы веществ по их названиям, используя валентности и записываем РИО в молекулярном виде (проверяем растворимость веществ по ТР):
так как NH4OH неустойчивое вещество и разлагается на воду и газ NH3уравнение РИО примет окончательный вид
— Cоставляем полное ионное уравнение РИО, используя ТР (не забывайте в правом верхнем углу записывать заряд иона):
K + + OH — + NH4 + + Cl — = K + + Cl — + NH3 ↑+ H2O
— Cоставляем краткое ионное уравнение РИО, вычёркивая одинаковые ионы до и после реакции:
Взаимодействие между растворами следующих веществ может осуществляться, так как продуктами данной РИО являются газ (NH3 ↑) и малодиссоциирующее вещество вода (H2O).
Подберите вещества, взаимодействие между которыми в водных растворах выражается следующими сокращёнными уравнениями. Составьте соответствующие молекулярное и полное ионное уравнения.
— Используя ТР подбираем реагенты — растворимые в воде вещества, содержащие ионы 2H + и CO3 2- .
— Составляем молекулярное уравнение РИО:
так как угольная кислота – неустойчивое вещества, она разлагается на углекислый газ CO2 ↑ и воду H2O, уравнение примет окончательный вид:
— Составляем полное ионное уравнение РИО:
6H + +2 PO4 3- + 6 K + + 3CO3 2- -> 6 K + + 2 PO4 3- + 3CO2 ↑ + 3H2O
— Составляем краткое ионное уравнение РИО:
Сокращаем коэффициенты на три и получаем:
В конечном итоге мы получили искомое сокращённое ионное уравнение, следовательно, задание выполнено верно.
Задание №3. Запишите реакцию обмена между оксидом натрия и фосфорной кислотой в молекулярном, полном и кратком ионном виде.
1. Составляем молекулярное уравнение, при составлении формул учитываем валентности (см. ТР)
3Na2O (нэ) + 2H3PO4 (р) -> 2Na3PO4 (р) + 3H2O (мд), где нэ — неэлектролит, на ионы не диссоциирует,
мд — малодиссоциирующее вещество, на ионы не раскладываем, вода — признак необратимости реакции
2. Составляем полное ионное уравнение:
3. Сокращаем одинаковые ионы и получаем краткое ионное уравнение:
3Na2O + 6H + -> 6Na + + 3H2O
Сокращаем коэффициенты на три и получаем:
Na2O + 2H + -> 2Na + + H2O
Данная реакция необратима, т.е. идёт до конца, так как в продуктах образуется малодиссоциирующее вещество вода.
VI. Задания для самостоятельной работы
Задание №1. Посмотрите следующий эксперимент:
Составьте уравнение реакции ионного обмена карбоната натрия с серной кислотой в молекулярном, полном и кратком ионном виде.
Задание №2. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
Задание №3. Посмотрите следующий эксперимент:
Составьте уравнение реакции ионного обмена хлорида бария с сульфатом магния в молекулярном, полном и кратком ионном виде.
Задание №4. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
Как составлять уравнения ионных реакций
Знания, необходимые для составления уравнений ионных реакций:
- умение отличать электролит от неэлектролита;
- умение составлять уравнения диссоциации электролитов;
- умение устанавливать значение зарядов ионов.
Таблица растворимости:
Таблица электрохимического ряда напряжений металлов:
В ионных уравнениях химические формулы веществ записывают в двух видах — в виде ионов, либо в виде молекул. Возникает естественный вопрос, — когда то или иное вещество надо записывать в виде иона или молекулы?
В виде ионов записывают формулы следующих веществ:
- сильные кислоты: H2SO4, HNO3, HI. ;
- сильные основания: KOH, NaOH, Ba(OH)2. ;
- растворимые в воде соли: KNO3, BaCl2, NaBr.
В виде молекул записывают формулы следующих веществ:
В случае, если среди продуктов реакции имеются нерастворимые или малорастворимые вещества (осадок), возле таких веществ ставят стрелку вниз (↓). Газообразные и летучие соединения соответственно обозначаются стрелкой, направленной вверх (↑).
Алгоритм составления уравнения ионных реакций
- Записать уравнение в молекулярной форме:
- В тех случаях, когда реакция идет не до конца, у продуктов реакции, выпадающих в осадок или выделяющихся в виде газа, ставят стрелку:
- Записывают уравнение в ионном виде для тех веществ, которые диссоциируют на ионы, с указанием их зарядов:
- Определяют наличие одинаковых ионов в левой и правой части уравнения — это ионы, не принимающие участия в реакции, поэтому, их можно убрать, такая форма записи ионного уравнения называется сокращенной:
- ионы водорода и металлов имеют положительный заряд;
- ионы гидроксония и кислотных остатков — отрицательный заряд;
- как правило, заряд иона численно равен валентности атома.
Составление молекулярных уравнений по ионным
Теперь рассмотрим обратную задачу — как составить молекулярное уравнение, если известно сокращенное ионное уравнение.
- Дано сокращенное ионное уравнение взаимодействия между фосфором и хлором:
- По таблице Растворимостей (см. выше) подбираем соответствующие вещества, содержащие нужный катион и анион — хлорид натрия (NaCl) и нитрат свинца (II) (Pb(NO3)2);
- Пишем формулы выбранных веществ, которые должны прореагировать:
- Пишем формулы получившихся в результате реакции веществ:
- Осталось расставить стехиометрические коэффициенты, чтобы уравнять кол-во вещества в левой и правой части уравнения:
Реакции обмена в водных растворах электролитов могут протекать до конца (необратимые реакции)) или же одновременно протекать в противоположных направлениях (обратимые реакции).
Условия протекания необратимых реакций:
- образование осадка;
- выделение газа;
- образование малодиссоциирующего вещества (например, воды).
В случае, если в растворе нет ионов, способных связаться между собой, реакция является обратимой, т.е., не протекает до конца.
Пример необратимой реакции с выпадением осадка был приведен выше — взаимодействие хлорида натрия и нитрата свинца (II).
Пример необратимой реакции с выделением газа — взаимодействие карбоната натрия и соляной кислоты:
Пример необратимой реакции с образованием воды — взаимодействие гидроксида калия и азотной кислоты:
Пример обратимой реакции взаимодействия слабого электролита (CH3COOH) и нерастворимого основания (Cu(OH)2):
Если в реакцию вступают сильные электролиты, не дающие в результате взаимодействия малорастворимых или малодиссоциирующих веществ, то такие реакции не протекают — в растворе образуется смесь ионов, которые никак не взаимодействуют друг с другом:
Левая и правая части уравнения содержат абсолютные одинаковые ионы, которые можно сократить, поэтому никакой реакции не происходит.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
http://kardaeva.ru/89-dlya-uchenika/9-klass/140-reaktsii-ionnogo-obmena-i-usloviya-ikh-protekaniya
http://prosto-o-slognom.ru/chimia/04_uravnenie_ionnoj_reaktsii.html