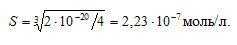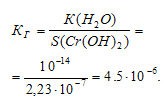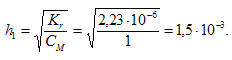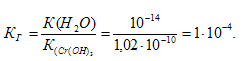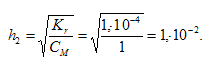Как определяется степень гидролиза изомолярного раствора соли
Задача 1105.
Каково соотношение степеней гидролиза для изомолярных растворов СrCl2 (h1) и СгСI3 (h2): а) h1 > h2; 6) h1 = h2; в) h1 . 10 -20 ;
КД[Сr(ОН)3] = 1,02 . 10 -10 .
а) Рассчитаем растворимость Сr(ОН)2:
ПР[Сr(ОН)2] = [Cr 2+ ] . [OH – ] = S . (2S) 2 = 4S 3 ;
Константа гидролиза будет определяться растворимостью образовавшегося Сr(ОН)2 и определяется по формуле:
Степень гидролиза определяется по формуле:
б) Константа гидролиза определяется константой диссоциации образовавшегося основания Сr(ОН)3 и определяется по формуле:
Степень гидролиза определяется по формуле:
Как можно уменьшить степень гидролиза соли
Задача 1106.
Как уменьшить степень гидролиза SnCl2: а) нагреть раствор; б) добавить кислоту; в) уменьшить рН раствора?
Решение:
SnCl2 – соль слабого основания [(Sn(OH)2] и сильной кислоты (HCl), поэтому гидролизуется по катиону. С учетом того, что гидролиз в основном протекает по первой ступени, уравнение гидролиза можно представить уравнением:
Sn 2+ + H2O — Sn(OH) + + H +
Следовательно, раствор соли SnCl2 имеет кислую реакцию среды (рН
а) Диссоциация воды есть процесс эндотермический, то есть сопровождается поглощением тепла: Н2О = Н + + ОН – – 55,835 кДж/моль. Следовательно по принципу Ле-Шателье, повышение температуры благоприятствует процессу диссоциации воды, то есть с повышением температуры концентрация ионов Н+ и ОН– возрастает, а следовательно, возрастает величина ионного произведения воды. Если нагреть раствор SnCl2, то равновесие сместится вправо, т.е. усилится гидролиз.
б) При добавлении кислоты в растворе SnCl2 увеличится содержание ионов Н + , что будет подавлять гидролиз, смещая равновесие гидролиза влево.
в) По принципу Ле-Шателье уменьшение концентрации ионов водорода при уменьшении его рН сместит равновесие влево, т.е. уменьшит гидролиз. Чтобы усилить гидролиз, нужно увеличить рН раствора, т.е. нужно добавить сильную щелочь, связывающую ионы водорода.
Гидролиз метасиликата натрия
Na2SiO3 — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
Первая стадия (ступень) гидролиза
Молекулярное уравнение
Na2SiO3 + HOH ⇄ NaHSiO3 + NaOH
Полное ионное уравнение
2Na + + SiO3 2- + HOH ⇄ Na + + HSiO3 — + Na + + OH —
Сокращенное (краткое) ионное уравнение
SiO3 2- + HOH ⇄ HSiO3 — + OH —
Вторая стадия (ступень) гидролиза
Молекулярное уравнение
NaHSiO3 + HOH ⇄ H2SiO3 + NaOH
Полное ионное уравнение
Na + + HSiO3 — + HOH ⇄ H2SiO3 + Na + + OH —
Сокращенное (краткое) ионное уравнение
HSiO3 — + HOH ⇄ H2SiO3 + OH —
Среда и pH раствора метасиликата натрия
В результате гидролиза образовались гидроксид-ионы (OH — ), поэтому раствор имеет щелочную среду (pH > 7).
Кремниевая кислота слабее угольной. Запишите уравнения гидролиза карбоната и силиката натрия и возможные значения рН среды при равных
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,289
- гуманитарные 33,621
- юридические 17,900
- школьный раздел 607,151
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
http://chemer.ru/services/hydrolysis/salts/Na2SiO3
http://www.soloby.ru/996098/%D0%BA%D1%80%D0%B5%D0%BC%D0%BD%D0%B8%D0%B5%D0%B2%D0%B0%D1%8F-%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F-%D0%B3%D0%B8%D0%B4%D1%80%D0%BE%D0%BB%D0%B8%D0%B7%D0%B0-%D0%BA%D0%B0%D1%80%D0%B1%D0%BE%D0%BD%D0%B0%D1%82%D0%B0-%D0%B2%D0%BE%D0%B7%D0%BC%D0%BE%D0%B6%D0%BD%D1%8B%D0%B5-%D0%B7%D0%BD%D0%B0%D1%87%D0%B5%D0%BD%D0%B8%D1%8F