Изменения состояния вещества
Содержание:
Переход из одного агрегатного состояния в другое (при постоянном давлении) происходит при строго определённой температуре и всегда связан с выделением или поглощением некоторого количества тепла. Переход вещества из одного состояния в другое происходит не мгновенно, а в течении некоторого времени, когда два состояния вещества существуют одновременно в тепловом равновесии.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Изменения состояния вещества
Агрегатное состояние — состояние какого-либо вещества, имеющее определенные свойства: способность сохранять форму и объем, иметь дальний или ближний порядок и другие. При изменении агрегатного состояния вещества происходит изменение физических свойств, а также плотности, энтропии и свободной энергии.
Физические и химические явления
Вокруг нас постоянно происходят различные изменения с веществами: вода испаряется или затвердевает, осенью меняется окраска листьев у растении (разрушается хлорофилл). Эти изменения с веществами называются явлениями.
Физическими явлениями называют такие явления, при которых не происходит превращения одних веществ в другие.
Например, при переходе в газообразное состояние молекулы воды практически не изменяются и находятся на большом расстоянии (рис. 6).
Рис. 6. Испарение воды
Явления, в результате которых из одних веществ образуются другие, называются химическими явлениями, или химическими реакциями.
При химических явлениях происходит разрушение структурных частиц веществ, вступающих в реакцию, и образование новых структурных частиц, а следовательно, новых веществ.
При горении водорода в кислороде разрушаются молекулы водорода и кислорода, в результате перегруппировки атомов образуются молекулы воды (рис. 7). Метод получения сложных веществ из более простых называется синтезом (от греч. «соединять»).
Рис. 7. Образование молекулы воды
При горении угля в кислороде (рис. 8) атомы кислорода из молекул кислорода соединяются с атомами углерода и образуются молекулы углекислого газа.
Рис. 8. Горение угля
С помощью химических явлений (химических реакций) можно получать из одних веществ другие. Это — металлы, их сплавы, пластмассы, синтетические волокна, краски, лекарства, минеральные удобрения, взрывчатые вещества и др.
Сложные биохимические процессы, протекающие в живых организмах растении и человека, также связаны с различными химическими превращениями.
Обрабатывая металлы, пластмассы, стекла, волокна, можно получать различные предметы. Существует много видов обработки материалов: прокат, штамповка, литье, резание, шитье, приклеивание и многое др. Это физические явления. Физические и химические явления взаимосвязаны и играют важную роль в природе.
Кто из нас не наблюдал явления, происходящего при обрабатывании пореза раствором пероксида водорода? При попадании на кровоточащую ранку пероксид вскипает, что свидетельствует об образовании газа, а это, как вам известно, является признаком химической реакции.
Это интересно
Приготовление пищи является эндотермической реакцией, а фейерверк — экзотермической реакцией.
Знаешь ли ты?
Запах мокрой земли, который мы чувствуем после дождя, — это органическое вещество геосмин, которое вырабатывают живущие на поверхности земли цианобактерии и актинобактерии.
Любая химическая реакция сопровождается внешними признаками, по которым мы и судим о ее протекании; поглощение или выделение теплоты (иногда света), изменение окраски, появление запаха, выделение газа, образование осадка.
Признаки химических реакций
Изменение цвета. Часто химические реакции сопровождаются изменением цвета. Например, если разложить малахит, то получится черное вещество оксид меди и бесцветный углекислый газ. К примеру, каждый из вас наблюдал появление бурой ржавчины на серых стальных изделиях. В обоих случаях наблюдается изменение цвета веществ.
Осаждение. В некоторых химических реакциях появляется твердое вещество, называемое осадком (изображается 
Выделение или поглощение теплоты. В ходе протекания многих реакций происходит выделение теплоты или поглощение теплоты.
Выделение газов. В ходе некоторых реакции происходит газообразование (изображают 
Условия возникновения и течения химических реакций
Что нужно сделать, чтобы началась химическая реакция?
Прежде всего необходимо привести в тесное соприкосновение реагирующие вещества. Чем более измельчены вещества, тем теснее соприкасаются их частички, тем легче идет реакция между ними. Кусок сахара трудно зажечь, а тонко измельченный сахар на воздухе сгорает мгновенно, со взрывом (взрывы сахарной пыли происходят иногда на сахарных заводах). При растворении происходит тонкое дробление. Поэтому многие реакции проводят в растворах.
В некоторых случаях соприкосновения веществ, например железа с влажным воздухом, достаточно, чтобы происходила реакция. Но так бывает не всегда.
Например, медь не вступает в реакцию с кислородом воздуха при невысокой температуре около 20—25°С. Чтобы вызвать реакцию соединения меди с кислородом, нам пришлось бы прибегнуть к нагреванию.
На возникновение и течение химических реакций нагревание влияет по-разному. Для одних реакции требуется непрерывное нагревание. Прекращается нагревание — прекращается и химическая реакция. Это мы можем наблюдать на примере разложения сахара.
В других случаях нагревание требуется лишь для возникновения реакции, дает ей как бы толчок, а дальше реакция течет сама собой. Так происходит при горении древесины и других горючих веществ.
Таким образом, для протекания химических реакций необходимы следующие условия: соприкосновение веществ, измельчение (растворение) веществ, нагревание, применение ускорителей реакции, освещение веществ.
Изучение физических и химических явлений
Для ознакомления с физическими и химическими явлениями возьмем кусочек сахара и металлическую ложку. Вначале поместим сахар в ложку и нагреем его на пламени газовой горелки, сахар расплавится — произошло физическое явление. Если сахар продолжать нагревать, он станет коричневым — произошло химическое явление. Именно так получают карамель.
Самое важное
Различают два вила явлении: физические и химические. При физическом явлении меняются агрегатное состояние, форма вещества, а при химическом явлении происходит превращение одного вещества в другое. Химическое явление называется химической реакцией. Признаки химической реакции: появление осадка, выделение газа, выделение или поглощение тепла (энергии), появление запаха, изменение цвета вещества.
Агрегатные состояния вещества
Нас окружают различные тела. Они состоят из различных веществ. Мельчайшей частицей вещества является молекула этого вещества, она обладает всеми его химическими свойствами. Каждое конкретное вещество состоит из собственных молекул: вода — из молекул воды, кислород — из молекул кислорода. Вещества в обычных условиях находятся в различных состояниях: вода — жидкость, кислород — газ, поваренная соль — твердое. Эти состояния — твердое, жидкое и газообразное — называют агрегатными состояниями вещества. А каковы основные особенности молекулярного строения твердого, жидкого и газообразного тел? Какими свойствами будет обладать вещество в зависимости от особенностей его молекулярной структуры?
Достанем из холодильника заранее подготовленный кусочек льда, переложим его в прозрачную термостойкую посуду, начнем разогревать. В процессе мы увидим, что при нагревании лед постепенно тает, превращаясь в воду, — переходит из твердого состояния в жидкое. Этот процесс называется плавлением . Если жидкость довести до кипения и покипятить несколько минут, ее объем в колбе уменьшится. Этот процесс называется кипением. Куда делась вода? Она превратилась в пар, невидимый для глаза. Если дома оставить чашку с водой на столе, то вода также превратится в пар и без кипячения — этот процесс называется испарением, он более длительный. Когда в природе вода испаряется, мы наблюдаем образование облаков и тумана. Водяной пар — это еще одно из трех состоянии воды. Вода в обычных условиях может существовать в твердом, жидком и газообразном состоянии одновременно. Различные агрегатные состояния существуют практически у любого вещества, только наблюдать их бывает достаточно сложно.
Любое вещество, состоящее из атомов или молекул, в зависимости от условий может находиться в одном из трех агрегатных состояний: твердом, жидком, газообразном (рис. 9). Вещества могут переходить из одного агрегатного состояния в другое, и на практике это широко используется.
Рис. 9. Агрегатные состояния вещества: а — твердое; б — жидкое; в — газообразное
Молекулы любого вещества не изменяются при переходе этого вещества из одного агрегатного состояния в другое. Молекула воды в любом состоянии не изменится ни по размеру, ни по составу, также и молекула кислорода, и любая другая. Строение вещества определяется не только взаимным расположением атомов в молекулах, но и расположением этих частиц в пространстве.
Что же отличает одно агрегатное состояние вещества от другого?
Каковы особенности строения газов, жидкостей и твердых веществ?
Твердое состояние вещества
Частицы твердого вещества расположены близко друг к другу, расстояние между ними сравнимо с размером молекул. Атомы прочно связаны друг с другом и очень плотно упакованы. Они не могут удаляться друг от друга и лишь совершают небольшие колебательные движения. Вещество, находящееся в твердом состоянии, имеет наибольшую плотность, а также сохраняет объем и форму (рис. 10а).
Жидкое состояние вещества
Жидкое состояние вещества — промежуточное между твердым и газообразным. Молекулы подвижны, поэтому жидкости не сохраняют форму: они могут течь, их легко перелить (рис. 10б). Но сжать их трудно, так как при этом молекулы сближаются и между ними возникает отталкивание.
Жидкости сохраняют объем, но не сохраняют форму, принимая форму сосуда, в котором находятся.
Так, если мы возьмем литр молока или воды и перельем его из кувшина в банку, то молока в банке будет опять же литр, но оно примет уже другую форму — форму банки.
Газообразное состояние вещества
Расстояние между молекулами газа во много раз больше самих молекул, они почти не притягиваются и свободно движутся. Поэтому газы заполняют весь предоставленный объем, не имеют формы и легко сжимаются.
Рис. 10. Расположение молекул веществ: а — твердое; б — жидкое; в — газообразное
Молекулы газов движутся с огромными скоростями. Опыт с одеколоном при наблюдении явления диффузии доказывает нам это.
Скорости газов зависят не только от того, какой это газ, но и от температуры. При увеличении температуры скорости возрастают (рис. 10в).
Изменение агрегатных состояний вещества
Но как из одного состояния вещества получить другое? Нужно создать для такого перехода определенные условия.
Так. для того чтобы лед растаял, необходимо сначала нагреть его до температуры плавления льда — 0°С. Мы можем увидеть, как лед, который мы достали из холодильника, не сразу стал таять — это значит, что его начальная температура была ниже 0°С, поэтому мы его нагревали до указанной температуры. Чтобы быстро превратить воду в пар, ее необходимо вскипятить, так как вода кипит при температуре 100°С.
У каждого вещества своя температура плавления и кипения. Например, кислород переходит из твердого состояния в жидкое при -218°С, но самая низкая температура плавления у гелия (-272°С). Самым тугоплавким металлом является вольфрам, прежде чем он начнет плавиться, его необходимо нагреть до 3410°С. Самым легкоплавким из металлов является ртуть (-39°С) (табл. 2).
Температура плавления и кипения веществ
| Вещество | Температура плавления, °С | Температура кипения, °С |
| Гелий | -272 | -269 |
| Кислород | -218 | -183 |
| Вода | 0 | 100 |
| Алюминий | 660 | 2467 |
| Вольфрам | 3410 | 5555 |
Если рассмотреть температуры кипения некоторых веществ, то мы увидим, что рекорд опять удерживает гелий, при температуре -269°С он из жидкого состояния превратится в газ, азот — при -196°С, а кислород — при -183°С. Поскольку достичь таких низких температур очень трудно и в природных условиях таких температур не бывает, мы с вами все эти вещества встречаем в газообразном состоянии.
Самая высокая температура кипения у вольфрама — 5555°С.
Плазма
Имеется еще и четвертое состояние вещества, которое физики склонны относить к числу агрегатных. При особых условиях вещество может находиться в плазменном состоянии. Плазма — наиболее распространенное состояние вещества в природе. Солнце, большинство звезд, туманности — это плазма. Верхняя часть земной атмосферы — ионосфера — тоже представляет собой плазму. Полярные сияния, молнии, в том числе и шаровые, — все это виды плазмы. В технике применяют плазму, например, в люминесцентных лампах.
Все процессы перехода вещества из одного состояния в другое носят определенные названия. Таких процессов шесть (схема 4).
Процесс, когда вещество из твердого состояния переходит в жидкое, называется плавлением.
Процесс перехода «жидкость—твердое вещество» называется кристаллизацией.
Процесс перехода вида «жидкость—газ» называется парообразованием.
Обратный процесс перехода вида «газ — жидкость» называется конденсацией.
Иногда бывает так, что вещество из твердого состояния сразу переходит в газ, минуя жидкую фазу. Процесс перехода из твердого состояния в газообразное называется сублимацией, или возгонкой. Любое вещество в твердом состоянии, если оно имеет запах, сублимирует.
Процесс, обратный сублимации, — десублимация.
Знаешь ли ты?
Мы считаем, что у вещества существует три агрегатных состояния. На самом же деле их как минимум пятнадцать, при этом список продолжает расти с каждым днем.
Опыт с пустой закрытой пластиковой бутылкой
Пустую пластиковую бутылку плотно закройте пробкой и поставьте в холодильник. Буквально через минуту вы увидите, что стенки бутылки втянулись вовнутрь, будто кто-то откачал из нее часть воздуха. Почему так произошло? Примет ли бутылка прежнюю форму, если ее вынуть из холодильника?
| Металлы с наибольшей плотностью | |
| Металлы |  |
| 1. Осмий | 22.59 |
| 2. Придий | 22.56 |
| 3. Платина | 21.45 |
| 4. Рений | 21.01 |
| 5. Нептуний | 20.47 |
| 6. Плутоний | 20.26 |
| 7. Золото | 19.32 |
| 8. Вольфрам | 19.26 |
| 9. Уран | 19.05 |
| 10. Тантал | 16.67 |
| Наиболее низкие температуры плавления | |
| Вещество |  |
| 1. Гелий | -272 |
| 2. Водород | -259 |
| 3. Неон | -249 |
| 4. Фтор | -220 |
| 5. Кислород | -218 |
| 6. Азот | -210 |
| 7. Аргон | -189 |
| 8. Криптон | -157 |
| 9. Ксенон | -112 |
| 10. Хлор | -101 |
Самое важное
Агрегатные состояния вещества — твердое, жидкое и газообразное. Различные агрегатные состояния существуют практически у любого вещества, только наблюдать их бывает достаточно сложно. Молекулы твердых веществ расположены близко друг к другу. Твердые вещества сохраняют форму и объем. Молекулы жидких веществ подвижны. Жидкости не сохраняют форму, они могут течь, их легко перелить, но они сохраняют объем, принимая форму сосуда, в котором находятся. Расстояние между молекулами газа во много раз больше их самих. Молекулы газа свободно движутся и заполняют весь объем, не имеют форму и легко сжимаются.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Основные агрегатные состояния вещества
О чем эта статья:
Агрегатные состояния вещества
Чтобы разобраться с тем, какими бывают агрегатные состояния, предлагаю по ходу чтения статьи заполнять таблицу.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
Лед, вода и водяной пар — это все три агрегатных состояния одного вещества. Лед — твердое состояние, вода — жидкая, пар — газообразное. Для каждого вещества существует три состояния.
Твердое состояние
Его очень легко представить — это любой предмет, который мы встречаем в жизни. В этом состоянии тело сохраняет форму и объем. Расстояние между молекулами, приблизительно равно размеру самих молекул, которые, в свою очередь, расположены очень структурированно.
Такая структура называется кристаллической решеткой — из-за четкой структуры молекулам сложно двигаться, и они просто колеблются около своих положений равновесия.
Заполняем нашу табличку
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
Жидкое состояние
В этом состоянии сохраняется объем, но не сохраняется форма. Например, если перелить молоко из кувшина в стакан, то молоко, имевшее форму кувшина, примет форму стакана. Кстати, в корове у молока тоже была другая форма.
Расстояние между молекулами в жидком состоянии чуть больше, чем в твердом, но все равно невелико. При этом частицы не собраны в кристаллическую решетку, а расположены хаотично. Молекулы почти не двигаются, но при нагревании жидкости делают это более охотно.
Вспомните, что происходит, если залить чайный пакетик холодной водой — он почти не заваривается. А вот если налить кипяточку — чай точно будет готов.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
Газообразное состояние
В жизни мы встречаем газообразное состояние вещества, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (он занимает весь предоставленный ему объем), состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
занимают предоставленный объем
больше размеров молекул
хаотичное и непрерывное
С агрегатными состояниями разобрались, ура! Но до сих пор неясно, каким образом у каждого вещества их целых три, и как одно переходит в другое. Для этого узнаем, что такое фазовые переходы.
Фазовые переходы: изменение агрегатных состояний вещества
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Фазовые переходы интересны тем, что все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы металлургии и микроэлектроники.
На схеме — названия всех фазовых переходов:
Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
График фазовых переходов
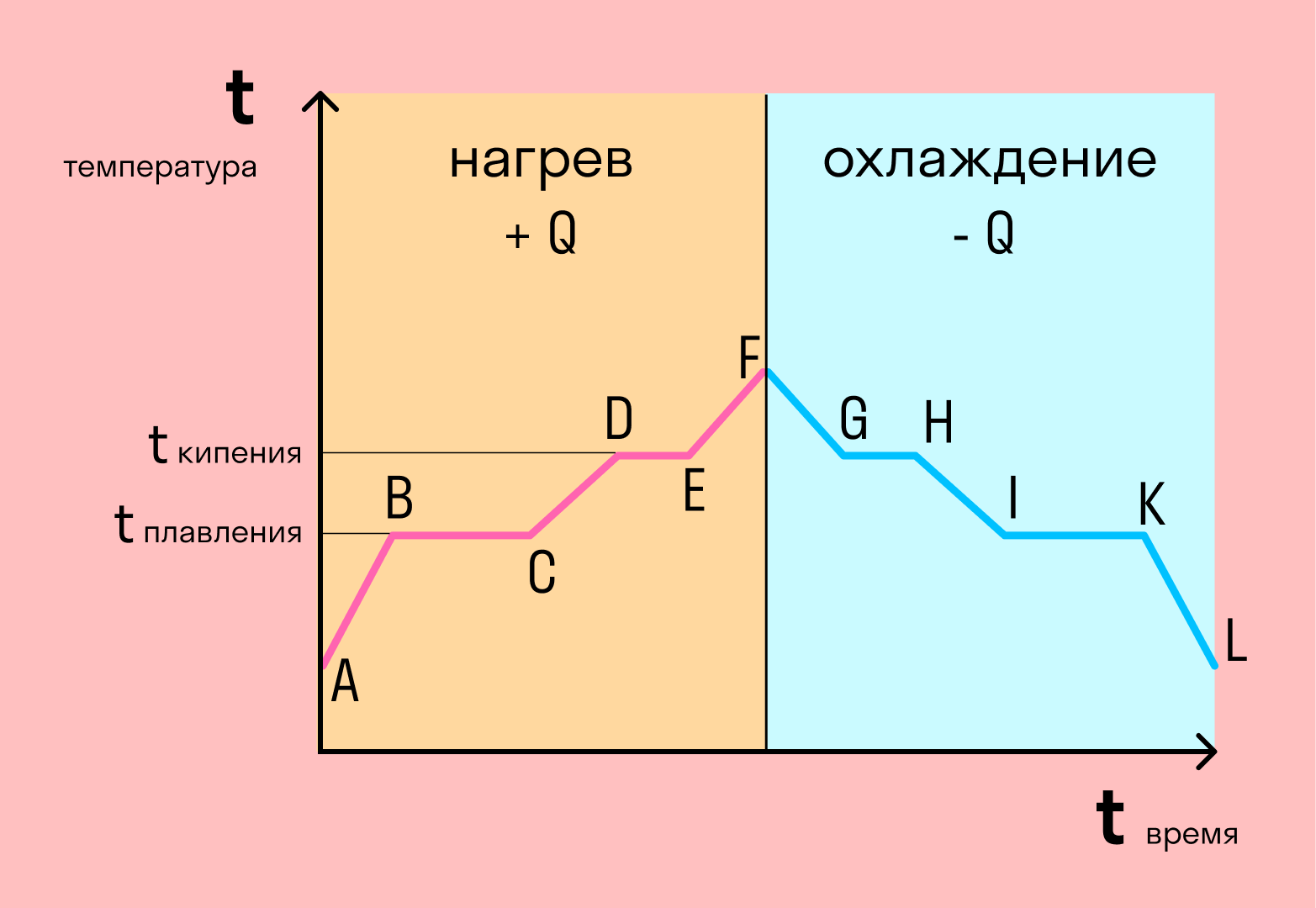
Если взять процесс превращения льда в воду, воды — в пар, и обратные действия, то мы получим очень информативный график.
Разбираемся по шагам.
- AB — нагревание льда
Сначала взяли лед, конечно, при отрицательной температуре, потому что при нуле лед начинает плавиться. Нагрели лед до температуры плавления (до 0 градусов Цельсия).
- BC — плавление льда
После того, как лед нагрелся до температуры плавления, он начинает плавиться. В точке B это еще лед, а в точке C — уже вода. Плавление происходит при постоянной температуре и тем дольше длится, чем больше масса плавящегося вещества. Еще этот процесс зависит от свойств самого вещества, но об этом немного позже.
- CD — нагревание воды
Расплавленное вещество уже в жидком состоянии снова начинает нагреваться, и температура увеличивается, пока не достигает температуры кипения. В данном случае нагревается вода — это значит, что ее температура кипения равна 100 градусам Цельсия.
- DE — кипение (парообразование) воды
При 100 градусах вода кипит, пока не выкипит целиком. В данном случае процесс, как и плавление, происходит при постоянной температуре. Но парообразование нельзя путать с испарением, потому что парообразование происходит при конкретной температуре, а испарение — при любой .
- EF — нагревание пара
Далее полученный пар нагревается, но путем нагревания невозможно дойти до другого фазового перехода — можно пойти только обратно.
- FG — охлаждение пара
Первый шаг в обратную сторону — охлаждение до температуры кипения.
- GH — конденсация пара
Дойдя до температуры кипения (в данном случае 100 градусов), пар начинает переходить в жидкое состояние. Этот процесс также происходит при постоянной температуре.
- HI — охлаждение воды
Сконденсировавшись, вода охлаждается, пока не начнет замерзать.
- IK — кристаллизация воды
Кристаллизуется (замерзает) вода при той же температуре, что и плавится лед — 0 градусов. Кристаллизация также происходит при постоянной температуре.
- KL — охлаждение льда
После кристаллизации лед охлаждается.
С нагреванием и охлаждением все совсем просто — мы либо передаем теплоту телу (веществу), и оно идет на увеличение температуры, либо тело отдает тепло и охлаждается.
В остальных процессах температура не меняется. Это связано с тем, что количество теплоты не всегда зависит от температуры. Формулы для всех процессов выглядят так:
Нагревание
Охлаждение
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг · ˚C]
m — масса [кг]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Плавление
Кристаллизация
Q — количество теплоты [Дж]
λ — удельная теплота плавления вещества [Дж/кг]
m — масса [кг]
Парообразование
Конденсация
Q — количество теплоты [Дж]
L — удельная теплота парообразования вещества [Дж/кг]
m — масса [кг]
Онлайн-уроки физики в Skysmart не менее увлекательны, чем наши статьи!
Решение задач по фазовым переходам
С теорией разобрались — а теперь давайте практиковаться!
Задачка раз. Температура медного образца массой 100 г повысилась с 20 °С до 60 °С. Какое количество теплоты получил образец? Удельную теплоёмкость меди считать равной 380 Дж/(кг · °С)
Сначала нужно перевести массу в килограммы:
Берем формулу количества теплоты для нагревания вещества:
Q = 380 · 0,1 · (60 − 20) = 1520 Дж
Ответ: образец получил 1520 Дж
Задачка два. Какое количество теплоты необходимо для плавления 2,5 т стали, взятой при температуре плавления? Удельная теплота плавления стали λ = 80 кДж/кг. Теплопотерями пренебречь.
Сначала нужно перевести массу в килограммы и удельную теплоту в Дж/кг:
80 кДж/кг = 80 000 Дж/кг
Берем формулу количества теплоты для плавления вещества:
Q = 80 000 · 2500 = 200 000 000 Дж = 200 МДж
Ответ: для плавления 2,5 т стали необходимо 200 МДж теплоты.
Сублимация и десублимация
Мы уже рассказали про такие процессы, как сублимация и десублимация.
- Переход из твердого состояния в газообразное, минуя жидкое — сублимация (возгонка);
- Переход из газообразного состояния в твердое, минуя жидкое — десублимация.