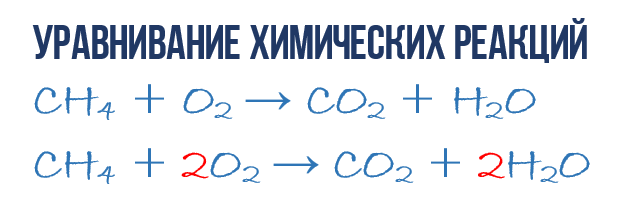Урок химии 10 класса на тему «Вычисления по уравнениям реакций, протекающих в растворах»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Тема: Вычисления по уравнениям реакций, протекающих в растворах
Цель: формировать умение решать расчетные задачи по уравнениям реакций, протекающих в растворах.
-создать условия для закрепления и развития умений решения расчетных задач изученных типов ;
-совершенствовать умения записывать уравнения химических реакций, решать цепочки химических превращений;
— обобщение и систематизация изученного материала по темам «Спирты. Альдегиды. Фенолы. Карбоновые кислоты»
-содействовать формированию коммуникативных навыков и развитию познавательного интереса к возможностям практического применения знаний
Тип урока : комбинированный
Приветствие, проверка готовности к уроку
2.Проверка домашнего задания (устный опрос у доски)
3.Целеполагание и актуализация знаний:
-Объявление темы и постановка цели урока;
-вспомните формулы, которые использовались вами при решении расчетных задач по теме «растворы» (запись формул на доске, их фронтальное обсуждение)
4.Этап формирования умений решения расчетных задач (самостоятельная групповая работа по решению практико-ориентированных задач)
№1. Этиленгликоль хорошо растворяется в воде, при этом он сильно понижает температуру замерзания воды (60%-й раствор этиленгликоля понижает температуру замерзания до -49 0 С), что позволяет использовать его в качестве жидкости для очистки стекол автомобилей. Определите, какие массы этиленгликоля и воды понадобятся для приготовления 8кг данного раствора. Чему будет равна молярная концентрация этого раствора, если его плотность составляет 1,004г/см 3
№2 . Многие считают, что небольшие количества алкоголя не вредят. Но это не так. Поскольку этанол легко растворяется в воде, он сразу же поглощается пищеварительными органами и разносится кровью по всему телу (в том числе и в ткани мозга). Около 90% этанола задерживается в печени. Определите, какое количество этанола можно получить при сбраживании 20кг 70% раствора глюкозы.
№3 .Раствор с массовой долей тринитроглицерина 1% используется в медицине в качестве средства для расширения сосудов сердца. Определите, какие массы глицерина и азотной кислоты понадобятся для получения 500г этого раствора.
№4 .Динамит—это взрывчатая смесь тринитроглицерина с кизельгуром, была изобретена шведским химиком А.Нобелем. Динамит взрывается с выделением большого количества газов, вызывающих сильную ударную волну, и большого количества теплоты. Определите массу тринитроглицерина, которую можно получить из 2т 60% раствора глицерина, если выход продукта составляет 98%.
№5. При уксуснокислом брожении этанола под действием ферментов образуется уксусная кислота, которая затем используется в пищевых целях (столовый уксус—9%-й раствор уксусной кислоты в воде). Рассчитайте, какую массу уксусной кислоты можно получить из 0,5кг раствора с массовой долей этанола 70%, если выход продукта реакции равен 85%.
5.Обобщение и систематизация (групповая работа)
Выполнение задания №2
6.Домашнее задание: §36, №1,3
7.Подведение итогов. Рефлексия
Тема: Вычисления по уравнениям реакций, протекающих в растворах
№1. Этиленгликоль хорошо растворяется в воде, при этом он сильно понижает температуру замерзания воды (60%-й раствор этиленгликоля понижает температуру замерзания до -49 0 С), что позволяет использовать его в качестве жидкости для очистки стекол автомобилей. Определите, какие массы этиленгликоля и воды понадобятся для приготовления 8кг данного раствора. Чему будет равна молярная концентрация этого раствора, если его плотность составляет 1,004г/см 3
№2 . Многие считают, что небольшие количества алкоголя не вредят. Но это не так. Поскольку этанол легко растворяется в воде, он сразу же поглощается пищеварительными органами и разносится кровью по всему телу (в том числе и в ткани мозга). Около 90% этанола задерживается в печени. Определите, какое количество этанола можно получить при сбраживании 20кг 70% раствора глюкозы.
№3 .Раствор с массовой долей тринитроглицерина 1% используется в медицине в качестве средства для расширения сосудов сердца. Определите, какие массы глицерина и азотной кислоты понадобятся для получения 500г этого раствора.
№4 .Динамит—это взрывчатая смесь тринитроглицерина с кизельгуром, была изобретена шведским химиком А.Нобелем. Динамит взрывается с выделением большого количества газов, вызывающих сильную ударную волну, и большого количества теплоты. Определите массу тринитроглицерина, которую можно получить из 2т 60% раствора глицерина, если выход продукта составляет 98%.
№5. При уксуснокислом брожении этанола под действием ферментов образуется уксусная кислота, которая затем используется в пищевых целях (столовый уксус—9%-й раствор уксусной кислоты в воде). Рассчитайте, какую массу уксусной кислоты можно получить из 0,5кг раствора с массовой долей этанола 70%, если выход продукта реакции равен 85%.
Тема: Вычисления по уравнениям реакций, протекающих в растворах
№1. Этиленгликоль хорошо растворяется в воде, при этом он сильно понижает температуру замерзания воды (60%-й раствор этиленгликоля понижает температуру замерзания до -49 0 С), что позволяет использовать его в качестве жидкости для очистки стекол автомобилей. Определите, какие массы этиленгликоля и воды понадобятся для приготовления 8кг данного раствора. Чему будет равна молярная концентрация этого раствора, если его плотность составляет 1,004г/см 3
№2 . Многие считают, что небольшие количества алкоголя не вредят. Но это не так. Поскольку этанол легко растворяется в воде, он сразу же поглощается пищеварительными органами и разносится кровью по всему телу (в том числе и в ткани мозга). Около 90% этанола задерживается в печени. Определите, какое количество этанола можно получить при сбраживании 20кг 70% раствора глюкозы.
№3 .Раствор с массовой долей тринитроглицерина 1% используется в медицине в качестве средства для расширения сосудов сердца. Определите, какие массы глицерина и азотной кислоты понадобятся для получения 500г этого раствора.
№4 .Динамит—это взрывчатая смесь тринитроглицерина с кизельгуром, была изобретена шведским химиком А.Нобелем. Динамит взрывается с выделением большого количества газов, вызывающих сильную ударную волну, и большого количества теплоты. Определите массу тринитроглицерина, которую можно получить из 2т 60% раствора глицерина, если выход продукта составляет 98%.
№5. При уксуснокислом брожении этанола под действием ферментов образуется уксусная кислота, которая затем используется в пищевых целях (столовый уксус—9%-й раствор уксусной кислоты в воде). Рассчитайте, какую массу уксусной кислоты можно получить из 0,5кг раствора с массовой долей этанола 70%, если выход продукта реакции равен 85%.
Органическая химия в уравнениях реакций
«Шпаргалки. Химия» — это краткие изложения основных вопросов по курсу органической химии за 10 класс , которые можно использовать для повторения и закрепления пройденного материала по органической химии при подготовке к ЕГЭ Весь материал можно распечатать в виде шпаргалок.
Просмотр содержимого документа
«Органическая химия в уравнениях реакций»
Реакции к основным темам курса 10 класса (для запоминания), проф. класс.
2. р. нитрования – р. Коновалова (р. замещения, радик. мех-зм): R-Н +НО – NО2(разб) −→R—NО2 +Н2 внимание: замещение атомов водорода у третичного атома (—с—) проходит легче, чем у вторичного атома(—с—) и тем более первичного атома (с—).
. р. окисления метана ( +[О]) даёт продукты, в зависимости от условий:
2. р. замещения – аналогично алканам (циклы с 6 и атомами углерода);
5. Алкины (непредельные). Общая формула – СпН2п-2. М (СпН2п-2)= (14п-2) г/моль, σ- и 2π-связи, SP-гибридизация, линейное строение обладают слабыми кислотными свойствами
только ацетилен СН≡СН + НОН →СН3-СНО — альдегид
при нагревании, в присутствии катализатора – Pt, Pd продолжение см дальше
5.слабые кислотные свойства у алкинов с «концевой» кратной связью:
6
в) алкилирование — р. Фриделя-Крафтса – удлинение цепи атомов углерода
помнить: у гомологов бензола замещение в цикле атомов водорода происходит с равной вероятностью в положении 2, 4, 6 относительно имеющегося радикала в присутствии катализаторов FeBr3 и H2SO4.
б
в
Наличие гидроксогруппы — ОН в молекулах спиртов проявляется в слабых кислотных и основных свойств.
2. слабые основные свойства, возрастающие от первичных к третичным спиртам:
3. р. этерификации – взаимодействие с кислотами и образование сложных эфиров:
а) при t 150 0 С – внутримолекулярная (Н2О отрывается от 1 молекулы):
б) при t 0 С – межмолекулярная (Н2О отрывается от 2 молекул):
Различные классы спиртов дегидратируются при различных условиях:
7. качественные реакции на: а) предельные одноатомные спирты – CuO, t
1. подвижность атома водорода и выраженные кислотные свойства –
3. р. электрофильного замещения протекают легче, чем у аренов:
а) реакция с раствором бромной воды – 1-я качественная реакция на фенолы
в) получение фенолформальдегидной смолы – р. поликонденсации
4. реакция с раствором FeCl3 – 2-я качественная реакция на фенолы
Внимание: водород легко присоединяется по связи С=С и очень трудно – по связи С=О. LiAlH4 восстанавливает связи С=О до С – ОН, не затрагивая связь С=С.
1. Химические свойства отличаются от свойств альдегидов:
а) менее активны в реакциях нуклеофильного присоединения, чем альдегиды (с цианидом водорода в присутствии цианида калия) R – С=О + НСN − KCN → R – C (OH) – C ≡ N;
б) присоединение реактива Гриньяра – R – MqBr с образованием третичного спирта
г) окисление с трудом, не взаимодействуют с соединениями серебра и меди
2. Иодоформный тест – если карбонильная группа связана со 2-ым атомом углерода от конца углеродной цепи (со щелочным раствором иода)
1. Диссоциируют, т.е. являются донором катиона водорода – слабые электролиты, самая сильная из них – муравьиная НСООН
R – СООН ↔ R – СОО — + Н +, сл-но, характерны свойства, типичные для кислот – взаимодействие с Ме, основными оксидами, основаниями и солями слабых кислот.
2. р.замещения группы ОН на хлор, взаимодействие с хлоридом Р(V)
R – СООН + Н – О – СО – R — Р2О5 → R – СО – О – СО — R + Н2О (ангидрид к-ты),
остаток кислоты ↓ остаток спирта
5. получение амидов в реакциях с раствором аммиака, при нагревании
6. р. замещения атома водорода у α–атома (С) на атом брома, в присутствии Ркр
7. р. дегидратации и гидрирование, в присутствии LiAlH4 (см. «альдегиды»)
8.Внимание: муравьиная кислота – самая сильная из органических кислот и сильный восстановитель,
9. Получение: а) из спиртов (окисление, т.е. + [О])
R – СН2 – ОН + [О] → R – СНО (альдегид) и дальше + [О] → R – СООН (кислота);
б) из альдегидов – р. «серебряного и медного зеркала»
6. Сложные эфиры карбоновых кислот. Общая формула – R-С = О
р. гидролиза с Н2О идёт медленно, её катализируют (ускоряют) кислоты и щёлочи
2. р. восстановления, в присутствии LiAlH4 с образованием 2-х спиртов:
особенность: медленная реакция, обратимая, с низким выходом.
Хлорангидриды и ангидриды кислот
Эти два вида производных карбоновых кислот химически очень активны. Хлорангидриды даже более активны, чем ангидриды, и более летучи, что делает обращение с ними очень трудным. Они вступают в быструю реакцию на холоде с водой, аммиаком и с их производными, спиртами и аминами. В каждом случае атом водорода реагирующей молекулы замещается ацильной группой – это реакции ацилирования, а хлорангидриды и ангидриды кислот-ацилирующие агенты. С хлорангидридами:
↑ этот атом водорода замещается на ацильную группу.
С ангидридами кислот:
2. р. восстановления до многоатомных спиртов:
3. синее окрашивание с Си(ОН)2, как у многоатомных спиртов;
4. р. межмолекулярной дегидратации со спиртами: → простые эфиры;
5. р. этерификации с альдегидами → сложные эфиры;
1. Амины обладают основными свойствами, поэтому, как основания,
3. Р. нитрирования (с НО – NО) проходит по-разному:
9. Азотсодержащие соединения – аминокислоты …β α Мr (к-ты) = (14п+75)
Общая формула – R – СН — СООН
1.Аминокислоты обладают амфотерными свойствами, поэтому реагируют:
4. Получение: α- аминокислоты из α-хлорзамещенных карбоновых кислот
Окислительно – восстановительные реакции в органической химии.
Урок 13. Составление химических уравнений
В уроке 13 «Составление химических уравнений» из курса «Химия для чайников» рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
Химическое уравнение
В результате реакции горения метана CH4 в кислороде O2 образуются диоксид углерода CO2 и вода H2O. Эта реакция может быть описана химическим уравнением:
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу CH4 и сколько молекул CO2 и H 2 O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
Начнем с углерода. В левой части один атом С входит в состав молекулы CH4, а в правой части один атом С входит в состав CO2. Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H4 = 4H) в составе молекулы CH4, а в правой – всего 2 атома H в составе молекулы H2O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H2O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H2O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H2O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C7H5N3O6 энергично соединяется с кислородом, образуя H2O, CO2 и N2. Запишем уравнение реакции, которое будем уравнивать:
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C7H5N3O6 + O2 → CO2 + H2O + N2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты, а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро NA=6,022·10 23 , мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O2 с образованием 28 молей CO2, 10 молей H2O и 6 молей N2.
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C 7 H 5 N 3 O 6 = 227,13 г/моль
- O 2 = 31,999 г/моль
- CO 2 = 44,010 г/моль
- H 2 O = 18,015 г/моль
- N 2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO2, 10·18,015 г = 180,15 г H2O и 6·28,013 г = 168,08 г N2. Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO 2 | |
| 671,98 г CO 2 | 180,15 г H 2 O | |
| 168,08 г N 2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO 3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl 2 и диоксида углерода CO 2 :
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2. Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl2 (110,99 г/моль), CO2 (44,01 г/моль) и H2O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H + и Cl — . Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO3 реагирует с двумя гидратированными ионами H + , образуя при этом положительный ион Ca 2+ , CO2 и H2O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений» вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
http://multiurok.ru/files/orghanichieskaia-khimiia-v-uravnieniiakh-rieaktsii.html
http://himi4ka.ru/arhiv-urokov/urok-13-sostavlenie-himicheskih-uravnenij.html