Как записывается электрон в уравнении
3.1.2 Волновое уравнение. Квантовомеханическое объяснение строения атома
Неопределенность установления положения и скорости электрона столь велика, что необходимо вообще отказаться от анализа траектории его движения. Однако есть возможность вероятностного описания строения атома.

m – масса электрона Масса покоя электрона me=9,109 . 10 -31 кг ;
E – полная энергия электрона;
x , y , z – координаты.
Решением уравнения Шредингера является волновая функция Ψ и соответствующее ей значение энергии электрона E. Вероятность нахождения электрона в пространстве характеризуется квадратом волновой функции, т.е. величиной | Ψ | 2 . Для описания строения атома можно рассматривать электрон как бы “размазанным” в пространстве в виде электронного облака. Величина | Ψ | 2 , полученная из волнового уравнения, является мерой электронной плотности в данном элементе объема, или мерой вероятности нахождения электрона в данном элементе объема атома.
Таким образом, в квантовомеханической (вероятностной) модели атома исчезает смысл орбиты, на которой находится электрон. Взамен ее мы имеем дело с электронной плотностью, “размазанной” в пространстве атома. Тело, образованное “размазанным” электроном, называют орбиталью . Обычно под орбиталью понимают часть пространства, заключающую 90% электронного облака.
Наличие трех измерений пространства приводит к тому, что в выражении волновой функции Ψ , являющейся решением уравнения Шредингера, появляются три величины, которые могут принимать только дискретные целочисленные значения – три квантовых числа. Они обозначаются символами n , l и ml . Эти квантовые числа характеризуют состояние электрона не только в атоме водорода, но и в любом другом атоме.
а) Главное квантовое число ( n ) определяет средний радиус электронного облака, или общую энергию электрона на данном уровне. Оно принимает натуральные значения от 1 до ∞ . В реальных атомах n имеет 7 значений, обозначаемых латинскими буквами K, L, M, N, O, P, Q. Значение n=1 отвечает уровню с самой низкой энергией (т.е. наиболее устойчивому состоянию электрона). Теоретически количество уровней не ограничено, но в атоме главным образом бывают заняты электронами уровни с низкой энергией.
б) Побочное, или орбитальное, квантовое число ( l ). В спектрах многоэлектронных атомов наблюдается мультиплетная структура линий, т.е. линии расщеплены на несколько компонент. Мультиплетность линий означает, что энергетические уровни представляют собой совокупности энергетических подуровней, т.к. любой линии в спектре отвечает переход электрона из одного состояния в другое. Энергетические различия в состоянии электронов в данном уровне связаны с различием в форме электронных облаков.
Для характеристики энергетических подуровней используется орбитальное квантовое число l . Оно может принимать в пределах каждого уровня целочисленные значения от 0 до n –1. Таким образом, уровень в зависимости от l подразделяется на подуровни, которые имеют также буквенные обозначения: s ( l=0), p ( l=1), d ( l=2), f ( l=3). Электроны, находящиеся в этих состояниях, называются s -, p -, d — и f-электронами.
Форма s-электронного облака . Это облако обладает сферической симметрией, т.е. имеет форму шара. График волновой функции Ψ расположен по одну сторону от оси абсцисс (рисунок 3.1), т.е. волновая функция s-электрона положительна.
Рисунок 3.1 – График волновой функции s-электрона в зависимости от расстояния до ядра. Форма s-орбитали
Форма p-электронного облака . Для p-электрона при удалении от ядра по некоторому направлению волновая функция имеет перегиб (рисунок 3.2). По одну сторону от ядра Ψ положительна , а по другую – отрицательна (не путать знак волновой функции со знаком электрического заряда!). В начале координат Ψ обращается в нуль. В отличие от s-орбитали , p-орбиталь не обладает сферической симметрией, а имеет форму, напоминающую гантель (рисунок 3.2).
Рисунок 3.2 – График волновой функции p-электрона. Форма p-электронного облака
Знаки “+” и “–” от носятся не к вероятности нахождения электрона (она всегда положительна и равна | Ψ | 2 ), а к волновой функции, которая в разных частях электронного облака имеет различный знак.
Еще более сложную форму имеют электронные облака d — и f-электронов. Например, d-орбитали могут иметь четырехлепестковое строение, причем знаки волновой функции в “лепестках” чередуются:
в) Магнитное квантовое число ( ml ). Если атом поместить во внешнее магнитное поле, то происходит дальнейшее расщепление спектральных линий. Это означает, что при данных значениях n и l может существовать несколько состояний электрона с одинаковой энергией. Такие энергетические состояния называются вырожденными. Вырождение исчезает при воздействии на атом внешнего магнитного поля, что и приводит к появлению новых линий в спектре.
Энергетические изменения под действием магнитного поля объясняются различием в характере расположения электронных облаков в пространстве и, следовательно, их различной ориентацией по отношению к силовым линиям поля. Магнитное квантовое число ml для данного подуровня – это целочисленная величина в диапазоне от – l до + l . Таким образом, при данном l оно имеет (2 l+1) различных значений. Например, для s-подуровня ( l=0) имеется только одно значение ml , равное нулю. Поэтому s-подуровень содержит единственную орбиталь . Для p-подуровня ( l=1) возможны три значения: ml ∈ <–1,0,1>. В соответствии с этим каждый p-подуровень состоит из трех орбиталей гантелеобразной формы, ориентированных перпендикулярно друг другу вдоль трех координатных осей и обозначаемых px , py , pz . Легко определить, что на d-подуровне ( l=2) содержится 2 l+1=5 орбиталей , а на f-подуровне ( l=3) – 7 орбиталей .
На рисунке 3.3 показано постепенное усложнение представлений о структуре электронной оболочки атома (от уровней к подуровням и далее к орбиталям ).
Рисунок 3.3 – Эволюция представлений о строении электронной оболочки атома. Энергетическая диаграмма уровней с 1-го по 3-й
г) Спиновое квантовое число ( ms ) не связано с движением электрона вокруг ядра, а определяет его собственное состояние. Природа этого состояния неизвестна до сих пор. Предполагается, что она связана с вращением электрона вокруг собственной оси «Spin» в переводе с английского — «кружение», «верчение». . Число ms принимает два значения: +1/2 и –1/2.
Для определения состояния электрона в многоэлектронном атоме важное значение имеет принцип Паули, согласно которому в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми. Следовательно, каждая орбиталь , характеризующаяся определенными значениями n , l и ml , может быть занята не более чем двумя электронами, спины которых имеют противоположные знаки. Такие электроны называются спаренными.
Пользуясь принципом Паули, можно подсчитать, какое максимальное число электронов может находиться на каждом подуровне, т.е. определить емкость подуровней:
Здесь электроны на орбиталях изображены стрелками, направленными вверх или вниз в зависимости от знака спинового квантового числа.
Движение электронов в атомах
Содержание:
Движение электронов в атоме — это когда электрон в атоме находится в постоянном движении вокруг ядра. Но у такого движения отсутствует определенная траектория. Это выглядит примерно так, как показано на рисунке снизу. В каждый момент времени электрон находится в определенной точке околоядерного пространства.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Движение электронов в атомах
Электронное облако — модель движения электрона в атоме; область пространства, в каждой точке которой может находиться данный электрон. . Размер зависит от энергии электрона. Чем больше энергия электрона, тем больше по размеру его орбиталь, и тем дальше он находится от ядра.
Распределение электронов в атомах
Вспомните! Атом, молекула. Строение атома
Из курса 7 класса мы узнали, что атом является сложной системой, состоящей из ядра и электронов (рис. 1). Выясним теперь закономерности расположения электронов вокруг ядра. Число электронов равно заряду ядра атома (атомному номеру элемента). Однако
электроны притягиваются к ядру не с одинаковой силой, так как обладают различным запасом энергии и поэтому находятся на разном расстоянии от ядра.
Электроны с близкими значениями энергии располагаются на одинаковом расстоянии от ядра. Эти расстояния называются энергетическими уровнями. Их обозначают буквой n и нумеруют по мере удаления от ядра: 1, 2, 3, 4, 5, 6, 7. Значение n определяется номером периода, в котором расположен элемент. Максимальное число электро-
нов на каждом энергетическом уровне (емкость энергетического уровня)
определяется формулой 
энергетического уровня. Если n = 1, N = 2; n = 4, 
Электроны, расположенные ближе к ядру, сильнее притягиваются к
нему. По мере отдаления от ядра энергия связи уменьшается. Радиус r показывает удаленность каждого энергетического уровня от ядра.
Электроны заселяют пространство вокруг ядра поэтапно, образуя энергетические уровни (рис. 2). Почему так важно знать, как располагаются электроны в атоме? Потому что от строения электронных оболочек элемента зависят его физические и химические свойства (табл. 1). Потому что при непосредственном участии электронов атомов происходят образование и разрыв химических связей, т. е. протекают химические реакции. Скорость движения электрона очень велика, и определить его положение в пространстве в определенный момент времени невозможно. В одном месте пространства его можно обнаружить часто, в другом – редко. Область пространства, в которой вероятность нахождения электронов максимальна, называется электронным облаком, или орбиталью (s, p, d, f).
Форма электронных облаков различная: сферическая обозначается буквой s (s-облако); гантелеобразная – р-облако, причем р-облака ориентированы взаимно перпендикулярно вдоль трех осей x, y, z (рис. 3).
s-oблако может располагаться в пространстве симметрично точке пере-
сечения осей координат, поэтому его обозначают одной ячейкой 
может располагаться вдоль трех осей x, y, z, поэтому их обозначают 
или тремя ячейками 
Электроны вращаются не только вокруг ядра, но и вокруг своей оси, как
Земля вокруг Солнца и своей оси.
Вращение электрона вокруг своей оси называют спином (от англ. spin – волчок). Электроны могут вращаться по часовой стрелке или против нее. На каждой орбитали могут располагаться только два разнонаправленных электрона. Поэтому при составлении электронно-графических формул атомов электроны изображают в ячейке двумя разнонаправленными стрелками
Электронное облако, энергетический уровень, электронная формула, ячейка, спин.
Электронные формулы атомов
Теперь перейдем к рассмотрению электронных формул атомов. Начнем с первого элемента в таблице Менделеева – атома водорода. У атома водорода имеется один электрон, который расположен на s-подуровне первого энергетического уровня, поэтому электронная формула атома водорода 

В Периодической системе атомы водорода и гелия расположены в 1-м периоде, т. е. у этих элементов запас энергии электронов одинаковый, поэтому они находятся на одном энергетическом уровне. Согласно формуле 
Следующий: литий – элемент 2-го периода. У лития имеются два энергетических уровня вокруг ядра, внутренний повторяет электронное строение атома гелия. Два его электрона находятся на первом энергетическом уровне, третий электрон – на втором. Во 2-м периоде п = 2,

У атома неона второй энергетический уровень заполнен электронами, т. е.
второй слой завершен.
Такая закономерность повторяется на третьем энергетическом уровне – от натрия до аргона. У элементов этого периода строение внутренних двух уровней повторяет структуру неона (табл. 2).
У атома аргона завершается третий энергетический уровень. Элементы, у которых внешний энергетический уровень завершен, обладают инертностью.
После аргона в таблице расположен калий. У атома калия следующий электрон образует новый, четвертый энергетический уровень, а внутренние три уровня повторяют электронное строение аргона (табл. 1).
При сравнении электронной структуры элементов 2-го и 3-го периодов заметно, что число электронов на внешнем энергетическом уровне у атомов лития, натрия и калия одинаковое 
Такие сходства в структурах внешних уровней наблюдаются у элементов, расположенных в одной группе, например, у фтора и хлора 7 электронов. У неона и аргона на внешних энергетических уровнях по 8 электронов.
Каждый период (кроме 1-го) начинается с щелочного металла и заканчивается инертным газом. По периодам слева направо число электронов увеличивается от 1 до 8, электроны внешнего энергетического уровня слабее притягиваются к ядру. У элементов главных (А) подгрупп электроны внешнего энергетического уровня являются валентными, т. е. определяют валентность элемента (табл. 3).
Рассмотренные 20 элементов являются элементами главных подгрупп, их очередные электроны помещаются на внешних s— и р-подуровнях, поэтому их называют s— и р-элементами.
К s-элементам относятся элементы главных подгрупп I и II группы; к р-элементам – элементы главных подгрупп III–VIII группы. Объединение элементов в одну группу объясняется одинаковым числом у них валентных электронов.
Ознакомившись с электронным строением атома, мы можем дать следующее определение периодов и групп в Периодической системе:
Периодами называются горизонтальные ряды элементов с одинаковым числом энергетических уровней, начинающиеся со щелочного металла и заканчивающиеся инертным газом (кроме 1-го периода).
Группами называются вертикальные ряды элементов с одинаковым числом валентных электронов.
Электронная формула, электронно-графическая формула, s-, р-элементы.
Лабораторный опыт №1
изготовление моделей атомов
Цель работы: изготовить модели атомов.
Оборудование: разноцветный пластилин, шаростержневые модели атомов.
Ход работы
Атомы элементов можно смоделировать с помощью разноцветного пластилина (рис. 4, 5).
Смоделируйте атомы: водорода, углерода, серы, йода, кислорода, железа. Подберите цвета пластилина или готовых шариков таким образом, чтобы цвета соответствовали простым веществам: водород –бесцветный (можно белый); углерод – черный; сера –желтая; йод – темно-красный; кислород – бесцветный (можно голубой или синий, т.к. сжиженный кислород голубого цвета); железо – серый.
Образование ионов
Вспомните! Cтроение атома, завершенный слой, электронная конфигурация элемента
После ознакомления с электронным строением атомов можно приступить к изучению способности элементов образовывать химические соединения.
Каждый период в системе заканчивается инертным газом. Как вы думаете, почему они так инертны? Для выяснения этого вопроса рассмотрим электронные структуры этих элементов. Нам известно строение атомов 


У других элементов химическая активность определяется именно этой недостроенностью внешнего электронного слоя. Они могут завершить внешние электронные слои путем отдачи или присоединения электронов при образовании соединений (рис. 7).
Если элемент отдает электрон, он превращается в положительно заряженную частицу, а если принимает электрон — в отрицательно заряженную частицу, которые называются ионами, т. е. имеют завершенный энергетический уровень.
А это зависит от двух факторов:
1) от электронного строения атомов;
2) от радиуса атомов.
Заряды ионов пишутся арабскими цифрами сверху
над символом элемента, знак заряда указывается после
числового значения: например:
У элементов, расположенных в начале периодов, на внешней орбитали электронов мало (1–3). Поэтому они легко отдают эти электроны, принимая при этом электронное строение инертного газа, которым заканчивается предыдущий период. А у элементов, расположенных в конце периодов, число электронов на внешнем уровне больше, поэтому они легко принимают электроны. При этом они принимают конфигурацию инертного газа, которым заканчивается данный период. По периодам число электронов на внешнем электронном уровне (валентные электроны) постепенно увеличивается. Слева направо увеличиваются заряды ядер атомов. То есть в этом направлении усиливается способность принимать электрон.
Напишем формулы валентных электронов элементов III периода. Определим число неспаренных электронов и число электронов, недостающих до завершения энергетического уровня (табл.4).
Рассмотрим, как заряжаются атомы элементов при образовании соединения с изменением их электронных структур.
Для завершения внешнего слоя атому хлора недостает лишь одного электрона, поэтому он принимает один электрон от атома магния, превращаясь при этом в отрицательно заряженный ион.
А у атома магния на внешнем слое имеются два электрона, он отдает каждому атому хлора по одному электрону, т. е. требуется два атома хлора.
Как изменяются эти свойства по группам? Число валентных электронов одинаковое у элементов, расположенных в одной группе. А число электронных слоев, т. е. атомных радиусов в этом направлении, увеличивается. По этой причине усиливается способность отдать электрон 
Способность элемента отдать электрон характеризует металлические а принимать — неметаллические свойства.
Для выяснения этого вопроса рассмотрим электронное строение и значения атомных радиусов элементов IA и VIIA групп (табл. 5).
По периодам слева направо металлические свойства ослабевают, неметаллические свойства постепенно усиливаются;
По группам сверху вниз усиливаются металлические свойства.
Ионы, условия образования положительно и отрицательно заряженных ионов.
Составление формул соединений
По пройденным материалам вы знаете, что атомы являются электронейтральными частицами. Потому что количество электронов, которые вращаются вокруг ядра, численно равно заряду ядра, точно так же, абсолютные значения положительно и отрицательно заряженных частиц, составляющих молекулу, будут равны. Поэтому и молекула электронейтральна.
Теперь попытаемся составить формулу обыкновенной поваренной соли. В состав этого вещества входят элементы натрий и хлор в виде ионов. А образование этих ионов вам знакомо из предыдущего параграфа. Теперь обратим внимание на числовые значения зарядов данных ионов:
При образовании иона натрия заряд ядра превышает на единицу общее количество электронов, которые вращаются вокруг ядра.
А при образовании ионов хлора, наоборот, общее количество электронов становится больше на единицу, чем заряд ядра.
При написании формул бинарных (состоящих из двух элементов) соединений мы должны придерживаться такого правила:
В молекулах бинарных соединений положительно заряженная частица
пишется (в основном) на первом месте, отрицательная – на втором.
В соединениях, состоящих из элементов металла и неметалла, частицы атомов металла всегда положительно заряжены, а неметаллы – отрицательно.
Тогда формула поваренной соли выглядит так: NaCl (хлорид натрия).
В название бинарных соединений к международному или сокращенному названию элемента добавляется окончание ид, 


Далее рассмотрим составление формулы хлорида магния:
Используя правило «нулевой суммы», составим такое уравнение:
+2 + (–1)х = 0 ⇒ х = 2, следовательно, формула вещества:
І. Рассмотрим примеры составления формул и определения зарядов элементов соединений по этому способу.
Пример 1. Составьте формулу оксида трехвалентного элемента.
1. Напишем схему формулы оксида трехвалентного элемента –
2. Укажем заряды элементов в этом соединении: 
3. Находим значение наименьшего кратного абсолютных значений зарядов атомов элементов (3 · 2 = 6).
4. Разделив значение наименьшего кратного на абсолютное значение зарядов элементов, запишем их как индексы при них:
6 : 3 = 2, 6 : 2 = 3; х = 2, у = 3;
тогда формула оксида
Алгебраическая сумма зарядов элементов в соединении равна нулю.
+3 · 2 = +6; –2 · 3 = –6; +6 + (–6) = 0
II. Если дана формула вещества, можно определить заряды элементов в
соединении.
Пример 2. Определите заряд фосфора (V) в его оксиде.
1. 
2. В соответствии с вышеуказанным правилом, составляем уравнение с
одним неизвестным:
2х + 5 · (–2) = 0; 2х = +10; х = +5

Метод «нулевой суммы»
- 1. Электроны заселяют пространство вокруг ядра поэтапно, образуя энергетические уровни.
- 2. Область пространства, в которой вероятность нахождения электронов максимальна, называется электронным облаком, или орбиталью. Формы s-облаков — сферическая, а р-облаков — гантелеобразная.
- 3. Изображение электронов в атоме с помощью электронных облаков и распределение по уровням и подуровням называется электроннографической формулой.
- 4. Если элемент отдает электрон, он превращается в положительно заряженную частицу, а если принимает электрон — в отрицательно заряженную частицу. Эти заряженные частицы называются ионами.
- 5. Алгебраическая сумма зарядов элементов в соединении равна нулю.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Электроны: на задворках атомов
Электроны, крохотные объекты, населяющие задворки атомов, играют ведущую роль в химии, переносят электрический ток по нашим электрическим сетям и внутри ударов молний, и составляют «катодные лучи», использовавшиеся для создания изображений в телевидении XX века и на экранах компьютеров. Это наиболее типичный пример (вроде бы) элементарных частиц.
Под «элементарными» я подразумеваю, что электроны неделимы и не состоят из частиц меньшего размера. При помощи «вроде бы» я напоминаю, что они элементарны, насколько нам позволяют судить об этом современные знания – то, что мы знаем об электронах, получено в экспериментах, а наши эксперименты не обладают бесконечной властью. Если электроны не элементарны, но настолько малы, что наши текущие эксперименты не могут их разломать – они будут выглядеть элементарными во всех экспериментах, проведённых нами в прошлом и настоящем, но не во всех будущих экспериментах. Так что, когда-нибудь – ведь 80 лет назад люди считали, что протоны могут быть элементарными, но им не хватало знаний, а 150 лет назад люди считали, что атомы могут быть элементарными, но им не хватало знаний – мы можем обнаружить, что электроны не элементарны. Но пока, поскольку все доступные нам эксперименты демонстрируют, что они элементарны, мы будем условно предполагать, что так и есть – помня, что это частично экспериментальный факт, и частично – предположение!
Электрон стал первой из обнаруженных субатомных частиц (первым найденным объектом, чей размер был меньше атома). Во времена его открытия, в 1890-х (обычно пишут 1897 год, но это открытие было в некотором роде постепенным), научные дебаты по поводу того, состоит ли материя из атомов, или же атомы были просто выдумкой, удобной для описания поведения материи, подходили к концу. Но даже те, кто верил в существование атомов, не обязательно считали, что атомы были неделимы (как предполагало их имя, произошедшее от греческого «неразрезаемый»). Поколение спустя, к середине 1930-х, физики подтвердили существование атомов, поняли их базовую структуру и узнали, как подсчитывать их свойства с высокой точностью. Эти подсчёты они провели с помощью уравнений из теории поведения материи 1920-х годов, называемой «квантовая механика», ставшей необходимой потому, что знаменитые уравнения Ньютона не справлялись с описанием работы атомов. Многие ключевые проверки точности квантовой механики были связаны с точными измерениями поведения электронов внутри и снаружи атомов.
Все электроны идентичны и неразличимы; если я поменяю два из них местами, вы не сможете этого обнаружить. Так что я могу писать о «свойстве электрона», а вы можете быть уверены в том, что эти свойства таковы для всех электронов. Какие же свойства присущи им?
Масса!
У электрона есть масса – она мала по сравнению с массой любого атома, поэтому про неё обычно можно забыть в начальных классах химии, но она не настолько мала, чтобы забыть о ней в физике частиц и даже в понимании структуры атомов. Хотя электроны не вносят значительного вклада в массу атома, масса электрона необходима для определения размера атома. В этом, в частности, заключается важность поля и частицы Хиггса. Эту массу можно записать по-разному, и каждый из способов даёт вам свою перспективу:
- Она равна примерно 9 × 10 -31 кг = 0.000 000 000 000 000 000 000 000 000 000 9 кг.
- Она равна примерно 0,05% (точнее, 1/1838) массы атома водорода – легчайшего атома в природе. Большая часть его массы содержится в его ядре.
- Энергия, хранящаяся в массе электрона, E = mc 2 , равна 0,000 511 ГэВ. Это в 200 000 раз больше энергии, переносимой одним фотоном зелёного цвета. В физике частиц масса частицы часто записывается через обратное взаимоотношение энергии и массы: для стационарной частицы m = E / c 2 . В этих терминах масса электрона равна 0,000511 ГэВ / c 2 .
Электрический заряд!
У электрона есть электрический заряд – а значит, на него действуют электрическое и магнитное поля. На электрически заряженную частицу в присутствии электрического поля будет действовать электрическая сила. Именно такие силы удерживают электроны внутри их атомов.
Насколько велик электрический заряд электрона? Представьте себе статическое электричество – вы прошли в ботинках по ковру, а затем, прикоснувшись к дверной ручке, другому человеку или компьютеру (. ), вы почувствуете искру. Эта искра переносит заряд из одного места в другое – и обычно она в 10 миллионов миллионов раз больше заряда, переносимого электроном. Физики измеряют заряд с использованием произвольно выбранной единицы под названием кулон (так же, как время измеряется в секундах и длина в метрах). В типичном заряде статического электричества содержится одна миллионная доля кулона. Величину заряда электрона обычно обозначают e, и e примерно равно 1,6 × 10 -19 Кл.
Размер?
Размер электрона неизвестен; он может оказаться точечным объектом без размера, или у него может быть чрезвычайно малый размер, радиус которого не превышает 10 -18 м. Это, по меньшей мере, в 100 000 000 раз меньше радиуса атома. В ином случае мы бы видели признаки размера электрона в экспериментах.
Как на самом деле выглядит электрон? Как я писал в статье про атомы, определить понятие размера элементарной частицы сложно, поскольку электрон, хотя его и называют частицей, не является какой-нибудь пылинкой или крупинкой соли или песка. У него также есть и волновые свойства. В атоме электроны в каком-то смысле распределены по всему атому, как распространяется звуковая волна от барабана. В этом смысле, находясь внутри атома, они имеют размер всего атома.
Но это контекстуальный, а не присущий самому электрону размер. Я так и буду называть это «контекстуальным размером». Измените контекст – выньте электрон из атома, поместите его в маленькую металлическую коробку – и распределение электрона может вырасти или ужаться. У протона, наоборот, есть присущий ему размер, примерно в 100 000 раз меньше атома. Ни в каком смысле нельзя сделать протон меньше присущего ему размера, не разломав его. Короче, контекстуальный размер не может быть меньше внутреннего размера. Уменьшив контекстуальный размер электрона до минимума, в основном через рассеяние электронов высокой энергии с других частиц, мы искали их внутренний размер. Пока что ничего не нашли.
Так что, можно сказать, что эксперименты показывают, что присущий электрону размер меньше, чем 10 -18 м. А как далеко электрон распространяется в виде волны, зависит от контекста.
Про это свойство вы могли и не слышать. Оно может покорёжить вам мозг (как покорёжило мне!)
Среди странных свойств квантового мира есть очень странный факт (впервые открытый в 1920-х Гаудсмитом и Уленбеком, пытавшимися осмыслить данные, полученные с измерений электронов в атоме) — элементарные частицы могут крутиться, даже не имея размера! Представить это невозможно: мне, по крайней мере, это недоступно. Скажем это в практическом смысле: электроны и многие другие частицы природы ведут себя так, будто это маленькие вращающиеся волчки – если их поглощает другой объект, это заставляет этот объект немного крутиться. Представьте себе, как вращающийся кусок мягкой глины падает на способный крутиться стол. Глина прилипнет к столу, и стол начнёт вращаться.
Что ещё более странно, каждый из типов частиц всегда вращается с одной и той же скоростью! Мы говорим, что у электронов спин равен 1/2; это самая малая ненулевая скорость вращения, которой способна обладать частица. Нам также известны другие типы элементарных частиц со спином 1/2, 1, и (как мы думаем) 0, и не-элементарных частиц со спинами 0, 1/2, 1, 3/2, 2, 5/2, и далее, до очень больших значений.
Магнетизм↑
Электрически заряженный вращающийся шар вёл бы себя, как магнит, и вы можете догадаться, что поскольку у электронов есть заряд и спин, они ведут себя, как магниты. И вы правы! То, что электроны ведут себя, как маленькие магниты, помогает подтвердить тот факт, что они на самом деле вращаются. Обычные, повседневные магниты, сделанные из, допустим, железа, приобретают свой магнетизм от электронов; множества и множества электронов, чьи спины аккуратно выровнены, могут создать большой магнит из множеств и множеств маленьких!
А вы уверены в том, что электроны реально существуют?
Не пора ли в этой статье продемонстрировать изображение электрона?
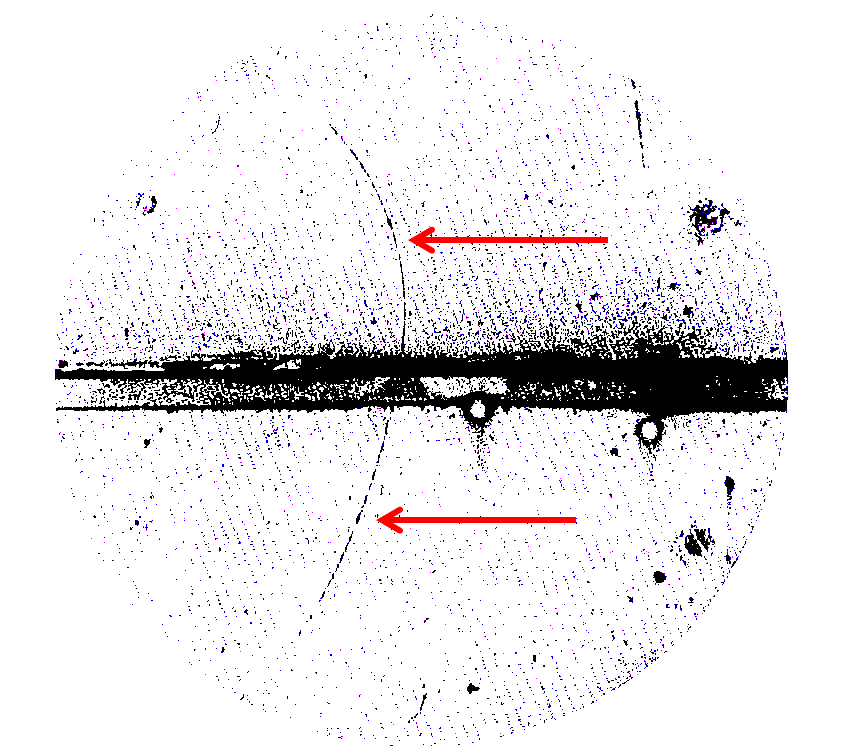
Электрически заряженная частица проходит через специально подготовленную пузырьковую камеру, оставит за собой след из пузырьков. Пузырьки быстро раздуваются до видимого размера, а затем этот след можно сфотографировать. Магнитное поле изгибает путь частиц; направление изгиба сообщает вам, был ли заряд частицы положительным или отрицательным. Это знаменитое фото 1933 года демонстрирует тонкий искривлённый путь пузырьков, отмеченный красными стрелками, ведущий себя точно так же, как след электрона – за исключением того, что след электрона выгнулся бы вправо. Изгиб не в ту сторону доказывает, что у частицы, оставившей след, заряд положительный, и поэтому след оставлен позитроном, античастицей электрона. Горизонтальная черта и диагональные линии – это артефакты фотографии и экспериментальной установки.
В отличие от молекул и атомов, достаточно крупных для того, чтобы сделать их фотографии при помощи особых микроскопов, изображение электрона сделать невозможно. Он просто слишком мал и неуловим. Мы можем делать изображения следов электронов, проходящих сквозь материю, как на рисунке (там показан антиэлектрон, позитрон, но электрон выглядел бы практически точно так же), но мы не можем получать изображения электронов напрямую.
Но наша уверенность в существовании электронов очень сильна, а наши знания их свойств весьма точны. Откуда берётся это уверенность?
Это важный вопрос, поскольку один из самых частых вопросов, который задают специалистам по физике частиц – это знаем ли мы на самом деле, что эти частицы существуют, или же мы обманываем себя (и всех остальных), и тратим кучу денег на ерунду, которая оказывается всего лишь горячим воздухом, выходящим из наших голов.
Да, мы знаем, что мы делаем. И мы знаем об этом уже более ста лет. Часть нашей уверенности получена благодаря таким изображениям, которое приведено выше. Но есть и множество других источников уверенности, о которых я, возможно, напишу позже.
http://natalibrilenova.ru/dvizhenie-elektronov-v-atomah/
http://habr.com/ru/post/373943/



































