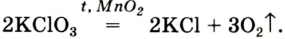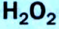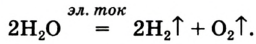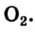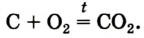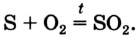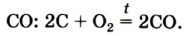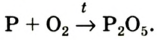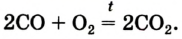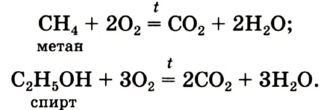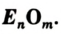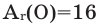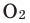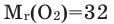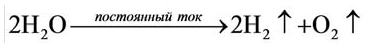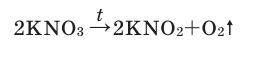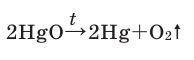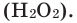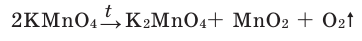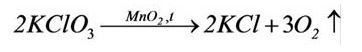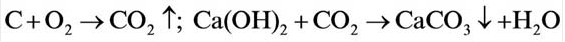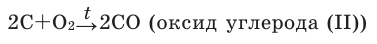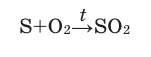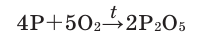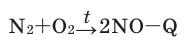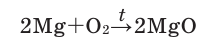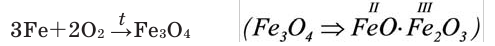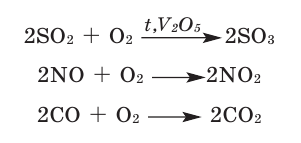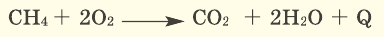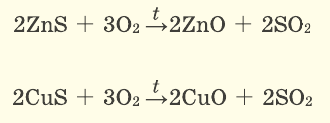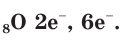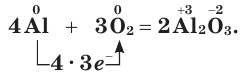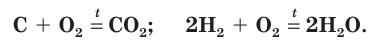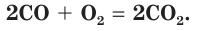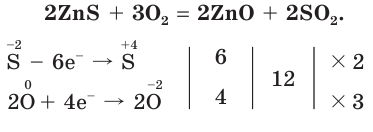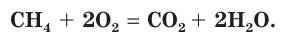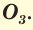Кислород: химия кислорода
Кислород
Положение в периодической системе химических элементов
Кислород расположен в главной подгруппе VI группы (или в 16 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кислорода
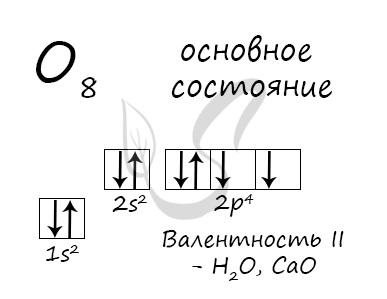
Электронная конфигурация кислорода в основном состоянии :
+8O 1s 2 2s 2 2p 4 1s 

Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
Физические свойства и нахождение в природе
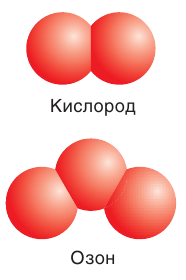
Кислород О2 — газ без цвета, вкуса и запаха, немного тяжелее воздуха. Плохо растворим в воде. Жидкий кислород – голубоватая жидкость, кипящая при -183 о С.
Озон О3 — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент. Кислород входит в состав многих минералов — силикатов, карбонатов и др. Массовая доля элемента кислорода в земной коре — около 47 %. Массовая доля элемента кислорода в морской и пресной воде составляет 85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Способы получения кислорода
В промышленности кислород получают перегонкой жидкого воздуха.
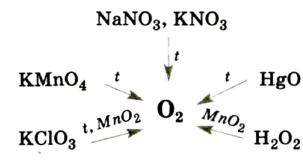
Лабораторные способы получения кислорода:
- Разложение некоторых кислородосодержащих веществ:
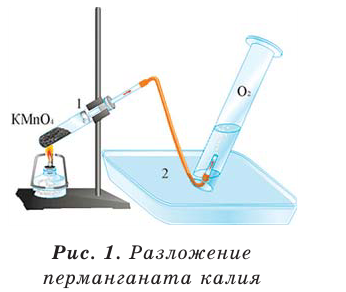
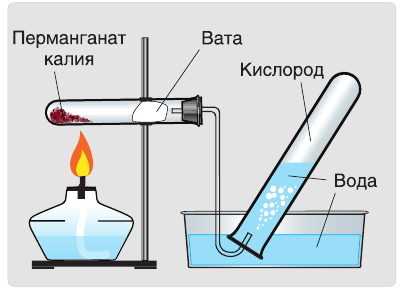
Разложение перманганата калия:
Разложение бертолетовой соли в присутствии катализатора MnO2 :
2KClO3 → 2KCl + 3O2
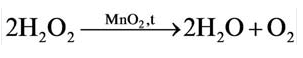
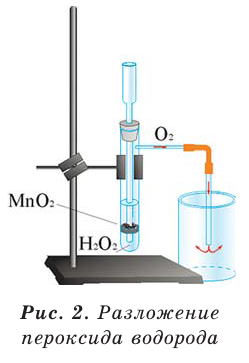
Разложение пероксида водорода:
2HgO → 2Hg + O2
Соединения кислорода
Основные степени окисления кислород +2, +1, 0, -1 и -2.
| Степень окисления | Типичные соединения |
| +2 | Фторид кислорода OF2 |
| +1 | Пероксофторид кислорода O2F2 |
| -1 | Пероксид водорода H2O2 Пероксид натрия Na2O2 и др. |
| -2 | Вода H2O Оксиды металлов и неметаллов Na2O, SO2 и др. Соли кислородсодержащих кислот Кислородсодержащие органические вещества Основания и амфотерные гидроксиды |
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя (с большинством химических элементов) и свойства восстановителя (только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами , и с неметаллами . Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
Но чаще фосфор сгорает до оксида фосфора (V):
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000 о С), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
Железо , в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит , образуя оксид углерода (IV):
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды . При этом образуются оксиды:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения ( сероводород, аммиак, метан, силан гидриды . При этом также образуются оксиды:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора ( сероуглерод, сульфид фосфора и др.):
CS2 + 3O2→ CO2 + 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления ( оксид углерода (II), оксид железа (II) и др.):
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например , кислород окисляет гидроксид железа (II):
Кислород окисляет азотистую кислоту :
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
Кислород
Кислород (лат. Oxygenium) — элемент VIa группы 2 периода периодической таблицы Д.И. Менделеева. Первым открывает группу халькогенов — элементов VIa группы.
Газ без цвета, без запаха, составляет 21% воздуха.
Общая характеристика элементов VIa группы
Общее название элементов VIa группы O, S, Se, Te, Po — халькогены. Халькогены (греч. χαλκος — руда + γενος — рождающий) — входят в состав многих минералов. Например, кислород составляет 50% массы земной коры.
От O к Po (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.
Среди элементов VIa группы O, S, Se — неметаллы. Te, Po — металлы.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns 2 np 4 :
- O — 2s 2 2p 4
- S — 3s 2 3p 4
- Se — 4s 2 4p 4
- Te — 5s 2 5p 4
- Po — 6s 2 6p 4
Основное состояние атома кислорода
У атома кислорода (как и атомы азота, фтора, неона) нет возбужденного состояния, так как отсутствует свободная орбиталь с более высоким энергетическим уровнем, куда могли бы перемещаться валентные электроны.
Атом кислорода имеется два неспаренных электрона, максимальная валентность II.
Природные соединения
- Воздух — в составе воздуха кислород занимает 21% (это число пригодится в задачах!)
- В форме различных минералов в земной коре кислорода содержится около 50%
- В живых организмов кислород входит в состав органических веществ: белков, жиров, углеводов и нуклеиновых кислот
Получение
В промышленности кислород получают из сжиженного воздуха. Также активно применяются кислородные установки, мембрана которых устроена как фильтр, отсеивающие кислород (мембранная технология).
В лаборатории кислород получают разложением перманганата калия (марганцовки) или бертолетовой соли при нагревании. Применяется реакция каталитического разложения пероксида водорода.
На подводных лодках для получения кислорода применяют следующую реакцию:
Химические свойства
Является самым активным неметаллом после фтора, образует бинарные соединения со всеми элементами кроме гелия, неона, аргона. Чаще всего реакции с кислородом экзотермичны (горение), ускоряются при повышении температуры.
- Реакции с неметаллами
Во всех реакциях, кроме взаимодействия со фтором, кислород проявляет себя в качестве окислителя.
2C + O2 = (t) 2CO (неполное окисление — угарный газ, соотношение 2:1)
C + O2 = (t) CO2 (полное окисление — углекислый газ, соотношение 1:1)
F + O2 → OF2 (фторид кислорода, O +2 )
В реакциях кислорода с металлами образуются оксиды, пероксиды и супероксиды. Реакции с активными металлами идут без нагревания.
Известна реакция горения воды во фторе.
Все органические вещества сгорают с образованием углекислого газа и воды.
При применении катализаторов и особых реагентов в органической химии достигают контролируемого окисления: алканы окисляются до спиртов, спирты — до альдегидов, альдегиды — до кислот.
Процесс можно остановить на любой стадии в зависимости от желаемого результата.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Кислород как химический элемент в химии — формулы, определение с примерами
Содержание:
Кислород как химический элемент:
Кислород — самый распространенный элемент на Земле.
Дыхание, горение, многие процессы в живой и неживой природе, а также в технике протекают в присутствии кислорода как простого вещества.
Кислород, являясь самым распространенным элементом в земной коре, считается одним из самых необходимых элементов для жизнедеятельности на Земле.
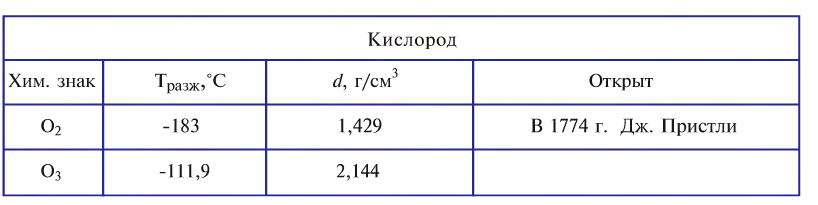
Кислород был открыт в 1774 г. Дж. Пристли и независимо от него — К. Шееле, но как новое вещество его подробно охарактеризовал А. Лавуазье.
Название «кислород» предложено А. Лавуазье. По-латыни (oxygenium) оно означает «рождающий кислоты». Химическим знаком его была взята первая буква латинского названия. Порядковый номер кислорода в периодической системе — 8, а относительная атомная масса равна 15,9994
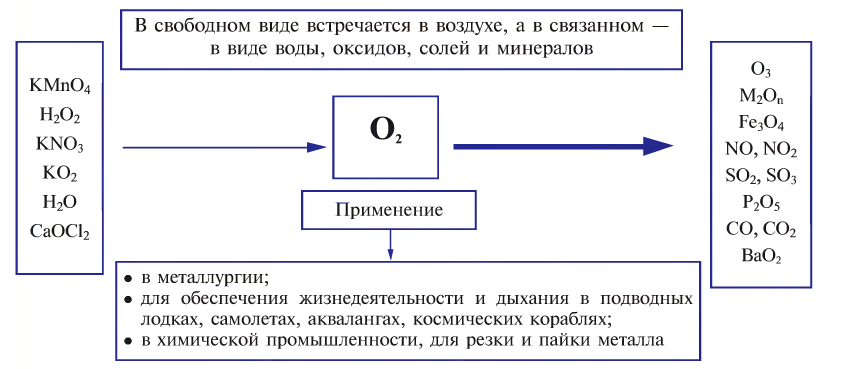
В свободном виде кислород встречается в атмосферном воздухе, а в связанном виде, т.е. в виде соединений, входит в состав воды, минералов и других веществ, составляющих горные породы, а также растительные и животные организмы. В земной коре масса кислорода составляет 47%. Объемная доля молекулярного кислорода в воздухе составляет 20,94%. В воде масса связанного кислорода составляет 89%.
- Химический знак кислорода — О.
- Формула простого вещества —
- Относительная атомная масса
- Относительная молекулярная масса
- Валентность в соединениях — 2.
- Эквивалентная масса — 8 г/моль.
- Эквивалентный объем — 5,6 л/моль.
Кислород как простое вещество
Получение:
В лаборатории кислород получают следующими способами.
1. Термическим разложением перманганата калия:
2. Термическим разложением бертолетовой соли в присутствии катализатора:
3. Термическим разложением нитратов щелочных металлов:
4. Электролизом воды (рис. 19):
Рис. 19. При электролизе воды образуется один объем кислорода и два объема 4
5. Пероксид водорода в присутствии катализатора оксида марганца (IV) разлагается на воду и кислород (рис. 20):
В промышленности кислород получают электролизом воды или из жидкого воздуха.
Рис. 20. Разложение 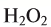
Понятие о катализаторах:
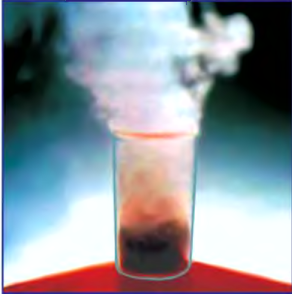
Если обратить внимание на реакцию получения кислорода посредством разложения пероксида водорода, то можно увидеть, что этот процесс осуществляется очень быстро в присутствии черного порошка — оксида марганца (IV) — 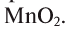
Если отделить фильтрованием порошок, находящийся на дне сосуда, и высушить его, то можно заметить, что его исходные масса и свойства не изменились. Им можно пользоваться при разложении других образцов пероксида водорода.
Вещества, участвующие в химической реакции и ускоряющие ее, но которые при этом не расходуются и не изменяются, называются катализаторами.
Процесс, протекающий в присутствии катализатора, называется катализом.
Рис. 21. Притяжение кислорода к магниту
Физические свойства:
Молекула кислорода состоит из двух атомов и как простое вещество выражается формулой 02. Относительная молекулярная масса равна 32. При обычных условиях кислород — газ без цвета, вкуса и запаха. Он немного тяжелее воздуха (1 л кислорода весит 1,43 г, а 1 л воздуха — 1,293 г). Кислород мало растворяется в воде: при 0°С в 1 л — 49 мл кислорода, при 20°С в 1л — 31 мл кислорода. Приблизительно при 1500°С кислород расщепляется на атомы. При —183°С кислород превращается в голубоватую жидкость. Жидкий кислород способен притягиваться к магниту (рис. 21).
Озон:
При пропускании через кислород или воздух электрической искры (или грозового разряда) образуется новое вещество с характерным запахом — озон. Возможность получения озона из чистого кислорода доказывает, что он является его аллотропическим видоизменением и состоит из атомов кислорода:
Озон постоянно образуется в стратосфере (слой атмосферы на высоте 23—25 км от Земли) под действием ультрафиолетовых лучей, а также в результате окисления смолистых веществ хвойных растений. Озоновый слой составляет в толщину 2—4,5 мм, он защищает Землю от губительной солнечной радиации (вредных лучей). Нарушение целостности озонового слоя чрезвычайно опасно для жизни на Земле. Поэтому ученые постоянно проводят исследования по изучению причин появления озоновых дыр и мер по их предупреждению.
Озон разъедает резину, обесцвечивает масло и бумагу, убивает бактерии. Он используется при усовершенствовании технологических процессов в промышленности, при очистке дымовых газов, промышленных и бытовых стоков, а также при дезинфекции питьевой воды.
Озон — газ голубого цвета с характерным запахом, в воде растворяется лучше, чем кислород (при 0°С в 1 л воды 490 мл).
Озон легко разлагается:
В лаборатории озон получают с помощью озонатора.
Озон отделяют от кислорода путем сильного вымораживания (озон кипит при температуре -111,9°С).
Озон ядовит. Его количество в воздухе не должно превышать 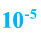
Серебро не взаимодействует с кислородом, но при взаимодействии с озоном дает оксид.
Химические свойства кислорода:
Кислород (после фтора) — самый активный неметалл.
Кислород поддерживает горение.
Кислород соединяется почти со всеми металлами (окисляет их), кроме золота, серебра, платины и металлов группы платины:
Кислород вступает в реакцию также со всеми неметаллами, кроме галогенов (элементов VII группы главной подгруппы), образуя оксиды:
Кислород также вступает в реакцию со сложными органическими и неорганическими веществами:
Оксиды — это вещества, образующиеся в результате взаимодействия кислорода и большинства простых или сложных веществ.
В оксидах кислород двухвалентен.
Биологическое значение кислорода
Кислород считается важным биогенным элементом. Он составляет 45% сухой биомассы растений. Процесс дыхания живых организмов на Земле непосредственно связан с кислородом. Кислород также является источником озонового слоя, задерживающего опасные солнечные лучи. Роль кислорода огромна при распаде и гниении умерших организмов. Процесс фотосинтеза также нельзя представить без кислорода. Он составляет 65% тела человека.
Применение кислорода
Кислород широко применяется в медицине, при обеспечении жизнедеятельности в подводных и космических аппаратах, при осуществлении процессов дыхания, горения и гниения, для создания высоких температур в производственных процессах, в производстве химических веществ, в качестве окислителя топлива в различных агрегатах. Кислород хранится в 40-литровых голубых баллонах (вес тары 80 кг) при давлении 150-160 атм и объеме 6-7 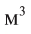
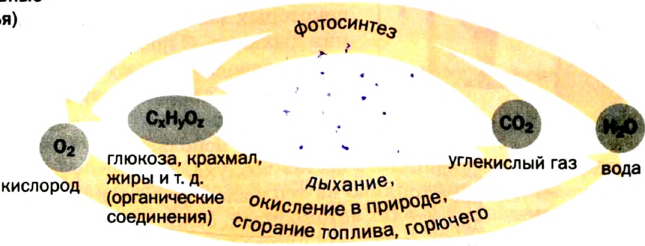
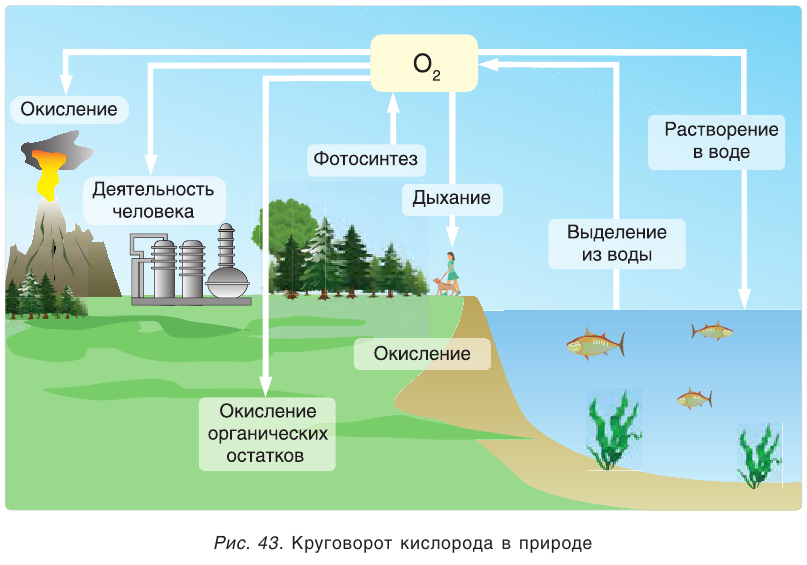
Круговорот кислорода в природе
О том, что кислород в большом количестве находится в литосфере, гидросфере и атмосфере, мы говорили в предыдущих разделах учебника (табл. 5).
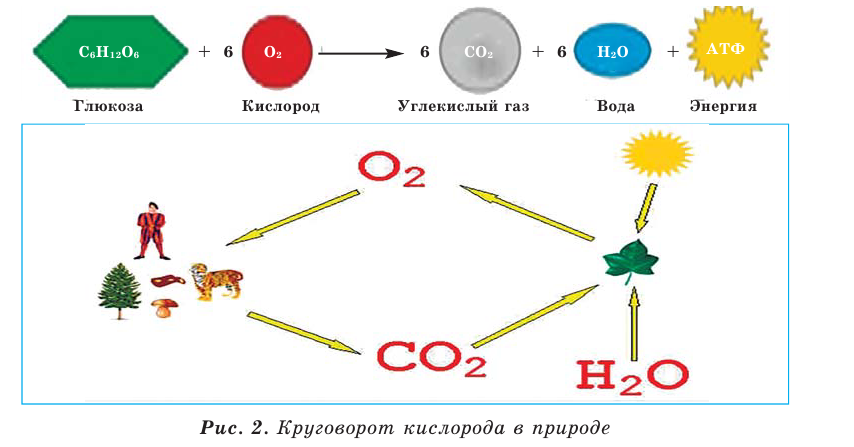
Круговорот кислорода на Земле несущественно отличается от его круговорота в атмосфере, литосфере и гидросфере. На Земле круговорот в основном протекает в процессе фотосинтеза и дыхания. В процессе фотосинтеза углекислый газ, взаимодействуя с водой, образует органические вещества и кислород. В результате 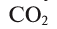
При дыхании, разложении умерших организмов и горении кислород из биосферы возвращается обратно в гидросферу и атмосферу:
В биомассе Земли кислород полностью меняется каждые 20—30 лет. В литосферу кислород переходит из атмосферы в виде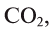
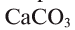
Эта реакция наблюдается в основном в зонах повышенной вулканической деятельности, тем самым постепенно обновляя углекислый газ в атмосфере.
Кислород и воздух
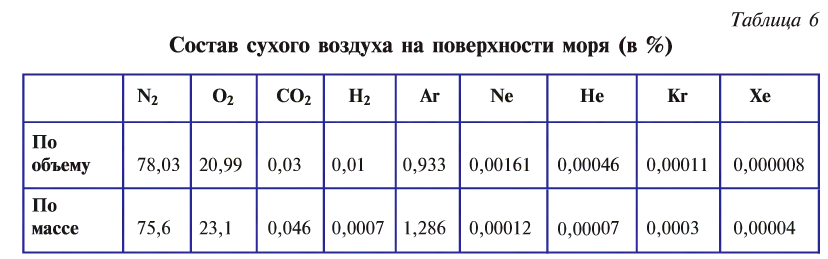
Атмосферный воздух — это природная смесь многих газов. Помимо азота и кислорода, являющихся основной составной частью воздуха, в его состав входят в небольшом количестве инертные газы, углекислый газ, пары воды и водород (табл. 6). Кроме них, в воздухе встречаются, в зависимости от внешних условий, пыль, некоторые случайные примеси. Кислород, азот и инертные газы являются постоянными составляющими воздуха, они встречаются в любом месте почти в одинаковом количестве. Содержание же углекислого газа, паров воды и пыли изменяется в зависимости от условий.
Один литр воздуха при 20°С и нормальном атмосферном давлении весит 1,293 г. При —192°С и давлении 101,33 кПа воздух превращается в бесцветную прозрачную жидкость. Из жидкого воздуха выделяются азот, кислород и инертные газы.
Углекислый газ и водяные пары воздуха выполняют функцию защитного экрана, препятствующего распространению во Вселенной тепла Земли, а озон не пропускает губительные для жизни на Земле коротковолновые ультрафиолетовые лучи, исходящие от Солнца и звезд. Твердые частицы воздуха (пыль) служат основой для образования дождевых капель (в состав пыли входят минеральные вещества, частицы угля, растительная пыль и различные бактерии).
К случайным примесям воздуха относятся сероводород и аммиак, образующиеся при гниении органических остатков, выбрасываемый промышленными предприятиями сернистый газ, образующиеся в результате электрических разрядов оксиды азота, которые периодически выводятся из состава воздуха дождем и снегом.
Воздух является необходимой составной частью жизни на Земле. Сохранение его чистоты имеет огромное значение для человечества. Для защиты воздуха от техногенных загрязнений необходимо использовать новые безотходные технологии, предупреждать уменьшение биомассы Земли, обеспечивать нормальную работу естественных механизмов очистки воздуха.
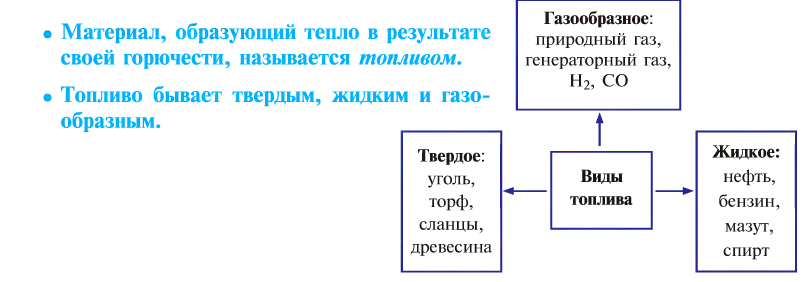
Горение и виды горючих веществ
Реакция, протекающая с участием кислорода и сопровождающаяся выделением большого количества света и тепла, называется горением.
В чистом кислороде, по сравнению с воздухом, вещества горят во много раз быстрее (рис. 22). В обоих случаях выделяется равное количество теплоты, но в кислороде этот процесс протекает быстрее и выделяющаяся теплота не расходуется, как в случае с воздухом, на нагревание азота. Температура при горении в чистом кислороде выше, чем в воздухе. Опуская тлеющую лучину в сосуд с чистым кислородом, можно увидеть, как она сразу загорается. А в воздухе тлеющая лучина может вскоре и потухнуть. Если эта лучина зажжена, то она продолжает гореть на воздухе, потому что выделяющееся при горении тепло требует большей температуры, чем температура воспламенения лучины.
Рис. 22. Горение магния в чистом кислороде
Рис. 23. Тушение пламени
Температура, необходимая для поджигания вещества на воздухе, называегся температурой воспламенения.
Значит, для обеспечения горения веществ, нужно нагревать их до температуры воспламенения и подавать кислород в достаточном количестве.
Для того чтобы потушить пламя, необходимо ликвидировать факторы, обеспечивающие его появление, т.е. охладить вещество до температуры ниже температуры возгорания и прекратить подачу кислорода (рис. 23).
Чтобы потушить горящую вещь, сначала следует понизить температуру, используя невоспламеняющиеся средства, затем накрыть источник возгорания одеялом или брезентом, чтобы прекратить подачу воздуха.
В непредвиденных ситуациях для тушения пожара необходимо использовать специальные средства, а если их нет, то применять указанный выше способ.
Вообще процесс горения имеет огромное значение в промышленности и в повседневной жизни.
От твердого топлива остается минеральный осадок — пепел. Жидкое и газообразное топливо такого недостатка не имеет. Но любое топливо независимо от места добычи, промышленного объема, экономической эффективности имеет только свое место применения, и возможности по его взаимозамещению ограничены.
Неправильное сжигание топлива приносит вред народному хозяйству.
Топливо позволяет спокойно переносить холод, варить пищу, которая не употребляется в сыром виде, получать металлы из руд путем их выплавки, обеспечивать движение транспорта, получать другие виды энергии.
Оксиген
Это первый элемент, который вы будете подробно изучать. Из периодической системы Д. И. Менделеева можно получить такие сведения о нем:
- • символ Оксигена — О;
- • порядковый номер элемента — 8;
- • Оксиген находится во 2-м периоде, в VI группе;
- • относительная атомная масса элемента — 16 (точное значение — 15,999).
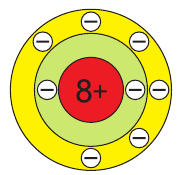
Значение порядкового номера элемента указывает на то, что атом Оксигена содержит 8 электронов, а заряд ядра атома равен +8.
Оксиген — неметаллический элемент, поскольку его простые вещества кислород 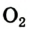
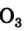
Вам известно, что Оксиген имеет постоянное значение валентности — 2. Атом этого элемента легко присоединяет 2 электрона и превращается в простой ион 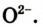
Распространенность оксигена в природе
Оксиген — один из самых распространенных элементов на нашей планете. В земной коре его атомов больше, чем атомов любого другого элемента (§ 6). Атомы Оксигена содержатся в песке, глине, известняке, многих минералах. Оксиген — второй по распространенности в атмосфере (после Нитрогена) и в гидросфере (после Гидрогена).
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 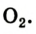
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 02. Это вещество содержит молекулы, состоящие из двух атомов Оксигена.
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5 объема воздуха. Состав сухого воздуха 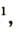
Организм взрослого мужчины ежесуточно потребляет приблизительно 900 г кислорода, а женщины — 600 г.
Состав воздуха:
Газ компонент воздуха Доля воздуха в%
| Название | Формула | объемная* | массовая |
| Азот | 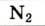 | 78,09 | 75,51 |
| Кислород | 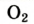 | 20,95 | 23,15 |
| Аргон | 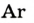 | 0,93 | 1,28 |
| углекислый газ | 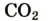 | 0,037 | 0,056 |
| Другие газы | менее 0,002 | менее 0,003 |
* Объемная доля вещества в смеси — отношение объема вещества к объему смеси. Объемную долю обозначают греческой буквой
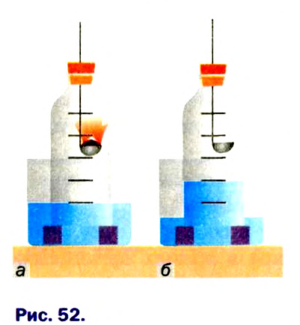
Определить объемную долю кислорода в воздухе можно экспериментально. Для этого нужны стеклянная бутылка без дна с пробкой и кристаллизатор с водой. В пробку вставляют ложку для сжигания, в которую набрано немного красного фосфора. Его поджигают, быстро вносят в бутылку и плотно I закрывают ее пробкой (рис. 52). Когда горение фосфора прекратится, вода займет примерно 1/5 часть объема бутылки. Этот объем занимал в воздухе кислород, который вступил в реакцию с фосфором.
Кислород содержится не только в атмосфере. Небольшое его количество вместе с другими газами воздуха растворено в природной воде.
Существует еще одно простое вещество Оксигена — озон 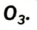
Озон содержится в атмосфере в незначительном количестве; его объемная доля не превышает
Определение объемной доли кислорода в воздухе сжиганием фосфора:
а — начало опыта;
б — окончание опыта
1 0,0004 %. Распадаясь, он поглощает часть ультрафиолетовых лучей солнечного света, вредную для растений и животных, и тем самым оберегает природу.
Физические свойства кислорода
В обычных условиях кислород — бесцветный газ, который не имеет запаха и вкуса. При охлаждении до -183 °С превращается в голубую жидкость, которая при температуре -219 °С затвердевает, образуя синие кристаллы. Кислород в 1,1 раза тяжелее воздуха. Он плохо растворяется в воде, но этого достаточно для существования в природных водоемах рыб, других живых существ, которые дышат растворенным кислородом.
Жидкий кислород, как и железо, притягивается к магниту.
Вывод:
Оксиген — неметаллический элемент. В природе распространено его простое вещество кислород, а также вода и другие соединения. На кислород приходится немногим более 1/5 объема воздуха.Кислород — газ без запаха и вкуса, необходимый для дыхания; он поддерживает горение.
Открытие кислорода
Кислород был открыт во второй половине XVIII в. несколькими учеными разных стран. Первым этот газ получил шведский химик К.-В. Шееле в 1772 г., а через два года, не зная об опытах предшественника, — английский химик Дж. Пристли. В 1775 г. французский ученый A.-JI. Лавуазье исследовал кислород и дал ему название oxygen.
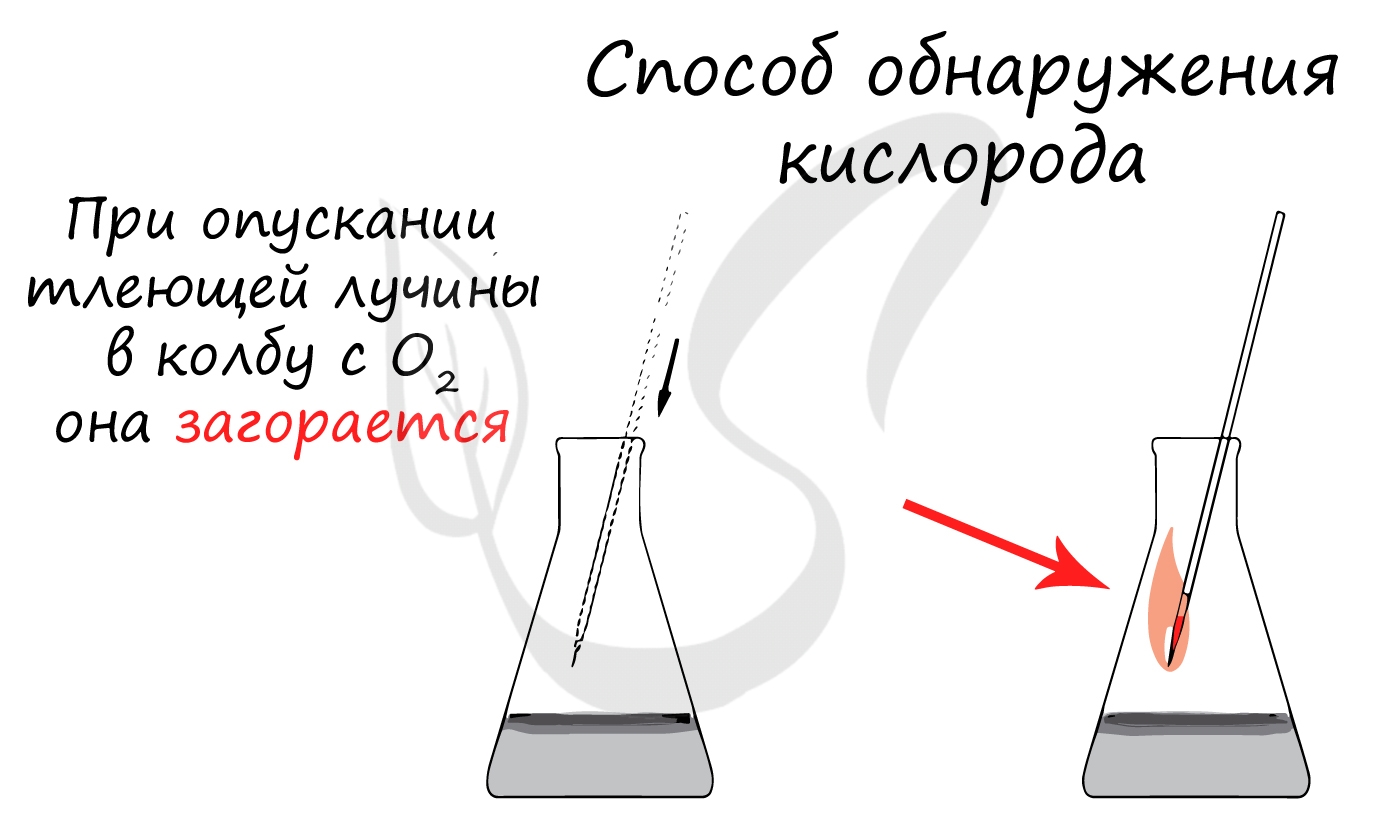
Кислород можно обнаружить с помощью тлеющей лучинки. Лучинка, помещенная в сосуд с этим газом, ярко вспыхивает (рис. 53).
Рис. 53.Обнаружение кислорода:
а — тлеющая лучинка на воздухе; б — возгорание лучинки в кислороде
Получение кислорода в промышленности
Неисчерпаемым источником кислорода является воздух. Чтобы получить из него кислород, следует отделить этот газ от азота и других газов. На такой идее основан промышленный метод получения кислорода. Его реализуют, используя специальную, достаточно громоздкую аппаратуру. Сначала воздух сильно охлаждают до превращения его в жидкость. Затем температуру сжиженного воздуха постепенно повышают. Первым из него начинает выделяться газ азот (температура кипения жидкого азота составляет -196 °С), а жидкость обогащается кислородом (температура кипения кислорода -183 °С).
Получение кислорода в лаборатории
Лабораторные методы получения кислорода основаны на химических реакциях.
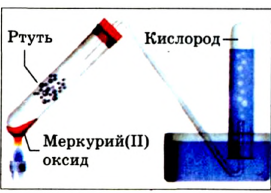
Дж. Пристли получал этот газ из соединения, название которого — меркурий 
В современном исполнении этот опыт изображен на рисунке 54. При нагревании меркурий 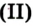
Рис. 54.Получение кислорода нагреванием меркурий 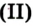
Соответствующее химическое уравнение:
Сейчас метод Пристли не используют, поскольку пары ртути токсичны. Кислород получают с помощью других реакций, подобных рассмотренной. Они, как правило, происходят при нагревании.
Реакции, при которых из одного вещества образуются несколько других, называют реакциями разложения.
Для получения кислорода в лаборатории используют такие оксигенсодержащие соединения:
- калий перманганат
(бытовое название — марганцовка; вещество является распространенным дезинфицирующим средством)
- калий хлорат
(тривиальное название — бертолетова соль, в честь французского химика конца XVIII — начала XIX в. K.-Л. Бертолле)
Небольшое количество катализатора — манган 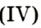
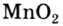
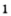
Получение кислорода разложением гидроген пероксида
Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), чтобы она едва тлела. Насыпьте в пробирку с раствором гидроген пероксида немного катализатора — черного порошка манган 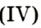
Составьте уравнение реакции разложения гидроген пероксида, если вторым продуктом реакции является вода
В лаборатории кислород можно также получить разложением натрий нитрата 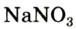

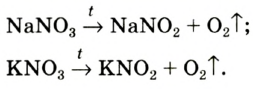
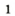
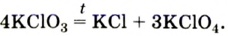
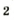
Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока:
Лабораторные методы получения кислорода
В природе кислород образуется вследствие фотосинтеза в зеленых листьях растений. Упрощенная схема этого процесса такова:
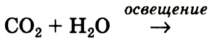
Выводы:
Кислород был открыт в конце XVIII в. несколькими учеными. Кислород получают в промышленности из воздуха, а в лаборатории — с помощью реакций разложения некоторых оксигенсодержащих соединений. Во время реакции разложения из одного вещества образуются два или более веществ.
Химические свойства кислорода
Химические свойства каждого вещества проявляются в химических реакциях при его участии.
Кислород — один из наиболее активных неметаллов. Но в обычных условиях он реагирует с немногими веществами. Его реакционная способность существенно возрастает с повышением температуры.
Реакции кислорода с простыми веществами
Кислород реагирует, как правило, при нагревании, с большинством неметаллов и почти со всеми металлами.
Реакция с углем (углеродом)
Известно, что уголь, нагретый на воздухе до высокой температуры, загорается. Это свидетельствует о протекании химической реакции вещества с кислородом. Теплоту, которая выделяется при этом, используют, например, для обогрева домов в сельской местности.
Основным продуктом сгорания угля является углекислый газ. Его химическая формула — 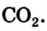
Карбон образует простые вещества — графит и алмаз. Они имеют общее название — углерод — и взаимодействуют с кислородом при нагревании согласно приведенному химическому уравнению
Реакции, при которых из нескольких веществ образуется одно, называют реакциями соединения.
Реакция с серой
Это химическое превращение осуществляет каждый, когда зажигает спичку; сера входит в состав ее головки. В лаборатории реакцию серы с кислородом проводят в вытяжном шкафу. Небольшое количество серы (светло-желтый порошок или кристаллы) нагревают в железной ложке. Вещество сначала плавится, потом загорается в результате взаимодействия с кислородом воздуха и горит едва заметным синим пламенем (рис. 56, б). Появляется резкий запах продукта реакции — сернистого газа (этот запах мы ощущаем в момент загорания спички). Химическая формула сернистого газа — 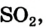

Рис. 56. Сера (а) и ее горение на воздухе (б) и в кислороде (в) 
Если ложку с горящей серой поместить в сосуд с кислородом, то сера будет гореть более ярким пламенем, чем на воздухе (рис. 56, в). Это можно объяснить тем, что молекул 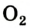
Рис. 57.Красный фосфор (а) и его горение на воздухе (б) и в кислороде (в)
Реакция с фосфором
Фосфор, как и сера, горит в кислороде интенсивнее, чем на воздухе (рис. 57). Продуктом реакции является белое твердое вещество — фосфор 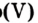
Реакция с магнием. Раньше эту реакцию использовали фотографы для создания яркого освещения («магниевая вспышка») при фотосъемке. В химической лаборатории соответствующий опыт проводят так. Металлическим пинцетом берут магниевую ленту и поджигают на воздухе. Магний сгорает ослепительно-белым пламенем (рис. 58, б); смотреть на него нельзя! В результате реакции образуется белое твердое вещество. Это соединение Магния с Оксигеном; его название — магний оксид.
Рис. 58. Магний (а) и его горение на воздухе (б)
Реакции кислорода со сложными веществами
Кислород может взаимодействовать с некоторыми оксигенсодержащими соединениями. Например, угарный газ СО горит на воздухе с образованием углекислого газа:
Немало реакций кислорода со сложными веществами мы осуществляем в повседневной жизни, сжигая природный газ (метан), спирт, древесину, бумагу, керосин и др. При их горении образуются углекислый газ и водяной пар:
Оксиды
Продуктами всех реакций, рассмотренных в параграфе, являются бинарные соединения элементов с Оксигеном.
Соединение, образованное двумя элементами, одним из которых является Оксиген, называют оксидом.
Общая формула оксидов —
Каждый оксид имеет химическое название, а некоторые — еще и традиционные, или тривиальные
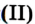
Таблица 4
Формулы и названия некоторых оксидов
| Формула | Название | |
|---|---|---|
| традиционное (тривиальное) | химическое | |
| СаО | Негашеная известь | Кальций оксид |
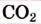 | Углекислый газ | Карбон 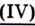 оксид оксид |
| СО | Угарный газ | Карбон 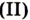 оксид оксид |
Выводы:
Кислород — химически активное вещество. Он взаимодействует с большинством простых веществ, а также со сложными веществами. Продуктами таких реакций являются соединения элементов с Оксигеном — оксиды.
Реакции, при которых из нескольких веществ образуется одно, называют реакциями соединения.
Горение и кислород
Рассмотренные в предыдущем параграфе реакции с участием кислорода сопровождаются одинаковыми внешними эффектами.
Химическую реакцию, во время которой выделяется теплота и появляется пламя, называют горением.
Пламя возникает вследствие свечения раскаленных частиц веществ, которые сгорают или образуются во время реакции.
Для того чтобы горючее вещество воспламенилось, необходимы такие условия:
- наличие кислорода (воздуха);
- нагревание вещества до температуры самовозгорания (для бензина она составляет 220 °С, сухой древесины — 250—300 °С, бумаги — 440 °С, угля — свыше 600 °С).
Кислород поддерживает горение веществ, но сам не горит.
Если не выполняется хотя бы одно из этих условий, то горение не происходит. Это учитывают во время работы с огнеопасными веществами, а также при тушении пожаров.
Погасить огонь можно, залив горящее вещество или предмет водой, засыпав его песком или землей, накрыв одеялом или направив на него струю углекислого газа (он не поддерживает горения и тяжелее воздуха) (рис. 63).
Рис. 63. Гашение пламени:
а — водой; б — песком; в — углекислым газом
В лабораториях, на предприятиях с этой целью используют огнетушители (рис. 64). 
Рис. 64. Огнетушитель (а)и его использование (б)
Окисление и кислород
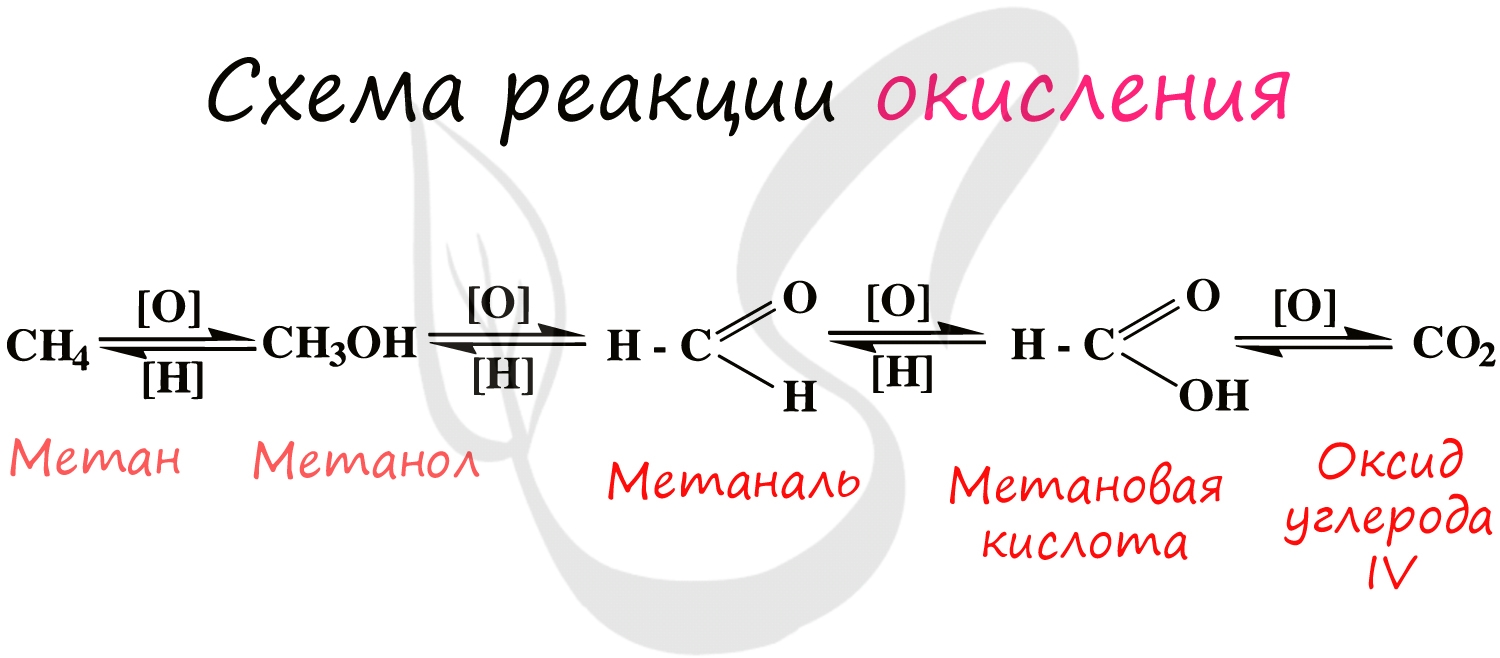
Взаимодействие веществ с кислородом не всегда сопровождается их горением. Большинство таких реакций происходят медленно, иногда — незаметно. Вещество, которое взаимодействует с кислородом, подвергается окислению, т. е. изменяется при участии кислорода.
Медленным окислением веществ обусловлено появление ржавчины на железе, прокисание молока, прогорание масла, порча многих других продуктов питания.
Реакции веществ с кислородом, которые не сопровождаются горением, используют в цветной металлургии, химической промышленности.
Кислород, поступая через легкие в организм животного или человека, окисляет различные вещества, в том числе и те, которые постоянно поступают вместе с пищей.
Выводы:
При взаимодействии некоторых веществ с кислородом происходит их горение — химическое превращение с выделением теплоты и появлением пламени.
Условиями, необходимыми для горения, являются наличие кислорода и достижение веществом определенной температуры. Для того чтобы погасить пламя, необходимо устранить хотя бы одно из этих условий.
Любую реакцию вещества с кислородом называют окислением. Многие из таких реакций происходят медленно и не сопровождаются появлением пламени.
Круговорот оксигена в природе
Каждое мгновение на Земле происходит множество физических и химических превращений. Эти изменения в природе являются циклическими, т. е. периодически повторяющимися.
Часть изменений, которые происходят с веществами на планете, обусловлена химическими реакциями.
Совокупность процессов, происходящих в природе, при которых атомы или ионы элемента в результате реакций переходят от одних веществ к другим, называют круговоротом элемента.
Если главным веществом в круговороте Оксигена выбрать кислород, то можно выделить такие звенья круговорота (схема 8):
- расходование, или связывание, кислорода (процессы дыхания, сгорания топлива и горючего, окисление различных веществ в природе, в технологических процессах);
- взаимопревращение оксигенсодержащих соединений;
- образование кислорода (процесс фотосинтеза, разложение воды в верхних слоях атмосферы). Неизменность содержания кислорода в атмосфере свидетельствует о том, что процессы связывания и выделения кислорода компенсируют друг друга.
Схема 8. Круговорот Оксигена(основные звенья)
Оксиген способствует круговороту других элементов, поскольку образует с ними многочисленные соединения.
Применение кислорода в различных отраслях
Кислород используют в различных отраслях, причем в больших количествах (схема 9). В металлургии он ускоряет процесс выплавки стали и улучшает ее качество. Этот газ необходим в производстве многих химических соединений, используется в специальных устройствах для резки и сварки металлов (водородно-кислородные, ацетиленово-кислородные горелки). Баллоны, наполненные кислородом (рис. 66) или его смесью с инертным газом гелием, используют космонавты, военные летчики, пожарники, водолазы. Кислородные подушки применяют при некоторых заболеваниях для облегчения дыхания. С помощью сжиженного кислорода создают необходимые условия для сгорания горючего в космических ракетах.

Схема 9.Применение кислорода
Широко используется и кислород, входящий в состав воздуха. При его участии сгорает топливо на теплоэлектростанциях, горючее в двигателях автомобилей, обжигают металлические руды на заводах цветной металлургии.
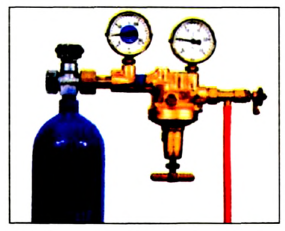
Рис. 66. Баллон с кислородом
Во время сжигания топлива и горючего образуется и попадает в воздух значительное количество угарного (СО) и сернистого 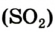
Биологическая роль кислорода
Кислород необходим живым существам для дыхания. Попадая через легкие в организм, этот газ соединяется с гемоглобином (компонент крови) и поступает во все органы и ткани. При участии кислорода происходят различные реакции. Некоторые из них сопровождаются выделением теплоты; благодаря этому поддерживается постоянная температура тела.
Выводы:
В природе атомы Оксигена в результате химических реакций постоянно переходят от одних веществ к другим; происходит круговорот этого элемента.
Кислород широко используется в промышленности, технике, медицине, а в составе воздуха — в теплоэнергетике, автотранспорте, других областях.
Кислород необходим живым существам. Попадая в организм во время дыхания, он принимает участие во многих химических реакциях. Кислород также является продуктом фотосинтеза.
Отравление угарным газом СО происходит потому, что он реагирует с гемоглобином, и поступление кислорода в организм прекращается.
Распространение кислорода в природе и его получение
Что происходит с вами, оставаясь в закрытом помещении, без воздуха? Какие газы и сколько процентов содержится в составе воздуха, которым мы дышим?
Общая характеристика:
- Химический знак: О
- Валентность: II
Химическая формула простого вещества:
Относительная молекулярная масса простого вещества: - Относительная атомная масса:
Распространение кислорода в природе:
Кислород был открыт в 1772 году шведским ученым Карлом Шееле. Это самый распространенный в природе элемент. Примерно 49,4% массы земной коры приходится на долю кислорода. Кислород в атмосфере земного шара (по массе 23%, по объёму 21%) и в природных водах существует в растворённом виде.
Наличие кислорода в атмосферном воздухе впервые было установлено А.Лавуазье в 1774 году. Кроме кислорода в воздухе содержится 78% по объему и 75,5% по массе азота (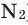
Кислород в виде соединений является основной составной частью почвы, воды, горных пород, руд, минералов. Он входит в состав всех живых организмов (растений, животных и т.д.). Приблизительно 65% человеческого тела составляет элемент кислород.
В природных соединениях встречается три изотопа 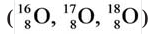
Французский химик. В 1774 году экспериментальным путем доказал состав воздуха.
Получение кислорода в лаборатории
Кислород получают в лаборатории в результате разложения воды под действием постоянного электрического тока:
В результате разложения нитрата калия. Впервые кислород был открыт К.Шееле в 1772 году в результате реакции разложения нитрата калия.
В результате разложения оксида ртути (II). В 1774 году кислород был получен английским ученым Джозефом Пристли путем нагревания оксида ртути (II) 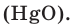
В настоящее время самыми удобными для получения кислорода в лабораторных условиях веществами являются известный в народе под названием «марганцовка» перманганат калия ( 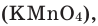
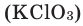
В результате разложения перманганата калия (рис. 1).
В результате разложения пероксида водорода 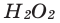
Вещества, которые ускоряют ход химических реакций, сохраняя при этом свое количество после реакции без изменения, называются катализаторами.
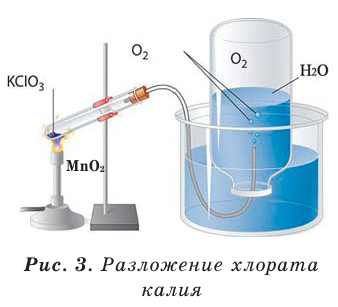
В результате разложения хлората калия (Бертолетова соль) при участии оксида марганца (IV) (рис. 3).
Без участия оксида марганца (IV) 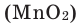
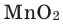
Получение кислорода в промышленности
В промышленности кислород в большом количестве получают при дистилляции сжиженного воздуха. Очистив воздух от пыли, влаги и углекислого газа, его сжижают путем сжатия под высоким давлением и охлаждения. Температуру сжиженного и охлажденного до — 200 


Свойства и применение кислорода
Рассмотрите картинки и поясните свои соображения. Какова причина длительного пребывания водолазов под водой? Где ещё используется кислородный баллон?
Физические свойства:
Кислород — это бесцветный газ без запаха и вкуса, относительно мало растворим в воде (при температуре 20°С в 100 объёмах воды растворяется 3,1 объёма кислорода). Кислород немного тяжелее воздуха, при температуре — 183 °С сжижается, а при понижении температуры до — 218,8 °С — затвердевает.
Химические свойства:
В обычных условиях кислород в чистом виде и в составе воздуха химически неактивен. Однако при нагревании его активность резко возрастает. Кислород может находиться во взаимодействии с большинством простых веществ — неметаллами и металлами, а также со сложными веществами.
Взаимодействие кислорода с неметаллами. Если раскалить под действием пламени спиртовки уголек в железной ложке, то он не загорится, а начнет дымиться. Поместим железную ложку с дымящимся угольком в банку с кислородом (для того, чтобы банка не разбилась, дно посыпаем мелким песком). Раскаленный уголек будет гореть без пламени, выделяя тепло. Если нальем в банку известковую воду 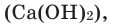
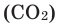
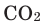
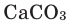
При горении раскаленного угля в условиях нехватки кислорода образуется очень опасный удушающий угарный газ:
Нагреем в железной ложке немножко серы. Сера горит слабым голубоватым пламенем. Опустим ложку в банку с кислородом. Скорость горения серы увеличивается, появляется пламя ярко-голубого цвета. В банке образуется бесцветный газ с резким запахом — серный газ ( 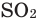
Возьмем немного фосфора в железной ложке и нагреем на огне спиртовки. Фосфор начинает гореть. Если опустить горящий фосфор в банку с кислородом, то горение ускорится и очень скоро банка наполнится белым дымом оксида фосфора (V). Горение фосфора тоже сопровождается выделением теплоты.
Все неметаллы, кроме фтора (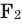
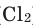
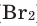
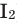
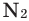
Взаимодействие кислорода с металлами. Кроме ценных (благородных) металлов (Ag, Au, Pt), большинство других металлов находятся в непосредственном взаимодействии с кислородом. Для вступления металлов в реакцию с кислородом, их следует нагреть, после чего реакция протекает самопроизвольно, с выделением света и тепла.
Магний горит в воздухе ярким, ослепительным пламенем. Если опустить ленту горящего магния в сосуд с кислородом, яркость пламени еще больше увеличится. В результате реакции образуется белый порошок оксида магния:
Если, насадив на железную проволоку деревянную щепку, мы зажжем ее и опустим в сосуд с кислородом, то вначале будет гореть кусок дерева, а затем железо. Железо горит без пламени, разбрасывая вокруг искры железной окалины.
Сложные вещества, состоящие из двух элементов, один из которых является кислородом, называются оксидами.
Взаимодействие сложных веществ с кислородом. Как и простые вещества, сложные вещества тоже могут гореть в кислороде и окисляться. Реакции взаимодействия веществ с кислородом являются реакциями окисления. Ряд оксидов, взаимодействуя с кислородом, образуют новые оксиды.
В наших квартирах ежедневно в газовых печах горит природный газ (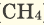
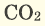
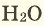
Серные соединения некоторых металлов (сульфиды) при горении в кислороде образуют два оксида.
Применение:
Сварка и резка металлов происходит при участии чистого кислорода. В металлургической и химической промышленности больше всего используется кислород из воздуха. Например, при производстве чугуна и серной кислоты использование кислорода из воздуха позволяет значительно ускорить и повысить производительность производственных процессов.
В медицине чистый кислород применяют для облегчения затрудненного дыхания. В этих целях в больницах используются кислородные подушки и заполненные чистым кислородом стальные баллоны. Летающие на большой высоте летчики, космонавты, работающие под водой водолазы также пользуются небольшими по размеру кислородными баллонами.
Все живые организмы в природе при дыхании употребляют кислород, ежегодно усваивая миллионы тонн атмосферного кислорода. Так, например, было вычислено, что только люди употребляют в течение года свыше 1330 миллиардов кубических метров атмосферного кислорода. Кроме того, в громадных количествах атмосферный кислород тратится при сжигании топлива, на процессы гниения, при вулканических извержениях (рис. 1).
В организме человека и животных происходит медленное окисление глюкозы кислородом (рис. 2).
Кислород — химический элемент и простое вещество
В периодической системе элементов кислород О расположен во втором периоде в VIА-группе. Кроме него в эту группу входят еще три неметалла — сера S, селен Se и теллур Te, а также один металл — полоний Po.
Кислород в природе
Кислород составляет почти половину массы земной коры (49 %). Он входит в состав самых разнообразных соединений: воды, оксидов, солей и т. д. Этот элемент является неотъемлемой частью живой материи — тканей растений и животных.
Основным источником кислорода на Земле является атмосферный воздух, в котором на долю кислорода приходится около 21 % по объему. Несмотря на колоссальные масштабы потребления кислорода (процессы горения, дыхания, промышленные потребности и т. д.), содержание 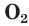
Процессы, происходящие в природе с участием кислорода, называются по-разному. Энергичное окисление с выделением тепла и света — горение, медленное окисление железа — ржавление, поглощение кислорода из воздуха живыми организмами — дыхание.
Строение атома кислорода
В атоме кислорода 8 электронов, которые располагаются на двух электронных слоях (рис. 44):
На внешнем электронном слое у атома кислорода находится 6 электронов, следовательно, до завершения этого слоя ему не хватает 2 электронов. Поэтому в своих
соединениях с металлами и водородом кислород обычно проявляет степень окисления, равную –2, как, например, в оксиде железа FeO. Кислород — второй по электроотрицательности химический элемент после фтора, поэтому только атомы фтора способны отнимать у него электроны. Положительную степень окисления +2 кислород проявляет только в соединении со фтором 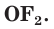
Строение и физические свойства простых веществ
С простым веществом кислородом вы уже познакомились в курсе химии 7-го класса. Напомним, что простое вещество кислород в природе существует в виде двух аллотропных модификаций — обычного кислорода 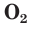
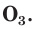
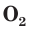
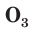
В природе озон образуется при грозовых разрядах и при окислении смолы хвойных деревьев. Небольшие количества озона в воздухе оказывают целебное действие на людей. Однако сильное обогащение воздуха озоном может стать опасным для здоровья. Увеличение содержания озона в воздухе выше предельно допустимой концентрации приводит к появлению головных болей, раздражению дыхательных путей и глаз, а затем к ослаблению сердечной деятельности. Источниками озона являются работающие приборы, в которых происходит высоковольтный электрический разряд — копировальные установки и лазерные принтеры, а также источники ультрафиолетового и рентгеновского излучения. Поэтому помещения, в которых находятся такие приборы, необходимо часто проветривать.
Озон сосредоточен в верхних слоях атмосферы, образуя озоновый слой, который защищает Землю и ее обитателей от жесткого ультрафиолетового излучения Солнца. Поверхности Земли достигают только те ультрафиолетовые лучи, которые не опасны для живых организмов. Когда мы загораем на солнце, на нашу кожу падают «мягкие» ультрафиолетовые лучи, не способные принести вреда здоровью (если загорать в меру).
Кислород и озон в воде мало растворимы. При 20 °С в 100 объемах 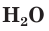
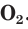
Химические свойства кислорода
Из-за высокой химической активности простое вещество кислород взаимодействует с большинством простых веществ и многими сложными веществами. Практически во всех своих реакциях кислород выступает в качестве окислителя.
Основными продуктами реакций кислорода с простыми веществами обычно являются оксиды. Окисление некоторых металлов происходит даже без нагревания, например:
Но для протекания большинства реакций кислорода с металлами требуется нагревание, иногда значительное.
При окислении кислородом неметаллов обычно выделяется большое количество теплоты, как, например, при горении углерода и водорода:
Кислород легко окисляет и многие сложные вещества. Например, известный вам из курса химии 7-го и 8-го классов оксид углерода(II) окисляется до углекислого газа:
При окислении сульфида цинка образуются два оксида — оксид цинка и оксид серы(IV):
Окисляются кислородом и органические вещества, например метан:
При этом, как правило, также образуются оксиды. Высокая окислительная способность кислорода является основой горения всех видов топлива.
С химическими свойствами озона вы познакомитесь в 11-м классе.
Применение кислорода и озона
Применение кислорода основано на его окислительных свойствах и свойстве поддерживать дыхание. Как окислитель он широко используется в металлургии, химической промышленности, других технологических процессах. Кислород применяют в качестве окислителя топлива в ракетных двигателях (рис. 47).
С участием кислорода совершается один из важнейших процессов жизнедеятельности живых организмов — дыхание. Окисление кислородом жиров, белков и углеводов служит источником энергии для живых организмов.
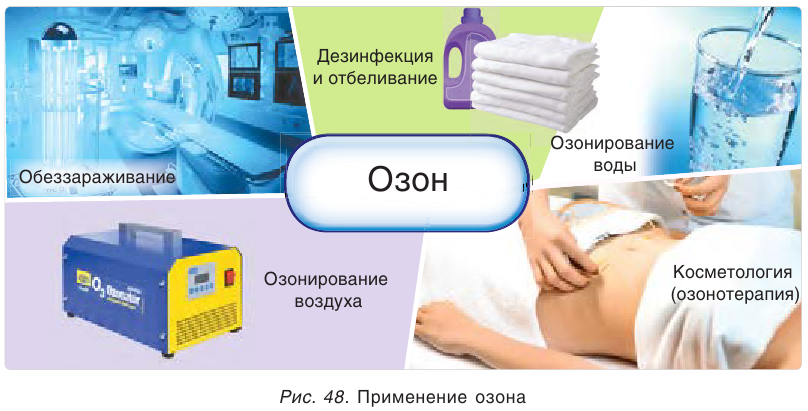
Озон используется для озонирования воздуха и питьевой воды, обезвреживания промышленных сточных вод, как дезинфицирующее средство в медицине, в качестве отбеливающего средства (рис. 48).
Атомы кислорода имеют на внешнем электронном слое по 6 электронов.
В соединениях с другими элементами кислород чаще всего проявляет степень окисления –2.
Известны две аллотропные модификации кислорода: кислород 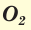
Кислород реагирует со многими простыми и сложными веществами.
Практически во всех реакциях кислород выступает в качестве окислителя.
| Рекомендую подробно изучить предметы: |
|
| Ещё лекции с примерами решения и объяснением: |
- Водород как химический элемент
- Вода в химии и её элементный состав, молекулярное строение, формула и молярная масса
- Железо как химический элемент
- Озон как химический элемент
- Место химии в системе наук
- Перспективы химического производства
- Типы химических реакций в химии
- Атом в химии
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
http://studarium.ru/article/172
http://www.evkova.org/kislorod-kak-himicheskij-element-v-himii







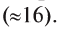
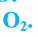


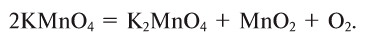
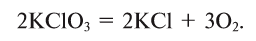
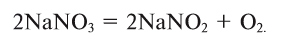
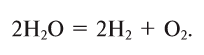

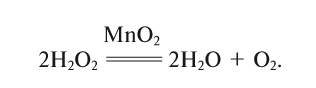
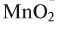

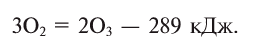
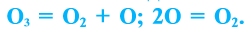
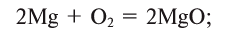
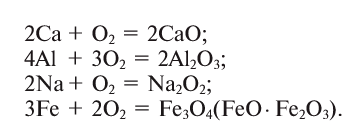
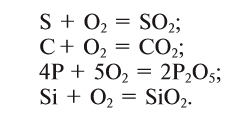
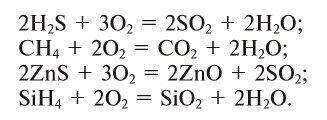

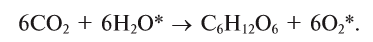
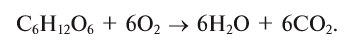
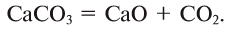


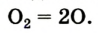
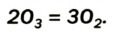

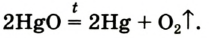
 (бытовое название — марганцовка; вещество является распространенным дезинфицирующим средством)
(бытовое название — марганцовка; вещество является распространенным дезинфицирующим средством)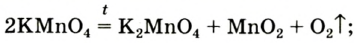
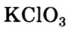 (тривиальное название — бертолетова соль, в честь французского химика конца XVIII — начала XIX в. K.-Л. Бертолле)
(тривиальное название — бертолетова соль, в честь французского химика конца XVIII — начала XIX в. K.-Л. Бертолле)