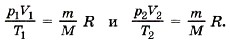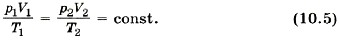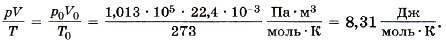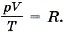Какая форма уравнения состояния содержит больше информации: уравнение Клапейрона или уравнение Менделеева — Клапейрона?
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,247
- разное 16,834
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Какая форма уравнения состояния содержит больше информации : уравнения Клоперона или Менделеева Клопирона ?
Физика | 5 — 9 классы
Какая форма уравнения состояния содержит больше информации : уравнения Клоперона или Менделеева Клопирона ?
И формулу пожалуйста).
Они равносильны, каждая подходит под определенную задачу.
Pv = m / M * R * T — М.
К. p * v / T = const — К.
M — молярная масса
R — справочная величина
T — температура в Кельвинах.
МКТ. Уравнение Менделеева — Клайперона?
МКТ. Уравнение Менделеева — Клайперона.
МКТ — (основное уравнение МКТ, уравнение состояния, газовый закон)?
МКТ — (основное уравнение МКТ, уравнение состояния, газовый закон).
Уравнение состояния идеального газа (уравнение Клапейрона — Менделеева) имеет вид?
Уравнение состояния идеального газа (уравнение Клапейрона — Менделеева) имеет вид.
Вывести из уравнения Менделеева — Клапейрона формулу универсальной газовой постоянной?
Вывести из уравнения Менделеева — Клапейрона формулу универсальной газовой постоянной?
Как выразить из формулы?
Как выразить из формулы.
Как выразить из формулы PV = m / M * RT (уравнение Менделеева — Клапейрона) как выразить массу.
Представление основного уравнения МКТ в виде уравнения состояния?
Представление основного уравнения МКТ в виде уравнения состояния.
Напишите пожалуйста уравнение состояния идеального газа?
Напишите пожалуйста уравнение состояния идеального газа.
Как из формулы уравнения состояния идеального газа вывести обьём?
Как из формулы уравнения состояния идеального газа вывести обьём.
Как узнать массу воздуха в комнате из уравнения менделеева — клайперона , не зная объема комнаты?
Как узнать массу воздуха в комнате из уравнения менделеева — клайперона , не зная объема комнаты?
Выразите, пожалуйста, V из формулы менделеева — клапейрона pv = mRT \ M?
Выразите, пожалуйста, V из формулы менделеева — клапейрона pv = mRT \ M.
На этой странице вы найдете ответ на вопрос Какая форма уравнения состояния содержит больше информации : уравнения Клоперона или Менделеева Клопирона ?. Вопрос соответствует категории Физика и уровню подготовки учащихся 5 — 9 классов классов. Если ответ полностью не удовлетворяет критериям поиска, ниже можно ознакомиться с вариантами ответов других посетителей страницы или обсудить с ними интересующую тему. Здесь также можно воспользоваться «умным поиском», который покажет аналогичные вопросы в этой категории. Если ни один из предложенных ответов не подходит, попробуйте самостоятельно сформулировать вопрос иначе, нажав кнопку вверху страницы.
Формула = > Q = mc( t2 — t1) Подставляем данные : 4 * 880 ( 30 — 15) = 4 * 880 * 15 = 52 800 Джоулей, переводим в кДж ( килоДжоули), получаем 52, 8 кДж Ответ : 52, 8 кДж.
какая форма уравнения состояния содержит больше информации клапейрона или менделеева клапейрона
§ 63. Уравнение состояния идеального газа
В этой главе вы не встретите принципиально новых сведений о газах. Речь пойдёт о следствиях, которые можно извлечь из понятия температуры и других макроскопических параметров. Основное уравнение молекулярнокинетической теории газов вплотную приблизило нас к установлению связей между этими параметрами.
Как можно рассчитать массу воздуха в кабинете физики?
Какие параметры воздуха будут необходимы для определения этой массы?
Мы детально рассмотрели поведение идеального газа с точки зрения молекулярно-кинетической теории. Была определена зависимость давления газа от концентрации его молекул и температуры (см. формулу (9.17)).
На основе этой зависимости можно получить уравнение, связывающее все три макроскопических параметра р, V и Т, характеризующие состояние идеального газа данной массы.

Запомни
Уравнение, связывающее три макроскопических параметра р, V и Т, называют уравнением состояния идеального газа.
Подставим в уравнение р = nkT выражение для концентрации молекул газа. Учитывая формулу (8.8), концентрацию газа можно записать так:
где NA — постоянная Авогадро, m — масса газа, М — его молярная масса. После подстановки формулы (10.1) в выражение (9.17) будем иметь
Запомни
Произведение постоянной Больцмана k и постоянной Авогадро NA называют универсальной (молярной) газовой постоянной и обозначают буквой R:
Подставляя в уравнение (10.2) вместо kNA универсальную газовую постоянную R, получаем
Важно
уравнение состояния идеального газа произвольной массы
Единственная величина в этом уравнении, зависящая от рода газа, — это его молярная масса.
Из уравнения состояния вытекает связь между давлением, объёмом и температурой идеального газа, который может находиться в двух любых состояниях.
Если индексом 1 обозначить параметры, относящиеся к первому состоянию, а индексом 2 — параметры, относящиеся ко второму состоянию, то согласно уравнению (10.4) для газа данной массы
Правые части этих уравнений одинаковы, следовательно, должны быть равны и их левые части:
Известно, что один моль любого газа при нормальных условиях (р0 = 1 атм = 1,013 • 10 5 Па, t = 0 °С или Т = 273 К) занимает объём 22,4 л. Для одного моля газа, согласно соотношению (10.5), запишем:
Мы получили значение универсальной газовой постоянной R.
Таким образом, для одного моля любого газа
Запомни
Уравнение состояния в форме (10.4) было впервые получено великим русским учёным Д. И. Менделеевым. Его называют уравнением Менделеева—Клапейрона.
Уравнение состояния в форме (10.5) называется уравнением Клапейрона и представляет собой одну из форм записи уравнения состояния.

Его имя внесено в список величайших учёных Франции, помещённый на первом этаже Эйфелевой башни.
Уравнение состояния не надо выводить каждый раз, его надо запомнить. Неплохо было бы помнить и значение универсальной газовой постоянной:
До сих пор мы говорили о давлении идеального газа. Но в природе и в технике мы очень часто имеем дело со смесью нескольких газов, которые при определённых условиях можно считать идеальными.
Самый важный пример смеси газов — воздух, являющийся смесью азота, кислорода, аргона, углекислого газа и других газов. Чему же равно давление смеси газов?
Для смеси газов справедлив закон Дальтона.
Закон Дальтона
Давление смеси химически невзаимодействующих газов равно сумме (ЦЩй их парциальных давлений:
где рi — парциальное давление i-й компоненты смеси.
Ключевые слова для поиска информации по теме параграфа.
Уравнение состояния. Универсальная газовая постоянная
Вопросы к параграфу
1. Что называют уравнением состояния?
2. Какая форма уравнения состояния содержит больше информации: уравнение Клапейрона или уравнение Менделеева — Клапейрона?
3. Почему газовая постоянная R называется универсальной?
4. Сформулируйте закон Дальтона.
Образцы заданий ЕГЭ
A1. Уравнение Менделеева—Клапейрона
1) связывает между собой макропараметры газа
2) связывает между собой микропараметры газа
3) связывает макропараметры газа с его микропараметрами
4) не связано ни с микропараметрами, ни с макропараметрами
A2.Кислород находится в сосуде вместимостью 0,4 м 3 под давлением 8,3 • 10 5 Па и при температуре 320 К. Чему равна масса кислорода? Молярная масса кислорода 0,032 кг/моль.
A3.Азот массой 0,3 кг при температуре 280 К оказывает давление на стенки сосуда, равное 8,3 • 10 4 Па. Чему равен объём газа? Молярная масса азота 0,028 кг/моль.
1) 0,3 м 3 2) 3,3 м 3 3) 0,6 м 3 4) 60 м 3
A4.В сосуде находится жидкий азот N2 массой 10 кг. Какой объём займёт этот газ при нормальных условиях (273 К; 100 кПа)? Молярная масса азота 0,028 кг/моль.
1) 4,05 м 3 2) 8,1 м 3 3) 16,2 м 3 4) 24,3 м 3
A5.В баллоне вместимостью 1,66 м3 находится азот массой 2 кг при давлении 100 кПа. Чему равна температура этого газа? Молярная масса азота 0,028 кг/моль.
Какая форма уравнения состояния содержит больше информации клапейрона или менделеева клапейрона
где NА — число Авогадро, k — постоянная Больцмана.
Такие процессы называют изопроцессами. Законы, описывающие изопроцессы, были открыты задолго до теоретического вывода уравнения состояния идеального газа.
V= const => p/T = const — закон Шарля
Сначала найдем, сколько альфа-частиц (то есть атомов гелия) образовалось за один год. Обозначим это число как N атомов:
N = 3,7·10 10 · 0,5 г · 60 сек · 60 мин · 24 час · 365 дней = 5,83·10 17 атомов.
Запишем уравнение Клапейрона-Менделеева PV = nRT и заметим, что число молей гелия n = N/NA. Отсюда:
В начале XX века этот способ определения постоянной Авогадро был самым точным. Но почему так долго (в течение года) длился эксперимент? Дело в том, что радий добывается очень трудно. При его малом количестве (0,5 г) радиоактивный распад этого элемента дает очень мало гелия. А чем меньше газа в замкнутом сосуде, тем меньшее он создаст давление и тем большей будет ошибка измерения. Понятно, что ощутимое количество гелия может образоваться из радия только за достаточно долгое время.
Отважнее! В область хаоса!
Урок физики 10 класс
Учитель Гребенюк Л.И.
Хезеф Луи Гей-Люссак
Уравнение состояния идеального газа
Для любого газа зависимость этих величин выглядит так:
Уравнением состояния идеального газа
Уравнением Клапейрона (1834г)
Клапейрон Бенуа Поль Эмиль
Универсальная газовая постоянная
Умножим обе части уравнения на ν = m/M
Менделеев Дмитрий Иванович
Обобщив уравнение Клапейрона,
в 1874 вывел общее уравнение состояния идеального газа
Для чего это нужно
( Будет изучаться в конце раздела «Молекулярная физика»)
1.Чему равен объем, который занимает водород массой 1 кг при температуре 27 ºС и давлении 100 кПа?
2.При давлении 100000 Па и температуре 27 ºС плотность газа равна 0, 162 кг/ м 3 Определите какой это газ?
Уравнение состояния идеального газа
Математическая запись универсального газового закона проста:
Она содержит основные характеристики поведения газов: p, V и T — соответственно давление, объем и абсолютная температура газа (в градусах Кельвина), R — универсальная газовая постоянная, общая для всех газов, а n — число, пропорциональное числу молекул или атомов газа (так называемое число молей газа — см. Закон Авогадро).
Чтобы понять, как работает этот закон, давайте представим, что температура газа постоянна. В этом случае в правой части уравнения получается константа. Значит, произведение давления и объема при неизменной температуре оказывается неизменным. Повышение давления сопровождается уменьшением объема, и наоборот. Это не что иное, как закон Бойля—Мариотта — одна из первых экспериментально полученных формул, описывающих поведение газов. С другой стороны, при постоянном давлении (например, внутри воздушного шарика, где давление газа равно атмосферному) повышение температуры сопровождается увеличением объема. А это — закон Шарля, другая экспериментальная формула поведения газов. Закон Авогадро и закон Дальтона также являются следствиями универсального газового закона.
Этот закон представляет собой то, что в физике принято называть уравнением состояния вещества, поскольку он описывает характер изменения свойств вещества при изменении внешних условий. Строго говоря, этот закон в точности выполняется только для идеального газа. Идеальный газ представляет собой упрощенную математическую модель реального газа: молекулы считаются движущимися хаотически, а соударения между молекулами и удары молекул о стенки сосуда — упругими, то есть не приводящими к потерям энергии в системе. Такая упрощенная модель очень удобна, поскольку позволяет обойти очень неприятную трудность — необходимость учитывать силы взаимодействия между молекулами газа. И это себя оправдывает, поскольку в природных условиях поведение большинства реальных газов практически не отличается от поведения идеального газа — отклонения в поведении практически всех природных газов, например атмосферного азота и кислорода, от поведения идеального газа не превышают 1%. Это позволяет ученым спокойно включать уравнение состояния идеального газа даже в весьма сложные теоретические расчеты. Например, астрономы при моделировании горячих звезд обычно считают вещество звезды идеальным газом и весьма точно прогнозируют давления и температуры внутри них. (Заметьте, что вещество внутри звезды ведет себя как идеальный газ, хотя его плотность несопоставимо выше плотности любого вещества в земных условиях. А дело в том, что вещество звезды состоит из полностью ионизированных ядер водорода и гелия — то есть из частиц значительно меньшего диаметра, чем диаметр атомов земных газов.) В будущем, по мере совершенствования теоретических методов, возможно, будут выведены более точные уравнения для описания состояния реальных газов с учетом их характеристик на молекулярном уровне.
* Эта формула была получена в 1874 году Д. И. Менделеевым путем объединения закона Авогадро и общего газового закона (pV/ T = const), сформулированного в 1834 году Б. П. Э. Клапейроном. Поэтому этот закон (в Европе, по крайней мере) принято называть законом Менделеева—Клапейрона. По существу, этот закон позволил ввести все ранее сделанные эмпирические заключения о характере поведения газов в рамки новой молекулярно-кинетической теории. (Примечание переводчика)
Какая форма уравнения состояния содержит больше информации клапейрона или менделеева клапейрона
Физика → Методика → Экзамены → Ответы на билеты устных экзаменов → 8. Уравнение состояния идеального газа (уравнение Менделеева—Клапейрона). Изопроцессы
Состояние данной массы газа полностью определено, если известны его давление, температура и объем. Эти неличины называют параметрами состояния газа. Уравнение, связывающее параметры состояния, называют уравнением состояния.
Для произвольной массы газа состояние газа описывается уравнением Менделеева—Клапейрона:
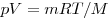
где 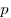
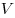
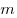
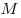
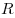
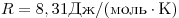
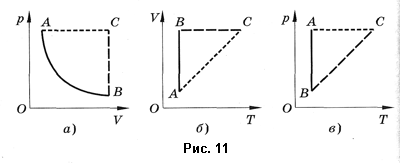
Уравнение Менделеева—Клапейрона показывает, что возможно одновременное изменение трех параметров, характеризующих состояние идеального газа. Однако многие процессы в газах, происходящие в природе и осуществляемые в технике, можно рассматривать приближенно как процессы, в которых изменяются лишь два параметра. Особую роль в физике и технике играют три процесса: изотермический, изохорный и изобарный.
Изопроцессом называют процесс, происходящий с данной массой газа при одном постоянном параметре — температуре, давлении или объеме. Из уравнения состояния как частные случаи получаются законы для изопроцессов.
Изотермическим называют процесс, протекаю-щий при постоянной температуре: 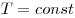
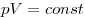
Изохорным называют процесс, протекающий при постоянном объеме: 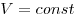
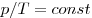
Изобарным называют процесс, протекающий при постоянном давлении. Уравнение этого процесса имеет вид 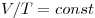
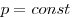
Реальные газы удовлетворяют уравнению состоя ния идеального газа при не слишком высоких давлениях (пока собственный объем молекул пренебрежимо мал по сравнению с объемом сосуда, в котором находится газ) и при не слишком низких температуpax (пока потенциальной энергией межмолекулярного взаимодействия можно пренебречь по сравнению с кинетической энергией теплового движения молекул), т. е. для реального газа это уравнение и его следствия являются хорошим приближением.
http://fizika.my-dict.ru/q/2493799_kakaa-forma-uravnenia-sostoania-soderzit-bolse/
http://pvh-al.ru/kakoy/kakaya-forma-uravneniya-sostoyaniya-soderzhit-bolshe-informatsii-klapeyrona-ili-mendeleeva-klapeyrona.html