Какие макроскопические параметры связывает уравнение Клапейрона—Менделеева?
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,296
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,203
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Уравнение МКТ идеального газа — основные понятия, формулы и определение с примерами
Содержание:
Фазовые состояния вещества:
В МКТ различают три фазовых (агрегатных) состояния вещества: жидкое, кристаллическое, газообразное (существует и четвертое состояние — плазма, и оно самое распространенное во Вселенной, ведь именно в состоянии плазмы находится вещество в звездах). Изменение фазового состояния называют фазовым переходом. Рассмотрим разные фазовые состояния вещества и выясним особенности движения и взаимодействия молекул вещества в разных состояниях.
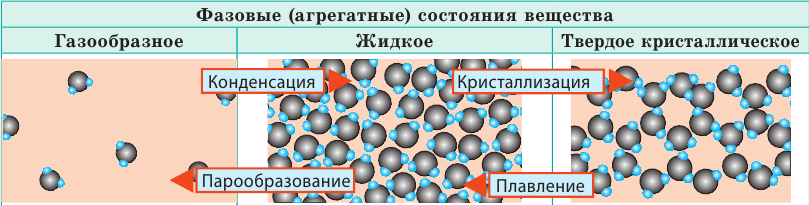 | ||
| Слово «газ» происходит от греческого слова chaos («хаос»). Молекулы газов расположены беспорядочно и на расстояниях, которые в десятки раз больше размеров самих молекул. На таких расстояниях молекулы практически не взаимодействуют друг с другом. Непрерывно сталкиваясь, молекулы газов разлетаются во все стороны, пока не встретят какое-либо препятствие, например стенки сосуда. Именно поэтому газы не имеют формы и занимают весь предоставленный объем. Большими расстояниями между молекулами объясняется и тот факт, что газы легко сжимаются. | Молекулы жидкости в целом расположены хаотично, однако в расположении ближайших молекул сохраняется определенный (ближний) порядок. Среднее расстояние между молекулами примерно равно размерам молекул, и межмолекулярные силы удерживают их около положения равновесия. Каждая молекула жидкости некоторое время (порядка 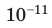 | В веществе, находящемся в твердом кристаллическом состоянии, молекулы расположены в определенном порядке (образуют кристаллическую решетку) на расстояниях, примерно равных размерам самих молекул, поэтому силы межмолекулярного взаимодействия удерживают их около положения равновесия. В отличие от жидкостей, перескакивания молекул в твердых телах происходят очень редко — каждая молекула сохраняет положение равновесия достаточно долго, а ее движение сводится к колебаниям около этого положения. Поэтому твердые тела сохраняют и объем, и форму; как и жидкость, их очень трудно сжать. |
Молекулы некоторых твердых тел в целом расположены беспорядочно. Такое состояние вещества называют аморфным. Вещества в аморфном состоянии напоминают очень вязкие жидкости. Так, если положить в сосуд кусочки смолы (аморфное вещество), со временем смола сольется и примет форму сосуда.
В отличие от кристаллических, аморфные вещества не имеют определенной температуры плавления, а переходят в жидкое состояние постепенно размягчаясь. Аморфное состояние веществ неустойчиво — постепенно происходит кристаллизация. Так, стекло имеет аморфную структуру, но со временем в нем образуются помутнения — кристаллики кварца. Сахар — это молекулярный кристалл. Если его расплавить и охладить, получим леденец — аморфное состояние сахара. Но через некоторое время в леденце начнут расти кристаллики сахара. Именно по этой причине засахаривается варенье.
- Молекулы, атомы, ионы находятся в непрерывном хаотическом движении. Именно движением частиц вещества можно объяснить такие явления, как броуновское движение (видимое в микроскоп хаотическое перемещение малых макрочастиц, взвешенных в жидкости или газе) и диффузия (взаимное проникновение соприкасающихся веществ друг в друга).
- Частицы вещества взаимодействуют друг с другом. Основная причина межмолекулярного взаимодействия — электрическое притяжение и отталкивание заряженных частиц, образующих атом. На расстояниях, которые больше размеров молекул, молекулы притягиваются друг к другу; на расстояниях, которые незначительно меньше размера молекул, — отталкиваются.
- Вещество может находиться в твердом, жидком и газообразном фазовых (агрегатных) состояниях в зависимости от того, как расположены, как двигаются и как взаимодействуют его частицы.
Основное уравнение МКТ идеального газа
Каждое макроскопическое тело состоит из огромного количества молекул. МКТ рассматривает строение и свойства макроскопических тел, а также процессы, происходящие в этих телах, с точки зрения их молекулярной структуры. Поведение макроскопических тел описывается рядом физических величин — микроскопическими и макроскопическими параметрами. Выясним, что это за параметры и как они связаны.
Микроскопические и макроскопические параметры
Рассмотрим систему, состоящую из очень большого количества атомов или молекул. Такой системой, например, может быть какой-либо газ. В любой момент времени каждая микрочастица газа обладает энергией, движется с некоторой скоростью, имеет массу.
Физические величины, характеризующие свойства и поведение отдельных микрочастиц вещества, называют микроскопическими параметрами.
Некоторые микроскопические параметры могут изменяться без внешнего воздействия на систему. Например, скорости движения молекул газа непрерывно изменяются в результате их столкновений друг с другом.
В то же время газ данной массы занимает некоторый объем, создает давление, имеет температуру. Значения этих физических величин определяются совокупностью множества молекул — например, мы не можем говорить о давлении, температуре или плотности одной молекулы.
Физические величины, характеризующие свойства и поведение макроскопических тел без учета их молекулярного строения, называют макроскопическими параметрами.
Макроскопические параметры могут изменяться только за счет внешних воздействий на систему или за счет теплообмена. Так, чтобы увеличить давление газа, газ нужно нагреть (передать определенное количество теплоты) или сжать (то есть совершить работу).
Какой газ называют идеальным
Количественные закономерности, связывающие макроскопические и микроскопические параметры тел, достаточно сложны. Рассмотрим самый простой случай — достаточно разреженные газы (такими, например, являются обычные газы при нормальных условиях). В разреженных газах расстояние между молекулами во много раз превышает размеры самих молекул, поэтому эти молекулы можно считать материальными точками, а их взаимодействием, за исключением моментов соударения, можно пренебречь. Кроме того, свойства разреженных газов практически не зависят от их молекулярного состава, а столкновения молекул такого газа приближаются к упругим. Таким образом, вместо реальных газов можно рассматривать их физическую модель — идеальный газ.
Идеальный газ — это физическая модель газа, молекулы которого принимают за материальные точки, не взаимодействующие друг с другом на расстоянии и упруго взаимодействующие в моменты столкновений.
Основное уравнение МКТ идеального газа
Начнем с такого микроскопического параметра, как скорость движения молекул. Обратим внимание на то, что бессмысленно рассматривать движение каждой отдельной молекулы и устанавливать скорость ее движения в данный момент времени, да это и невозможно: число молекул огромно, и за секунду каждая молекула изменяет скорость своего движения миллиарды раз. Поэтому физики используют средние значения скоростей молекул. Важнейшим в МКТ является понятие средний квадрат скорости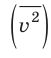
где N — число молекул; 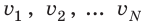
Квадратный корень из среднего квадрата скорости называют средней квадратичной скоростью движения молекул (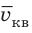
Понятно, что средний квадрат скорости (а следовательно, и среднюю квадратичную скорость) невозможно определить с помощью прямых измерений. Однако эта величина связана с определенными макроскопическими (измеряемыми) параметрами газа, например с давлением.
Напомним, что давление газа обусловлено ударами его молекул (рис. 28.1). Находясь в непрерывном хаотическом движении, молекулы газа сталкиваются со стенками сосуда и поверхностью любого тела в газе, действуя на них с некоторой силой. Суммарная сила воздействия частиц на единицу площади поверхности и есть давление газа: 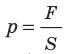
Уравнение зависимости давления p идеального газа от массы 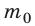
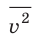
Здесь n — концентрация молекул газа — физическая величина, равная числу молекул в единице объема газа:
Средняя кинетическая энергия поступательного движения молекул идеального газа (кинетическая энергия поступательного движения, в среднем приходящаяся на одну молекулу) равна: 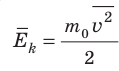
Пример решения задачи
Определите плотность идеального газа, находящегося под давлением 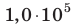
Решение:
В задаче нужно найти макроскопический параметр — плотность газа. Для решения задачи воспользуемся основным уравнением МКТ идеального газа:
Поскольку ρ = 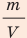
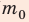
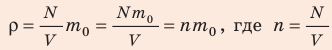
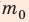
Отсюда 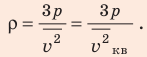
Проверим единицу, найдем значение искомой величины:
Анализ результата. Плотности газов при нормальных условиях колеблются от 0,09 до 1,5 кг/м3, то есть получен реальный результат.
Ответ: ρ = 1, 2 кг/м3.
- Физические величины, характеризующие свойства и поведение отдельных микрочастиц вещества, называют микроскопическими параметрами. Физические величины, характеризующие свойства и поведение макроскопических тел без учета их молекулярного строения, называют макроскопическими параметрами.
- Идеальный газ — это физическая модель газа, молекулы которого принимают за материальные точки, не взаимодействующие друг с другом на расстоянии и упруго взаимодействующие в момент столкновения.
- Основное уравнение МКТ идеального газа связывает макроскопический параметр (давление) с микроскопическими параметрами (массой и средним квадратом скорости движения молекул):
. Это уравнение можно записать в виде:
.
| Рекомендую подробно изучить предметы: |
|
| Ещё лекции с примерами решения и объяснением: |
- Уравнение состояния идеального газа
- Температура в физике
- Парообразование и конденсация
- Тепловое равновесие в физике
- Движение тел под воздействием нескольких сил
- Абсолютно упругие и неупругие столкновения тел
- Механизмы, работающие на основе правила моментов
- Идеальный газ в физике
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Конспект по теме «Уравнение Клапейрона-Менделеева»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
№24. Уравнение Клапейрона-Менделеева. Уравнение состояния идеального газа. Молярная газовая постоянная.
Объединенный газовый закон.
Макроскопические величины, однозначно характеризующие состояние газа, называют термодинамическими параметрами газа.
Важнейшими термодинамическими параметрами газа являются его объем V, давление р и температура Т.
Всякое изменение состояния газа называется термодинамическим процессом.
В любом термодинамическом процессе изменяются параметры газа, определяющие его состояние.
Соотношение между значениями тех или иных параметров в начале и конце процесса называется газовым законом .
Газовый закон, выражающий связь между всеми тремя параметрами газа называется объединенным газовым законом.
Соотношение p = nkT связывающее давление газа с его температурой и концентрацией молекул, получено для модели идеального газа, молекулы которого взаимодействуют между собой и со стенками сосуда только во время упругих столкновений. Это соотношение может быть записано в другой форме, устанавливающей связь между макроскопическими параметрами газа – объемом V, давлением p, температурой T и количеством вещества ν. Для этого нужно использовать равенства
где n – концентрация молекул, N – общее число молекул, V – объем газа
Тогда получим 
Так как при постоянной массе газа N остается неизменным, то Nk – постоянное число, значит
При постоянной массе газа произведение объема на давление, деленное на абсолютную температуру газа, есть величина одинаковая для всех состояний этой массы газа.
Уравнение, устанавливающее связь между давлением, объемом и температурой газа было получено в середине XIX века французским физиком Б. Клапейроном и часто его называют уравнением Клапейрона.
Уравнение Клапейрона можно записать в другой форме.
Здесь N – число молекул в сосуде, ν – количество вещества, NА – постоянная Авогадро, m – масса газа в сосуде, M – молярная масса газа. В итоге получим:
Произведение постоянной Авогадро NА на постоянную Больцмана k называется универсальной (молярной) газовой постоянной и обозначается буквой R.
Ее численное значение в СИ R = 8,31 Дж/моль·К
называется уравнением состояния идеального газа.
В полученной нами форме оно было впервые записано Д. И. Менделеевым. Поэтому уравнение состояния газа называется уравнением Клапейрона–Менделеева.`
Для одного моля любого газа это соотношение принимает вид: pV=RT
Установим физический смысл молярной газовой постоянной. Предположим, что в некотором цилиндре под поршнем при температуре T находится 1 моль газа, объем которого V. Если нагреть газ изобарно (при постоянном давлении) на 1 К, то поршень поднимется на высоту Δh, а обьем газа увеличится на ΔV.
Запишем уравнение pV=RT для нагретого газа: p (V + ΔV ) = R (T + 1)
и вычтем из этого равенства уравнение pV=RT , соответствующее состоянию газа до нагревания. Получим pΔV = R
ΔV = SΔh, где S – площадь основания цилиндра. Подставим в полученное уравнение:
pS = F – сила давления.
Получим FΔh = R, а произведение силы на перемещение поршня FΔh = А – работа по перемещению поршня, совершаемая этой силой против внешних сил при расширении газа.
Таким образом, R = A.
Универсальная (молярная) газовая постоянная численно равна работе, которую совершает 1 моль газа при изобарном нагревании его на 1 К.
Из уравнения состояния вытекает связь между давлением, объемом и температурой идеального газа, который может находиться в двух любых состояния.
Если индексом 1 обозначить параметры, относящиеся к первому состоянию, а индексом 2 – ко второму состоянию, то согласно уравнению состояния для газа данной массы



Правые части равны, следовательно, равны и левые


Это уравнение называется уравнением Клапейрона
Процессы, при которых один из параметров состояния газа остается постоянным называют изопроцессами.
Газовые законы – это законы, описывающие изопроцессы в идеальном газе.
Газовые законы были открыты экспериментально, но все они могут быть получены из уравнения Менделеева-Клапейрона.
Рассмотрим каждый из них.
Изотермический процесс – процесс перехода идеального газа из одного состояния в другое без изменения температуры.
Закон, описывающий связь между параметрами газа при таком процессе, называется закон Бойля-Мариотта в честь двух учёных, практически одновременно выведших его: англичанина Роберта Бойля и француза Эдма Мариотта (рис. 2). Запишем его:
Получаем: 

Из этого закона, очевидно, следует обратно пропорциональная связь давления и объёма: при увеличении объёма наблюдается уменьшение давления, и наоборот. График зависимости меняющихся величин в уравнении, то есть P и V, имеет следующий вид и называется изотермой:
Разным постоянным температурам соответствуют различные температуры.
Изотермическим процессом приближенно можно считать процесс медленного сжатия воздуха или расширение газа под поршнем насоса при откачке его из сосуда.
Изобарный (или изобарический) процесс – процесс перехода идеального газа из одного состояния в другое при постоянном значении давления.
Впервые такой процесс рассмотрел французский учённый Жозеф-Луи Гей-Люссак, поэтому закон носит его имя.
Получаем: 

Из этого закона очевидно следует прямо пропорциональная связь между температурой и объёмом: при увеличении температуры наблюдается увеличение объёма, и наоборот. График зависимости меняющихся величин в уравнении, то есть T и V, имеет следующий вид и называется изобарой
Следует обратить внимание на то, что работая с абсолютной шкалой температур, на графике присутствует область, близкая к абсолютному нулю температур, в которой данный закон не выполняется. Поэтому прямую в области, близкой к нулю, следует изображать пунктирной линией.
Изохорный (или изохорический) процесс – процесс перехода идеального газа из одного состояния в другое при постоянном значении объёма .
Процесс рассмотрен впервые французом Жаком Шарлем, поэтому закон носит его имя. Запишем закон Шарля:
Получаем: 

Из этого закона очевидно следует прямо пропорциональная связь между температурой и давлением: при увеличении температуры наблюдается увеличение давления, и наоборот. График зависимости меняющихся величин в уравнении, то есть T и P, имеет следующий вид и называется изохорой
В районе абсолютного нуля для графиков изохорного процесса также существует лишь условная зависимость, поэтому прямую также следует доводить до начала координат пунктиром.
Стоит обратить внимание, что именно такая зависимость температуры от давления и объёма при изохорных и изобарных процессах соответственно определяет эффективность и точность измерения температуры с помощью газовых термометров.
Интересен также тот факт, что исторически первыми были открыты именно изопроцессы, которые, как мы показали, являются частными случаями уравнения состояния, а уже потом уравнения Клапейрона и Менделеева-Клапейрона. Хронологически сначала были исследованы процессы, протекающие при постоянной температуре, затем при постоянном объёме а последними – изобарические процессы.
Теперь для сравнения всех изопроцессов мы собрали их в одну таблицу Обратите внимание, что графики изопроцессов в координатах, содержащих неизменяющийся параметр, собственно говоря, и выглядят как зависимость константы от какой-либо переменной.
До какой температуры нужно изобарически охладить некоторую массу газа с начальной температурой 37º C , чтобы объем газа уменьшился при этом на одну четверть?
Изобарный процесс описывается законом Гей-Люссака:
Газ нужно охладить до температуры 233К
В закрытом сосуде находится газ под давлением 200 кПа. Каким станет давление газа, если температуру повысить на 30%?
Так как сосуд с газом закрытый, объем газа не меняется. Изохорный процесс описывается законом Шарля:
Ответ Давление газа станет равным 260 кПа.
Задание 3 Представить этот цикл в координатах ( p , T ) и ( V , T )
* Как будет выглядеть график данного процесса в координатах P-V?
http://www.evkova.org/uravnenie-mkt-idealnogo-gaza
http://infourok.ru/konspekt-po-teme-uravnenie-klapejrona-mendeleeva-5778194.html
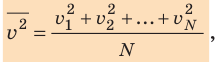
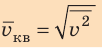
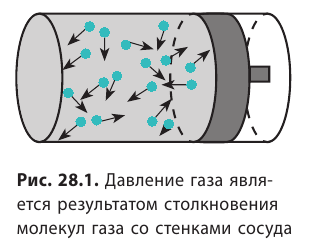
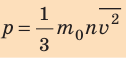
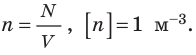
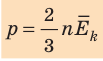
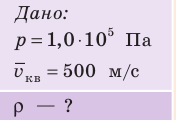


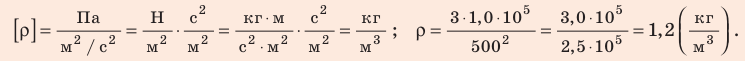
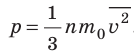 . Это уравнение можно записать в виде:
. Это уравнение можно записать в виде: 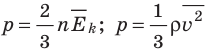 .
.









