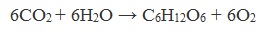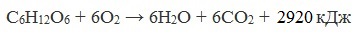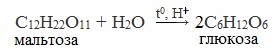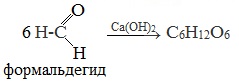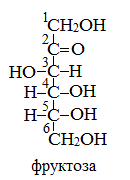Какие свойства глюкозы находят практическое применение уравнение
Глюкоза С6Н12O6 представляет собой наиболее распространенный и наиболее важный моносахарид — гексозу. Она является структурной единицей большинства пищевых ди- и полисахаридов.
Биологическая роль глюкозы
Глюкоза образуется в природе в процессе фотосинтеза, протекающего под действием солнечного света в листьях растений:
Глюкоза – ценное питательное вещество. Она является обязательным компонентом крови и тканей животных и непосредственным источником энергии для клеточных реакций. При окислении ее в тканях освобождается энергия, необходимая для нормальной жизнедеятельности организмов:
Глюкоза – необходимый компонент обмена углеводов. Она необходима для образования в печени гликогена (запасной углевод человека и животных).
Уровень содержания глюкозы в крови человека постоянен. Во всем объеме крови взрослого человека содержится 5-6 г глюкозы. Такого количества достаточно для покрытия энергетических затрат организма в течение 15 минут его жизнедеятельности.
При снижении ее уровня в крови или высокой концентрации и невозможности использования, как это происходит при сахарном диабете, наступает сонливость, может наступить потеря сознания (гипогликемическая кома).
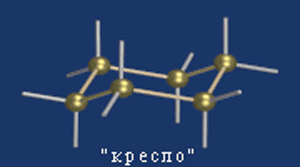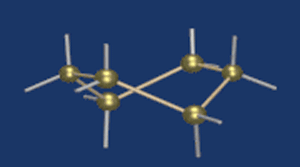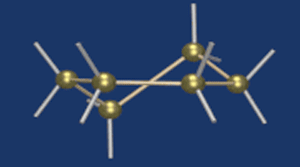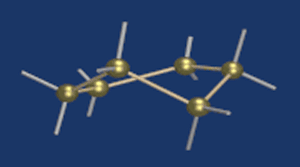
Строение глюкозы. Изомерия
В молекуле глюкозы присутствуют альдегидная и гидроксильная группы.
Видеоопыт «Распознавание глюкозы с помощью качественных реакций»
Моносахаридам свойственна также иная структура, возникающая в результате внутримолекулярной реакции между карбонильной группой с одним из спиртовых гидроксидов. Такая реакция внутри одной молекулы сопровождается ее циклизацией.
Известно, что наиболее устойчивыми являются 5-ти и 6-ти членные циклы. Поэтому, как правило, происходит взаимодействие карбонильной группы с гидроксилом при 4-м или 5-м углеродном атоме.
В результате взаимодействия карбонильной группы с одной из гидроксильных глюкоза может существовать в двух формах: открытой цепной и циклической.
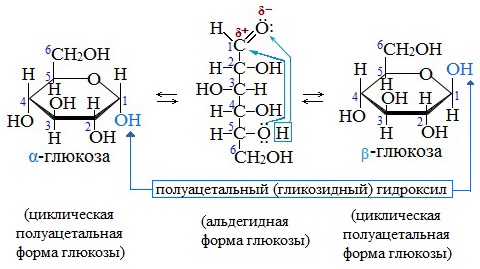
Образование циклической формы глюкозы при взаимодействии альдегидной группы и спиртового гидроксила при С5 приводит к появлению нового гидроксила у С1 называемого полуацетальным (крайний правый). Он отличается от других большей реакционной способностью, а циклическую форму в этом случае называют также полуацетальной.
В кристаллическом состоянии глюкоза находится в циклической форме, а при растворении частично переходит в открытую и устанавливается состояние подвижного равновесия.
Например, в водном растворе глюкозы существуют следующие структуры:
Подвижное равновесие между взаимопревращающимися структурными изомерами (таутомерами) называется таутомерией. Данный случай относится к цикло-цепной таутомерии моносахаридов.
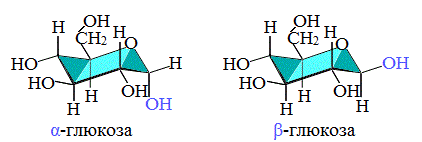
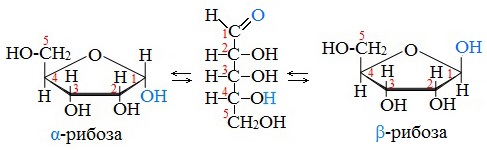
Циклические α- и β-формы глюкозы представляют собой пространственные изомеры, отличающиеся положением полуацетального гидроксила относительно плоскости кольца.
В α-глюкозе этот гидроксил находится в транс-положении к гидроксиметильной группе -СН2ОН, в β-глюкозе – в цис-положении.
С учетом пространственного строения шестичленного цикла
формулы этих изомеров имеют вид:
Видеофильм «Глюкоза и ее изомеры»
Аналогичные процессы происходят и в растворе рибозы:
В твердом состоянии глюкоза имеет циклическое строение.
Обычная кристаллическая глюкоза – это α-форма. В растворе более устойчива β-форма (при установившемся равновесии на неё приходится более 60% молекул).
Доля альдегидной формы в равновесии незначительна. Это объясняет отсутствие взаимодействия с фуксинсернистой кислотой (качественная реакция альдегидов).
Явление существования веществ в нескольких взаимопревращающихся изомерных формах было названо А. М. Бутлеровым динамической изомерией. Позднее это явление было названо таутомерией.
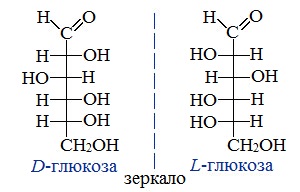
Для глюкозы кроме явления таутомерии характерны структурная изомерия с кетонами (глюкоза и фруктоза – структурные межклассовые изомеры) и оптическая изомерия:
Физические свойства глюкозы
Глюкоза – бесцветное кристаллическое вещество, хорошо растворимое в воде, сладкое на вкус (лат. «глюкос» – сладкий).
Она содержится в растительных и живых организмах, особенно много ее содержится в виноградном соке (отсюда и название – виноградный сахар), в спелых фруктах и ягодах. Мед в основном состоит из смеси глюкозы с фруктозой.
В крови человека ее содержится примерно 0,1 %
Видеоопыт «Определение глюкозы в виноградном соке»
Получение глюкозы
Основным способом получения моносахаридов, имеющим практическое значения, является гидролиз ди- и полисахароидов.
1. Гидролиз полисахаридов
Глюкозу чаще всего получают гидролизом крахмала (промышленный способ получения):
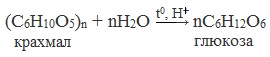
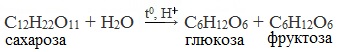
Первый синтез углеводов из формальдегида в щелочной среде осуществил А.М. Бутлеров в 1861 году.
4. Фотосинтез
В природе глюкоза образуется в растениях в результате фотосинтеза:
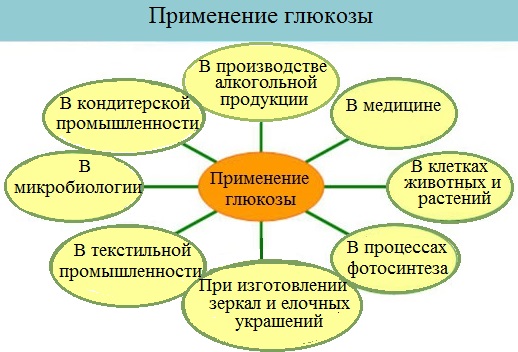
Применение глюкозы
Глюкоза применяется в медицине в качестве укрепляющего лечебного средства при явлениях сердечной слабости, шоке, для приготовления лечебных препаратов, консервирования крови, внутривенного вливания, при самых разнообразных заболеваниях (особенно при истощении организма).
Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников и т. д.)
Глюкоза находит широкое применение в текстильной промышленности при крашении и печатании рисунков.
Глюкоза применяется в качестве исходного продукта при производстве аскорбиновых и глюконовых кислот, для синтеза ряда производных сахаров и т.д.
Она применяется в производстве зеркал и елочных игрушек (серебрение).
В микробиологической промышленности как питательная среда для получения кормовых дрожжей.
Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, так же как и при силосовании кормов. Если подвергаемая силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха происходит маслянокислое брожение и корм становится непригоден к применению.
На практике используется также спиртовое брожение глюкозы, например при производстве пива.
Фруктоза
Фруктоза (фруктовый сахар) С6Н12О6 – изомер глюкозы. Фруктоза в свободном виде содержится в фруктах, меде. Входит в состав сахарозы и полисахарида инсулина. Она слаще глюкозы и сахарозы. Ценный питательный продукт.
В отличие от глюкозы она может без участия инсулина проникать из крови в клетки тканей. По этой причине фруктоза рекомендуется в качестве наиболее безопасного источника углеводов для больных диабетом.
Как и глюкоза, она может существовать в линейной и циклических формах. В линейной форме фруктоза представляет собой кетоноспирт с пятью гидроксильными группами.
Строение ее молекулы можно выразить формулой:
Имея гидроксильные группы, фруктоза, как и глюкоза, способна образовывать сахараты и сложные эфиры. Однако вследствие отсутствия альдегидной группы она в меньшей степени подвержена окислению, чем глюкоза. Фруктоза, также как и глюкоза, не подвергается гидролизу.
Фруктоза вступает во все реакции многоатомных спиртов, но, в отличие от глюкозы, не реагирует с аммиачным раствором оксида серебра.
Какие свойства глюкозы находят практическое применение?
Химия | 10 — 11 классы
Какие свойства глюкозы находят практическое применение?
Иллюстрируйте свой ответ уравнениями соответствующих реакций.
При спиртовом брожении получается соответсвенно спирт
C6H12O6 — — — — > ; 2C2H5OH + 2CO2
для получения сорбита (заместитель сахара).
Его используют в диетических продуктах, в сиропах от кашля.
Потребляют больные диабетом.
C6H12O6 + H2 — — — > ; C6H14O6
молочнокислые продукты получаются путем брожения глюкозы
C6H12O6 — — — — > ; CH3 — CHOH — COOH.
Какое из двух веществ — хлор или йод — обладает большим окислительным свойством?
Какое из двух веществ — хлор или йод — обладает большим окислительным свойством?
Какие опыты можно проделать, чтобы подтвердить ответ?
Напишите уравнения соответствующих реакций.
Какие химические свойства глюкозы подтверждают наличие в ней альдегидных групп?
Какие химические свойства глюкозы подтверждают наличие в ней альдегидных групп?
(Написать уравнения соответствующих реакций).
Где находит применение азот, исходя из его свойств ?
Где находит применение азот, исходя из его свойств ?
Решите пожалуйста, ребят?
Решите пожалуйста, ребят.
Какое из веществ проявляет только восстановительные, только окислительные или и окислительные, и восстановительные свойства : сера, сероводород, оксид серы(IV), серная кислота?
Подтвердите свой ответ уравнениями соответствующих реакций.
Какие химические свойства карбоновых кислот сходны со свойствами неорганических кислот?
Какие химические свойства карбоновых кислот сходны со свойствами неорганических кислот?
Напишите уравнения соответствующих реакций, сравните свойства соляной и уксусной кислоты.
Охарактеризуйте : а)сернистый газ ; б)оксид серы (VI) по плану : получения, свойства, применение?
Охарактеризуйте : а)сернистый газ ; б)оксид серы (VI) по плану : получения, свойства, применение.
Напишите уравнения соответствующих реакций.
Перечислите химические свойства воды?
Перечислите химические свойства воды.
Какие из этих свойств находят практическое применение.
Глюкоза свойства получения и применения?
Глюкоза свойства получения и применения.
Какое химическое свойство присуще сложным эфирам?
Какое химическое свойство присуще сложным эфирам?
Ответ подтвердите уравнением химической реакции.
2) Напишите уравнение реакции, с помощью которых можно осуществить следующие превращения глюкоза — > ; сорбит — > ; углекислый газ — > ; глюкоза — > ; целлюлоза — > ; тринитроцеллюлоза.
Напишите уравнения химических реакций, характеризующие свойства глюкозы как альдегидоспирта?
Напишите уравнения химических реакций, характеризующие свойства глюкозы как альдегидоспирта.
Если вам необходимо получить ответ на вопрос Какие свойства глюкозы находят практическое применение?, относящийся к уровню подготовки учащихся 10 — 11 классов, вы открыли нужную страницу. В категории Химия вы также найдете ответы на похожие вопросы по интересующей теме, с помощью автоматического «умного» поиска. Если после ознакомления со всеми вариантами ответа у вас остались сомнения, или полученная информация не полностью освещает тематику, создайте свой вопрос с помощью кнопки, которая находится вверху страницы, или обсудите вопрос с посетителями этой страницы.
С + 2H2 — > CH4 2CH4 — > CH = — CH + 3H2 ( t = 1500) CH = — CH + H2 — > CH2 = CH2 (t, kat) CH2 = CH2 + H2O — > CH3 — CH2 — OH (kat) C6H6 + HONO2 — > C6H5NO2 + H2O ( t, H2SO4) C6H5NO2 + 3H2 — > C6H5NH2 + 2H2O.
Вот снизу должна быть указа формула на фото.
Mr(CH4) = 12 + 4 * 1 = 16 W(H) = 4 / 16 = 0. 25 = 25% Mr(C2H2) = 2 * 12 + 2 * 1 = 26 W(H) = 2 / 26 = 0. 08 = 8% Mr(C2H4) = 2 * 12 + 4 * 1 = 28 W(H) = 4 / 28 = 0. 14 = 14% Ответ : C2H2, C2H4, CH4.
Решение задачи находится на фото.
Марганец масса 54, 93 а валентность 2 ; 4 ; 7.
Дано : m(Cu) = 6. 4г Найти : V(SO2) — ? Решение : 6. 4г. Xл Cu + 2H2SO4 = SO2 + 2H2O + CuSO4 64г. 22. 4л X = 6. 4г×22. 4л : 64г = 2. 24л Ответ : выделился оксид серы (IV) массой 2. 24л.
Вода – слабый электролит, диссоциирующий на ионы H + и OH — — анионы. Этому процессу соответствует константа диссоциации воды : д * [H2O] = К H2O = [H + ] [OH — ] – ионное произведение воды, К H2O = 1 * 10 — 14 (при 25° С) К H2O – величина постоянна..
1. Литий — Li + 3 Li )2ē )1ē ē = 3, p = 3, n = 4 Находится в I группе, А подгруппе, II периоде. 2. Металл 3. Li Be 5. Высший оксид — Li2O — основный 6. Высший гидроксид — LiOH — щелочь 7. Летучего водородного соединения не образует..
Нет, там за каждый элемент ставится определенное кол — во баллов. На Решу ОГЭ вариант открой, после внизу страницы нажми «сохранить», далее будет написано, как оценивается каждое задание из 2 части.
2. Дано : ω(Е) = 91, 18% Знайти : Е — ? Ω(Н) = 100% — 91, 18% = 8, 82% Загальна формула сполуки ЕН3 Мг(ЕН3) = 3 / 0, 0882 = 34 Аг(Е) = 34 — 3 = 31⇒Р — Фосфор 2. Дано : m(Me(NO3)3 = 42. 6 r m(Me(OH)3 = 15. 6 r Знайти : Ме — ? Формула солі — ? 42..
Презентация по теме «Состав, свойства и применение глюкозы».
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Описание презентации по отдельным слайдам:
Глюкоза. Строение. Физические и химические свойства. цель урока: Установить структуру глюкозы, изучить её физические и химические свойства.
Глюкоза. Физические свойства и её биологическое значение.
Глюкоза — это бесцветное кристаллическое вещество, хорошо растворимое в воде, сладкое на вкус. Она содержится в соке винограда, в спелых фруктах и ягодах, в меде. Строение глюкозы доказано экспериментально. Состав глюкозы выражается формулой С6H12O6.
Биологическое значение глюкозы. Глюкоза образуется в растениях при фотосинтезе. Энергия ,образовавшаяся при окислении глюкозы, используется для обеспечения процессов жизнедеятельности организма Глюкоза — исходное вещество для синтеза многих других необходимых живому организму соединений. Глюкоза – необходимый компонент крови, уровень её содержания находится в пределах 0,08-0,11%
Применение глюкозы. В медицине как средство усиленного питания и как лекарственное вещество. В кондитерском производстве. Входит в состав напитков. В текстильной промышленности при крашении. Используется для изготовления зеркал, ёлочных украшений (серебрение)
Глюкоза в природе
Глюкоза — С6Н12О6 Относится к кислородсодержащим соединениям, углеводам. При помощи химических реакций выясним структурную формулу глюкозы.
Глюкоза реагирует: 1) глюкоза + Сu(OH)2 — образуется синий раствор, который при нагревании приобретает оранжевый цвет. Это доказывает наличие нескольких -ОН групп и альдегидной группы. 2) Одна молекула глюкозы реагирует с 5 молекулами кислоты, это доказывает наличие 5 гидроксо групп. 3) глюкоза + аммиачный раствор оксида серебра – стенки пробирки покрываются серебром, это доказывает наличие альдегидной группы.
В результате проведенных реакций мы можем утверждать, что формула глюкозы –
Реакция «серебряного зеркала» NH4OH CH2OH-(CHOH)4-CHO+Ag2O 2Ag + CH2OH- (CHOH)4- COOH Реакция с гидроксидом меди CH2OH-(CHOH)4-CHO+2Cu(OH)2 2CuOH+H2O+ CH2OH- (CHOH)4- COOH 2CuOH=Cu2O+ H2O Реакция с водородом CH2OH-(CHOH)4-CHO+H2 CH2OH-(CHOH)4 — CH2OH сорбит
Специфические свойства глюкозы
Краткое описание документа:
Презентация на тему «Глюкоза. Строение. Физические и химические свойства». Цель урока: Установить структуру глюкозы, изучить её физические и химические свойства. Глюкоза — это бесцветное кристаллическое вещество, хорошо растворимое в воде, сладкое на вкус. Она содержится в соке винограда, в спелых фруктах и ягодах, в меде. Строение глюкозы доказано экспериментально. Состав глюкозы выражается формулой С6H12O6. Биологическая роль глюкозы. Глюкоза образуется в растениях при фотосинтезе. Энергия, образовавшаяся при окислении глюкозы, используется для обеспечения процессов жизнедеятельности организма. Глюкоза — исходное вещество для синтеза многих других необходимых живому организму соединений. Глюкоза – необходимый компонент крови, уровень её содержания находится в пределах 0,08-0,11%. Применение глюкозы. В медицине как средство усиленного питания и как лекарственное вещество. В кондитерском производстве. Входит в состав напитков. В текстильной промышленности при крашении. Используется для изготовления зеркал.
http://himia.my-dict.ru/q/743579_kakie-svojstva-glukozy-nahodat-prakticeskoe-primenenie/
http://infourok.ru/material.html?mid=101400