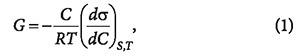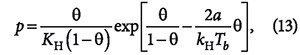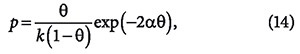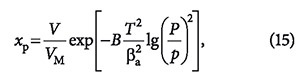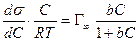О процессе адсорбции на твердых адсорбентах
Адсорбцию применяют при очистке воды от органических и хлорорганических соединений, нефтепродуктов, аммиака и поверхностно-активных веществ при низких концентрациях загрязнений на стадии глубокой очистки. В статье рассмотрены основные математические модели адсорбции на твердых адсорбентах. Изучены теоретические аспекты процесса адсорбции из воды органических веществ на твердых адсорбентах. Приведен расчет аппаратов для проведения адсорбции, а также даны их основные технические характеристики.
Адсорбцией называется поглощение загрязнений поверхностью твердого адсорбента, осуществляемое за счет взаимодействия молекул загрязнителей с поверхностью адсорбента и последующей диффузии молекул веществ через пленку, окружающую частицы адсорбента, к его поверхности, скорость которой определяется строением адсорбента, наличием пор и размером молекул сорбируемого вещества. Лучшими сорбентами для удаления из воды растворенных органических веществ признаны активированные угли различных марок, получаемые в результате пиролиза твердых древесных и каменноугольных материалов, эффективность которых определяется наличием в них микропор, а также цеолиты, представляющие собой алюмосиликаты натрия, калия или других элементов.
Адсорбция — процесс увеличение концентрации растворенного вещества у поверхности раздела двух фаз («твердая фаза-жидкость», «конденсированная фаза-газ») вследствие некомпенсированных сил межмолекулярного взаимодействия на границе разделе фаз. Процесс, обратный адсорбции, называется десорбцией.
Адсорбция является частным случаем сорбции — поглощения загрязнений поверхностью твердого тела, которая происходит за счет диффузии молекул органических веществ через жидкостную пленку, окружающую частицы сорбента, к его поверхности и далее внутренней диффузии молекул, скорость которой определяется строением сорбента, наличием в нем пор и размером молекул сорбируемого вещества [1].
Причина адсорбции—нескомпенсированные специфические межмолекулярные силы и ван-дер-ваальсовые взаимодействия вблизи поверхности, что свидетельствует о наличии адсорбционного силового поля. Твердое вещество, создающее такое поле, называется адсорбентом, вещество, молекулы которого адсорбируются — адсорбтивом, а адсорбированное вещество — адсорбатом. Если в состав адсорбента входят ионы или поверхностные функциональные группы, способные к ионизации, то между адсорбентом и водным раствором электролита происходит ионный обмен. Адсорбент в данном случае обозначается «ионитом».
Адсорбция на границе «твердое теложидкость» сложна из-за физической неоднородности поверхности твердых тел, наличия дефектов поверхности — трещин, дислокаций, выходом разных граней кристалла на поверхность и др.
Адсорбция сопровождается уменьшением давления пара поглощаемого вещества в исходной смеси и выделением теплоты. Поэтому в соответствии с принципом Ле-Шателье количество адсорбированного вещества возрастает с понижением температуры и повышением давления
На эффективность протекания адсорбционных процессов оказывают влияние химическая природа и пористая структура адсорбента, состав и концентрация функциональных групп на его поверхности, химическая природа адсорбата, условия организации взаимодействия в системе «адсорбент-адсорбат», которое может протекать как в статических, так и динамических режимах. Последнее в значительной степени определяет аппаратурное оформление адсорбционных процессов.
Различают физическую и химическую адсорбцию (хемосорбцию). При физической адсорбции молекулы адсорбента и адсорбтива не вступают в химическое взаимодействие, между ними формируются межмолекулярные электростатические силы («ван-дер-ваальсовые взаимодействия») — между ионами, диполями или квадруполями; при этом адсорбция определяется химической природой молекул адсорбтива (специфическая адсорбция) [2]. Значительную роль при адсорбции играет также геометрия поверхности раздела фаз: в случае плоской поверхности происходит адсорбция на открытой поверхности, в случае слабо или сильно искривленной поверхности — адсорбция в порах адсорбента. При хемосорбции происходит химическое взаимодействие молекул поглощаемого вещества с адсорбентом, когда формируются химические валентные связи.
Физическая адсорбция обратима, а хемосорбция может быть необратимой. Отличительные признаки хемосорбции — необратимость процесса, высокие тепловые эффекты (сотни кДж/моль) и активированный характер, закономерности химических реакций (осуществляется со значительной энергией активации), экзотермический или эндотермический эффект реакции, с повышением температуры ее скорость возрастает по закону Аррениуса и др. [3].
Физическая адсорбция — это процесс экзотермический, то есть протекает с выделением тепла. Между физической и химической адсорбцией существует множество промежуточных состояний (адсорбция, о бусловленная о браз ованием водородных связей). Возможны различные типы физической адсорбции и проявление дисперсионных межмолекулярных сил притяжения, поскольку они приблизительно постоянны для адсорбентов с поверхностью любой химической природы («неспецифическая адсорбция»).
Адсорбция сопровождается уменьшением давления пара поглощаемого вещества в исходной смеси и выделением теплоты. Поэтому в соответствии с принципом Ле-Шателье количество адсорбированного вещества возрастает с понижением температуры и повышением давления [4]. Понижение давления и повышение температуры способствуют обратному процессу — десорбции. Количество выделяющейся при адсорбции теплоты [кДж/кмоль] определяется экспериментально.
Количественно адсорбция может быть охарактеризована с помощью нескольких величин:
- Величиной α, представляющую собой количество адсорбтива в объеме адсорбционного слоя на единицу массы адсорбента, или количество адсорбтива на единицу поверхности адсорбента. Единицы измерения — моль/г, моль/м 2 .
- Введенной Гибсом величиной Г, представляющей собою избыток числа молей адсорбтива в объеме поверхностного слоя площадью 1 см 2 по сравнению с числом его молей в том же объеме, если бы у межфазной границы не происходило изменение концентрации адсорбтива. При малых концентрациях адсорбтива гибсовская адсорбция Г близка к поверхностной концентрации α, при больших концентрациях адсорбтива величина Г отличается от α.
В случаях же, когда концентрация адсорбтива в поверхностном слое меньше его концентрации в остальном объеме, величина Г является отрицательной величиной, а само подобное явление обозначается так называемой «отрицательной адсорбцией».
Уравнение изотермы адсорбции Гиббса позволяет определять адсорбцию Г (концентрацию адсорбированного вещества, моль/м 2 ) на границе раздела «жидкость-газ» по зависимости σ(С) при Т = const и S = const:
где σ — поверхностное натяжение; C — объемная концентрация адсорбтива; S — величина поверхности границы раздела фаз; T — температура.
Для каждого растворителя существуют вещества, которые снижают поверхностное натяжение: dσ/dC 0. Граница раздела фаз обогащается растворенным веществом, и такие вещества называются поверхностно-активными. Вещества, для которых dσ/dC > 0 и Г 2 .
Зависимости, описываемые уравнениями (7) и (8), называются изотермами адсорбции и используются в теоретических расчетах. В основу их построения положена модель Ленгмюра: поверхность адсорбента представляет собой набор энергетически одинаковых активных центров, на которых адсорбируются (локализуются) молекулы адсорбтива; на одном центре адсорбируется только одна молекула, то есть при адсорбции образуется только один адсорбционный слой (монослой); адсорбция на данном центре не влияет на адсорбцию на других центрах, то есть взаимодействием адсорбированных молекул можно пренебречь.
На основании химической термодинамики получены конкретные выражения изотерм адсорбции, называемые изотермами Ленгмюра-Фрейндлиха:
где xp — концентрация поглощенного адсорбентом вещества (емкость адсорбента), кг на 1 кг адсорбента; a — предельная концентрация поглощенного компонента в адсорбенте, достигаемая при p/ps = 1 (ps — давление насыщенного пара при заданной температуре); b — адсорбционный коэффициент, обратный константе равновесия Кр -1 ; k и n — эмпирические константы и показатель степени, зависящие от природы адсорбента, адсорбируемого вещества и температуры, определяемые опытным путем; р — равновесное давление адсорбента в парогазовой смеси, Н/м 2 .
Зависимости (7) и (8), называются изотермами адсорбции и используются в теоретических расчетах. В основе их построения — модель Ленгмюра: поверхность адсорбента представляет собой набор энергетически одинаковых активных центров, на которых адсорбируются молекулы адсорбтива
Константа равновесия определяется следующим уравнением:
Равновесное давление адсорбента пропорционально р, а концентрация свободных активных центров — величине (ат — а), где ат — полное число активных центров, а — число занятых активных центров. В области очень малых давлений bр = 1 и а = (amb) p, что отвечает уравнению Генри, в котором Кн = атb (ат — поверхностная концентрация адсорбтива при заполнении им всех активных центров). В области очень больших давлений (bр ≥ 1 и а ≈ ат) адсорбция перестает зависеть от давления. При очень малых заполнениях поверхности адсорбента уравнение изотермы адсорбции приобретает вид уравнения Генри:
где Кн — коэффициент Генри.
Вид изотерм адсорбции зависит от множества следующих факторов: удельной площади поверхности адсорбента, объема пор, структуры адсорбента, поглощаемого вещества и его свойств, а также от температуры.
На рис. 1 показаны пять основных типов изотерм адсорбции. Тип 1 характерен для микропористых адсорбентов. Начальные выпуклые участки изотерм типов 2 и 4 определяются наличием микропор. Дальнейшую форму изотерм определяют полимолекулярная адсорбция и капиллярная конденсация.
Вогнутые участки на изотермах 3 и 5 характерны для систем «адсорбент-адсорбтив», когда силы взаимодействия молекул адсорбтива с адсорбентом меньше сил межмолекулярного взаимодействия между молекулами адсорбтива.
Существуют различные математические модели адсорбции — мономолекулярная адсорбция, полимолекулярная адсорбция, капиллярная конденсация, каждая из которых описывает экспериментальные данные, полученные в определенных условиях.
В теорию полимолекулярной адсорбции, которая постулирует, что при температуре ниже критической каждая молекула, адсорбированная в первом слое, является центром для молекул, образующих второй слой, и т.д. Большой вклад внес Я. де Бур [5], экспериментально показавший, что зависимость среднего числа слоев на всех поверхностях, близких по химической природе, от p/ps выражается универсальной кривой (так называемой «t-кривой»). Это позволяет оценивать площади поверхности адсорбтивов.
Предпринимались попытки учесть в модели Ленгмюра также взаимодействия между адсорбированными молекулами. Так, Т. Хилл и Я. де Бур, предположив, что уравнение состояния адсорбционного слоя является двухмерным аналогом уравнения Ван-дер-Ваальса, получили уравнение изотермы адсорбции:
где θ = а/ат (а и b — константы уравнения Ван-дер-Ваальса). В свою очередь, Фаулер и Э. Гуггенгейм, учитывая взаимодействие адсорбированных молекул, вывели уравнение:
где α — константа, связанная с парным взаимодействием молекул.
Принципиально отличную модель адсорбции (потенциальная адсорбция), предложил М. Поляни [6]. Согласно этой модели, вблизи поверхности адсорбента формируется потенциальное адсорбционное силовое поле, убывающее с расстоянием от поверхности. Вследствие этого давление адсорбтива, равное p вдали от поверхности, вблизи нее возрастает и на некотором расстоянии достигает значения ps, при котором адсорбтив конденсируется.
Объем слоя между поверхностью раздела и геометрическим местом точек, в которых р = ps, заполнен жидкостью, которая характеризуется нормальными значениями физических свойств объемной жидкости.
Обратимая изотермическая работа адсорбционных сил выражается уравнением ε = RT ln(p/ps), и обозначается адсорбционным потенциалом. При заданной величине объема V адсорбционного слоя потенциал е не зависит от температуры (вследствие независимости дисперсионных сил от температуры). Такая температурная инвариантность дает возможность пересчитывать адсорбцию с одной температуры на другую, хотя уравнения изотермы адсорбции на основе излагаемой теории получить не удалось.
Принято различать молекулярную, кнудсеновскую и поверхностную диффузии. Молекулярная диффузия осуществляется, если длина свободного пробега молекул в порах адсорбента меньше размера пор, кнудсеновская — если эта длина превышает размер пор
Советским физико-химиком М.М. Дубининым [7] разработана теория объемного заполнения пор (ТОЗП) и получены уравнения адсорбции для газов и паров для широкого диапазона температур, характеризующие зависимость равновесной концентрации адсорбтива от структуры пор адсорбента. Эти уравнения имеют сложный характер и применимы только к микропористым сорбентам с размерами пор ≤ 1 нм:
где V — суммарный объем пор адсорбента; VM — объем адсорбированного вещества в жидком состоянии; В — константа, определяемая структурой адсорбента; Т — абсолютная температура пара; βа — коэффициент аффинности, равный отношению мольных объемов в жидком состоянии в порах данного вещества и стандартного; Р — давление насыщаемого пара адсорбтива; р — парциальное давление пара адсорбтива при температуре адсорбции.
Кроме вышеописанных, существует еще один механизм, приводящий к дополнительной адсорбции адсорбтивов ниже их критической температуры на пористых адсорбентах, — капиллярная конденсация [8]. Этот тип адсорбции обусловлен наличием у адсорбента мелких пор. Пары адсорбата в данном случае конденсируются в таких порах при давлениях, меньших давления насыщенного пара ps над плоской поверхностью, вследствие образования в капиллярах вогнутых менисков.
АДСО́РБЦИЯ
В книжной версии
Том 1. Москва, 2005, стр. 246-248
Скопировать библиографическую ссылку:
АДСО́РБЦИЯ (от лат. ad – на и sorbeo – поглощать), поглощение вещества из газовой фазы или жидкого раствора поверхностным слоем твёрдого тела или жидкости. Явление А. вызывается наличием адсорбц. cилового поля, создаваемого за счёт нескомпенсированности межмолекулярных cил в поверхностном слое. Вещество, создающее такое поле, называется адсорбентом, вещество, молекулы которого могут адсорбироваться, – адсорбтивом, уже адсорбиров. вещество – адсорбатом. Процесс, обратный А., – десорбция. А. – частный случай сорбции . Применение адсорбц. процессов датируется кон. 18 в., когда независимо и практически одновременно появились три публикации: итал. натуралист Ф. Фонтана и К. Шееле в 1777 описали поглощение газов древесным углем, в 1785 Т. Е. Ловиц обнаружил способность таких углей обесцвечивать растворы винных кислот, поглощая органич. примеси.
Лекция 13. Адсорбция
13.1. Уравнение адсорбции Гиббса
Строгое определение понятия адсорбции по Дж. Гиббсу: адсорбцией данного компонента на границе раздела двух фаз называется разность между фактическим количеством этого компонента в системе и тем его количеством, которое было бы в системе, если бы концентрации в обеих сосуществующих фазах были постоянны вплоть до некоторой геометрической поверхности, разделяющей их.
Эта разность может быть положительной или отрицательной. Она обозначается символом G (гамма) и имеет размерность моль/м 2 . Эту величину называют избыточной адсорбцией по Дж. Гиббсу.
Хотя в приведенном определении адсорбция отнесена к геометрической поверхности, не имеющей толщины (что удобно при выводе уравнений), фактически граница между фазами представляет собой очень тонкий слой (поверхностный слой), в котором все свойства отличаются от свойств объемных фаз и изменяются не скачкообразно, а непрерывно.
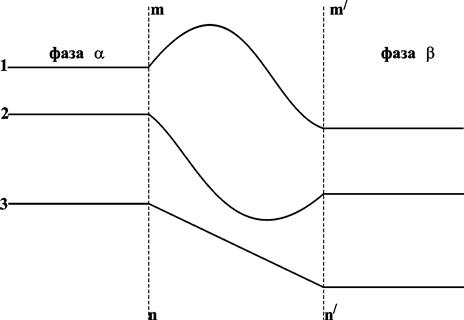
На рис. 13.1 показано возможное изменение концентрации вблизи границы раздела: концентрация компонента может быть как выше концентраций в обеих фазах (1), так и ниже (2) или иметь промежуточное значение. Эта область может рассматриваться как поверхностный слой. Таким образом, изучая границу раздела фаз, нужно рассматривать состояние трех фаз: двух объемных и одной поверхностной.
Рис. 13.1. Изменение концентрации компонентов у границы раздела фаз;
поверхностный слой – mn-m’n’
Уравнение, устанавливающее связь между всеми параметрами процесса адсорбции – величиной поверхностного натяжения s, концентрацией компонента [C] в одной из фаз, его адсорбцией Г, было выведено Дж. Гиббсом в 1876 г. Это уравнение является общим термодинамическим уравнением, справедливым для любых составов и природы поверхности раздела фаз.
Рассмотрим систему, состоящую из двух компонентов 1 и 2 и двух фаз a и b, разделенных поверхностью раздела с площадью S. Общее число молей каждого компонента в системе равно n1 o и n2 o . Если считать, что поверхностный слой не имеет толщины, т.е. представляет собой геометрическую поверхность, то обе объемные фазы будут иметь постоянный состав вплоть до этой геометрической поверхности. Обозначим число молей каждого компонента в каждой из этих фаз соответственно через n1 a ,n1 b ; n2 a ,n2 b . Так как на поверхности имеет место адсорбция, то, очевидно, n1 o ¹ n1 a + n1 b и n2 o ¹ n2 a + n2 b .
По вышеприведенному определению адсорбция каждого компонента Г1 и Г2 , отнесенная к единице площади поверхности, равна
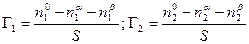
Чтобы найти Г1 и Г2, напишем уравнение энергии Гиббса для двух фаз a и b в отдельности и для всей системы в целом. В последнем случае, очевидно, нужно включить в уравнение член sdS:
dG o = — S o dT + V o dP + sdS + m1dn1 o + m2dn2 o . (13.2)
Укажем на уравнение Гиббса-Дюгема, которое устанавливает связь между химическими потенциалами:
dG = — S dT + VdP + Smidn1 (P, T – постоянные). (13.3)
Тогда для бинарной системы получим
Интегрируя это уравнение при постоянных значениях m1 и m2, получим
Из (13.4) и (13.6) вытекает, что
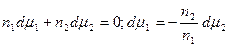
Это уравнение носит название уравнения Гиббса-Дюгема и связывает изменение химических потенциалов компонентов. Тогда с учетом уравнения Гиббса-Дюгема и поверхностных явлений получаем:
Сложение двух первых уравнений и вычитание полученной суммы из третьего дает
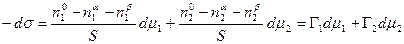
В качестве примера рассмотрим две конкретные системы: двухкомпонентный жидкий раствор, находящийся в равновесии со своим двухкомпонентным насыщенным паром, и твердое тело, находящееся в равновесии с однокомпонентным газом, совершенно не растворимым в этом твердом теле.
Поскольку в первом случае точное положение разделяющей геометрической поверхности несколько условно, то можно выбрать положение ее, при котором
Во втором случае вследствие нерастворимости газа в объеме твердого тела, объемные свойства этого тела, в частности его химический потенциал, не изменяются при адсорбции. Приписывая твердому телу индекс 1, имеем:
В обоих случаях получено одно и то же уравнение. Поэтому можно считать, что адсорбционное уравнение Гиббса имеет вид:
Оно является основным в учении о поверхностных явлениях.
Рассмотрим далее реальный раствор. Для реального раствора
где а – активность, тогда:
Подставив это значение в уравнение (13.12), получим:
ds = — Г Rt d lna,
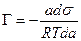
В разбавленных растворах а » С (где С – концентрация)
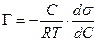
а для идеального или разреженного идеального газа
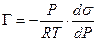
Уравнение (13.14) показывает, что если при адсорбции поверхностное натяжение s уменьшается с ростом концентрации С, т.е. ds/dC 0 и Г – отрицательно. Это соответствует поверхностно-инактивным веществам. Если известна зависимость s от С (т.е. изотерма поверхностного натяжения s = f(C) , то по уравнению Гиббса можно для каждого значения концентрации найти ds/dC и по уравнению Гиббса вычислить значение Г, т.е. построить изотерму адсорбции.
13.2. Обзор сорбционных явлений
Адсорбция на границе раздела твердое тело/газ. В общем случае явления, связанные с перераспределением веществ между различными частями гетерогенной системы, называются сорбцией. Сорбция (от лат. sorbeo – сгущать) – это изменение концентрации (часто увеличение) либо у поверхности раздела фаз (адсорбция), либо в объеме одной из фаз (абсорбция). Например, образование раствора за счет поглощения НСl (газа) и поглощение газа металлом (абсорбция). Поверхностная сорбция – адсорбция.
Твердое тело, у поверхности которого происходит адсорбция, называется адсорбентом, адсорбирующийся газ или адсорбирующийся компонент жидкого раствора – адсорбтивом, а адсорбированое вещество – адсорбат.
В строгом определении адсорбции она рассматривается как избыток вещества вблизи поверхности по сравнению с равным объемом вдали от нее. В ряде случаев удобнее рассматривать не избыток, а все количество адсорбата вблизи поверхности. Это количество обозначают символом а и называют полным содержанием, или просто адсорбцией (без указания гиббсова). Так как для пористых твердых тел бывает затруднительно знать величину поверхности, то часто адсорбцию относят не к единице поверхности, а к единице массы (моль/кг или моль/г).
Адсорбция самопроизвольна и протекает при Р = const со снижением энергии Гиббса, а при V = const – со снижением энергии Гельмгольца. Однако при этом происходит не выравнивание концентраций по всему объему системы, а увеличение разности концентраций между газовой фазой (раствором) и поверхностью. Одновременно уменьшается подвижность сорбирующихся молекул. Оба фактора ведут к уменьшению энтропии (DS o , так как DG o = DH o + TDS o ,
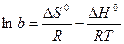
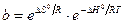
Таким образом, адсорбционный коэффициент b связан со стантартной энтропией DS° и со стандартной теплотой адсорбции q = –DH°.
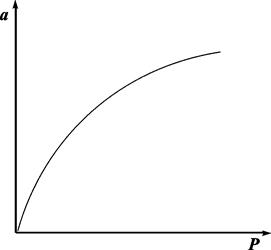
Очень часто аm называют «емкость монослоя». На рис.13.3 показана кривая, выражающая изотерму адсорбции по Ленгмюру
Рис. 13.3. Изотерма адсорбции по Ленгмюру
При очень малых заполнениях и, следовательно, очень малых давлениях Р в знаменателе, согласно (13.25), bр > 1 и а = аm, т.е. величина адсорбции перестает зависеть от давления, поскольку все центры уже заняты.
Для расчета параметров am и b уравнение Ленгмюра представляют в виде
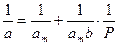
Тангенс угла наклона этой линии равен 1/amb, а отрезок, отсекаемый на оси ординат, равен 1/am.
Уравнение Ленгмюра, полученное на основании модели локализованной адсорбции газов на поверхности твердого тела, часто хорошо описывает адсорбцию растворенных веществ на поверхности жидкости (поверхность раздела раствор/газ), при которой адсорбция не локализована, так как молекулы подвижны и образуют двумерную газо- или жидкообразную пленку.
Обусловлено это тем, что основные положения модели Ленгмюра соблюдаются при адсорбции из растворов: поверхность жидкости идеально однородна, взаимодействие адсорбированных молекул в адсорбционном слое мало отличается от их взаимодействия в растворе. Оно к тому же ослаблено за счет взаимодействия молекул растворенного вещества с молекулами растворителя и практически не влияет на адсорбцию.
Уравнение Ленгмюра связано с уравнением состояния адсорбционной пленки – уравнением Гиббса. Так,
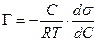
а по уравнению Ленгмюра
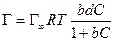
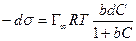
После интегрирования в пределах от sо до s и от 0 до С получим:
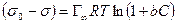
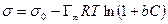
где Г¥ связано с площадью, занимаемой 1 моль адсорбированного вещества в мономолекулярном слое, следующим соотношением: 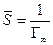
Дата добавления: 2016-02-09 ; просмотров: 2885 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://bigenc.ru/chemistry/text/1801545
http://helpiks.org/6-84315.html