Коллигативные свойства растворов
Любому раствору характерны те или иные физические свойства, к которым относятся и коллигативные свойства растворов. Это такие свойства, на которые не оказывает влияние природа растворенного вещества, а зависят они исключительно от количества частиц этого растворенного вещества.
К коллигативным свойствам растворов относятся:
- Понижение давление паров
- Повышение температуры кипения
- Понижение температуры затвердевания (кристаллизации)
- Осмотическое давление раствора.
Рассмотрим подробнее каждое из перечисленных свойств.
Понижение давления паров
Давление насыщенного пара (т.е. пара, который пребывает в состоянии равновесия с жидкостью) над чистым растворителем называется давлением или упругостью насыщенного пара чистого растворителя.
Если в некотором растворителе растворить нелетучее вещество, то равновесное давление паров растворителя при этом понижается, т.к. присутствие какого – либо вещества, растворенного в этом растворителе, затрудняет переход частиц растворителя в паровую фазу.
Экспериментально доказано, что такое понижение давления паров напрямую зависит от количества растворенного вещества. В 1887 г. Ф.М. Рауль описал количественные закономерности коллигативных свойств растворов.
Первый закон Рауля
Первый закон Рауля заключается в следующем:
Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе:
p — давление пара над раствором, Па;
p0 — давление пара над чистым растворителем, Па;
χр-ль — мольная доля растворителя.
nв-ва и nр-ля – соответственно количество растворенного вещества и растворителя, моль.
Иногда Первому закону Рауля дают другую формулировку:
относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества:
При этом принимаем, что χв-ва + χр-ль= 1
Изотонический коэффициент Вант-Гоффа
Для растворов электролитов данное уравнение приобретает несколько иной вид, в его состав входит изотонический коэффициент i:
Δp — изменение давления паров раствора по сравнению с чистым растворителем;
i – изотонический коэффициент.
Изотонический коэффициент (или фактор Вант-Гоффа) — это параметр, не имеющий размерности, который характеризует поведение какого – либо вещества в растворе.
То есть, изотонический коэффициент показывает, разницу содержания частиц в растворе электролита по сравнению с раствором неэлектролита такой же концентрации. Он тесно связан связан с процессом диссоциации, точнее, со степенью диссоциации и выражается следующим выражением:
n – количество ионов, на которые диссоциирует вещество.
α – степень диссоциации.
Повышение температуры кипения или понижение температуры затвердевания (кристаллизации). Второй закон Рауля
Равновесное давление паров жидкости имеет тенденцию к увеличению с ростом температуры, жидкость начинает кипеть, при уравнивании давления ее паров и внешнего давления.
При наличии нелетучего вещества, давление паров раствора снижается, и раствор будет закипать при более высокой температуре, по сравнению с температурой кипения чистого растворителя.
Температура замерзания жидкости также определяется той температурой, при которой давления паров жидкой и твердой фаз уравниваются.
Ф.М. Рауль доказал, что повышение температуры кипения, так же как и понижение температуры замерзания разбавленных растворов нелетучих веществ, прямо пропорционально моляльной концентрации раствора и не зависит от природы растворённого вещества. Это правило известно как Второй закон Рауля:
K — криоскопическая константа,
mв-ва — моляльность вещества в растворе.
Растворы электролитов не подчиняются Законам Рауля. Но для учёта всех несоответствий Вант-Гофф предложил ввести в приведённые уравнения поправку в виде изотонического коэффициента i, учитывающего процесс распада на ионы молекул растворённого вещества:
Осмотическое давление раствора
Некоторые материалы имеют способность к полупроницаемости, т.е. им свойственно пропускать частицы определенного вида и не пропускать частицы другого вида.
Перемещение молекул растворителя (но не растворенного, в нем вещества), через полупроницаемую мембрану в раствор с большей концентрацией из более разбавленного представляет собой такое явление как осмос.
Представим два таких раствора, которые разделены полупроницаемой мембраной, как показано на рисунке выше. Растворы стремятся к выравниванию концентраций, поэтому вода будет проникать в раствор, тем самым уменьшая его концентрацию.
Для того, чтобы осмос приостановить, необходимо приложить внешнее давление к раствору. Такое давление, которое требуется приложить, называется осмотическим давлением.
Осмотическое давление и концентрацию раствора неэлектролита позволяет связать уравнение Вант — Гоффа, которое напоминает уравнение идеального газа Клапейрона – Менделеева:
где C — молярная концентрация раствора, моль/м 3 ,
R — универсальная газовая постоянная (8,314 Дж/моль·К);
T — абсолютная температура раствора.
Преобразуем уравнение следующим образом:
C = n/V = m/(M·V)
π = т·R·T / M·V или
Для растворов электролитов осмотическое давление определяется уравнением, в которое входит изотонический коэффициент:
где i — изотонический коэффициент раствора.
Для растворов электролитов i > 1, а для растворов неэлектролитов i = 1.
Если полупроницаемой перегородкой разделены два раствора, имеющие одинаковое осмотическое давление, то перемещение растворителя через перегородку отсутствует. Такие растворы называются изотоническими.
Раствор, с меньшим осмотическим давлением, по сравнению с более концентрированным раствором, называют гипотоническим, а раствор с большей концентрацией – гипертоническим.
2.3.3. Осмотическое давление
В истинных растворах, отделенных от растворителя полупроницаемой перегородкой, может быть измерено осмотическое давление, величина которого зависит от концентрации растворенного вещества и для разбавленных растворов описывается уравнением Вант Гоффа
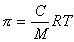
где С – массовая концентрация, кг/м 3 .
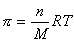
где n – частичная концентрация частиц/м 3 .
Грэм пытался определить осмотическое давление коллоидных растворов и пришел к ошибочному выводу, что коллоидные системы этим свойством не обладают. Как известно, именно на этом ошибочном факте Грэм провел разделение на истинные растворы и коллоидные системы.
Однако тот факт, что частицы в коллоидном состоянии также совершают хаотическое движение, не оставляет сомнений в том, что осмотическое давление должно быть и у коллоидных систем.
Из уравнения (2.2.97) следует, что осмотическое давление пропорционально частичной концентрации. Число частиц в коллоидной системе очень мало по сравнению с истинным раствором, поэтому осмотическое давление золей тоже очень мало. Например,1%-ный золь золота с частичками r» 10 — 9 м имеет осмотическое давление p = 3,45 Па. Чтобы этот золь имел такое же осмотическое давление, как 1М-раствор электролита, понадобилось бы в 1 дм 3 диспергировать 50 кг золота с частичками r = 10 — 9 м.
Очевидно, что при малом осмотическом давлении золя даже малейшая примесь электролита будет оказывать колоссальное влияние на осмотическое давление, поэтому при изучении осмоса в золях их требуется тщательно очищать.
Смолуховский показал, что при изменении степени дисперсности коллоида осмотическое давление обратно пропорционально r 3 частиц, т.е.
Пфеффер первый определил «молекулярную массу» частиц в золе и показал, что она необычайно велика:
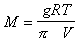
где g – навеска вещества; V – объем раствора.
Рис. 2.15. Схема конуса Тиндаля:
1- лампа, 2- конденсор, 3 — линза, 4- золь, 5 — луч света
Осмотическое давление раствора высокомолекулярного вещества также отличается от осмотического давления раствора низкомолекулярного вещества. В области разбавленных растворов осмотическое давление у растворенных полимеров будет больше, чем у золей.
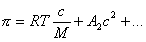
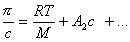
По углу наклона зависимости, описываемой выше определяется интенсивность взаимодействия макромолекул с растворителем, характеризуемая величиной А2. При одной и той же массовой концентрации в растворах полимеров большие молекулы присутствуют в меньшем количестве, чем число молекул низкомолекулярных веществ, поэтому осмотическое давление в таких растворах будет ниже, чем в растворах низкомолекулярных веществ.
Каким уравнением выражается осмотическое давление электролитов
Осмотическое давление раствора прямо пропорционально концентрации растворенных в нем частиц. Это справедливо для растворенных веществ как с большим, так и малым размером молекул. Например, одна молекула альбумина с молекулярной массой 70000 создает такой же осмотический эффект, как одна молекула глюкозы, молекулярная масса которой равна 180. Одна молекула NaCl, однако, обладает двумя осмотически активными частицами: ионами Na+ и Cl-, осмотический эффект которых (по сравнению с альбумином или глюкозой) в 2 раза выше, поэтому осмотическое давление раствора пропорционально его осмолярности — мере концентрации растворенных частиц.
В соответствии с правилом Вант-Гоффа осмотическое давление (π) можно рассчитать по формуле: π = CRT, где С — концентрация растворенного вещества в осмолях на литр, R — универсальная газовая постоянная и Т — температура в градусах по Кельвину (273° + температура по Цельсию). Если π выражается в общепринятых для биологических жидкостей единицах — миллиметрах ртутного столба, Т соответствует нормальной температуре тела (273° + 37° = 310° по Кельвину), рассчитанное значение π для раствора 1 осм/л составит 19300 мм рт. ст. Это значит, что для концентрации 1 мосм/л π равно 19,3 мм рт. ст. Таким образом, каждый миллиосмоль трансмембранного градиента концентрации создает осмотическое давление 19,3 мм рт. ст.
а) Расчет осмолярности и осмотического давления раствора. Предполагая, что мембрана непроницаема для растворенного вещества, можно рассчитать возможное осмотическое давление раствора, используя правило Вант-Гоффа. Например, осмотическое давление 0,9% раствора NaCl рассчитывают следующим образом: 0,9% означает, что 100 мл раствора содержит 0,9 г NaCl, или 9 г/л. Поскольку молекулярная масса NaCl составляет 58,5 г/моль, молярность раствора составит: 9 г/л разделить на 58,5 г/моль, или 0,154 моль/л. Поскольку каждая молекула NaCl эквивалентна 2 осмолям, осмолярность раствора составит: 0,154×2, или 308 мосм/л. Следовательно, осмолярность раствора равна 308 мосм/л. Возможное осмотическое давление раствора составит: 308 мосм/л х 19,3 мм рт. ст., или 5944 мм рт. ст.
Данный расчет является приблизительным, поскольку в растворе вследствие сил межионного взаимодействия между ионами Na+ и Сl- нет полной независимости. Теоретически рассчитанное с помощью правила Вант-Гоффа значение следует скорректировать с учетом поправки, носящей название осмотического коэффициента. Для NaCl он равен 0,93. Следовательно, реальное значение осмолярности 0,9% раствора NaCI составит 308×0,93, или 286 мосм/л. На практике при определении осмолярности и осмотического давления растворов, используемых для инфузий, поправкой на осмотический коэффициент иногда пренебрегают.
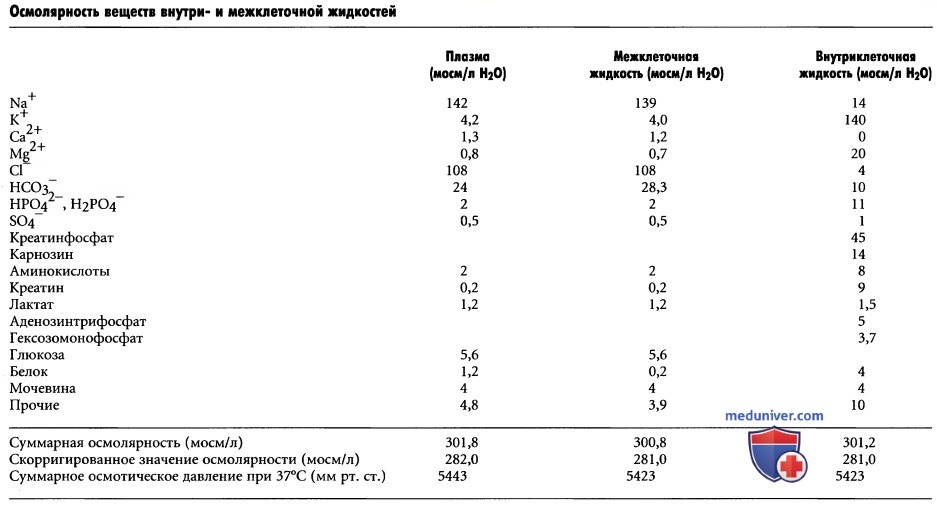
б) Осмолярность жидких сред организма. В таблице выше, обратим внимание на приблизительные значения осмолярности различных веществ, растворенных в плазме, межклеточной и внутриклеточной жидкостях. Отметим, что около 80% всей осмолярности межклеточной жидкости обусловлены ионами Na+ и Cl-, тогда как во внутриклеточной жидкости почти половина осмолярности создается ионами К+, а оставшаяся часть распределена между ионами других веществ.
Как видно из таблицы выше, суммарная осмолярность каждой из трех основных жидкостей организма составляет около 300 мосм/л. По сравнению с межклеточной и внутриклеточной жидкостями осмолярность плазмы на 1 мосм/л выше. Это небольшое различие обусловлено белками, которые поддерживают в просвете капилляров более высокое давление (выше на 20 мм рт. ст.), чем в окружающей межклеточной жидкости.
в) Скорригированное значение осмолярности жидких сред организма. В нижней строке таблицы выше приведено скорригированное значение осмолярности плазмы, межклеточной и внутриклеточной жидкостей. Причиной введения поправок являются силы притяжения и отталкивания между ионами или молекулами в растворе, которые вызывают, соответственно, небольшое увеличение или небольшое снижение осмотической «активности» растворенного вещества.
г) Суммарное осмотическое давление жидких сред организма. В таблице выше также приведены суммарные значения осмотического давления различных жидкостей, измеренные по разные стороны мембраны, при этом одна ее сторона погружалась в дистиллированную воду. Отметим, что суммарное давление в плазме равно произведению скорригированной осмолярности плазмы (282 мосм/л) на коэффициент 19,3. В итоге получим 5443 мм рт. ст.
Видео физиология фильтрации в почках и поддержки осмотического давления крови — профессор, д.м.н. П.Е. Умрюхин
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
http://xumuk.ru/colloidchem/90.html
http://meduniver.com/Medical/Physiology/688.html