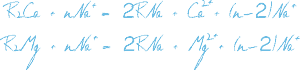Механизмы катионного обмена, особенности адсорбции
Содержание тяжелых металлов в почвенном растворе и доступность их для растений, в значительной мере, зависит от адсорбционных свойств почвы, Высокая адсорбционная активность почв способствует большему закреплению металлов и снижению их подвижности.
Адсорбция (от лат. ad — на, при и sorbeo — поглощаю) — преимущественное концентрирование молекул газа или растворенного в жидкости вещества (адсорбата) на поверхности жидкости, или твердого тела (адсорбента), а также растворенного в жидкости вещества на границе ее раздела с газовой фазой.
Если молекулы адсорбата образуют поверхностное химическое соединение с адсорбентом, то говорят о хемосорбции. Адсорбция увеличивается с ростом давления газа или концентрации раствора. При снижении парциального давления адсорбируемого компонента газовой смеси или бесконечном разбавлении раствора адсорбция уменьшается вплоть до полного освобождения поверхности адсорбента от молекул адсорбата. Адсорбцию вызывают молекулярные силы поверхности адсорбента. Неполярные молекулы удерживаются за счет дисперсионных сил. Полярные молекулы (диполи, мультиполи) взаимодействуют с электростатическим полем поверхности адсорбента, что усиливает адсорбцию. Считается, что адсорбционно-десорбционное равновесие в системе почвенно-паглащающий комплекс (ППК) – почвенный раствор осуществляется, как правило, посредствам ионообменного механизма.
Под (ППК) по мнению К.К.Гедройц понимают совокупность соединений, проявляющих способность к обменным реакциям в почве. Совокупность обменных реакций обеспечивается в основном наличием в почве обменных катионов, представленных главным образом элементами первой и второй группами периодической системы. В кислых почвах значительную роль играют Н+ и Al 3+
В обменной форме в почве находятся ионы: Zn2+ Cu2+ Mn 2+ Pb2+
Основные учения об ионном обмене и его исследования в теоретическом и практическом почвоведенье создал К.К.Гедройца. Он рассматривал ионный обмен как одну из форм поглотительной способности почв и предложил разделить следующие виды поглотительной способности:
1. Механическую — свойство почвы задерживать частицы, взмученные в фильтрующей через нее воде.
2. Физическую – концентрирование или разжижение растворенных в почвенном растворе веществ у поверхности соприкосновения твердых частичек почвы с поглощенной влагой, обусловленную поверхностной энергией почвенных частиц.
3. Физико-химическую, или обменную- свойство почвы обменивать некоторую часть содержащихся в твердых фазах катионов на эквивалентное количество катионов, находящихся в соприкосаемом с нею растворе
4. Химическую – образование в почвенном растворе нерастворимых или малорастворимых солей, которые выпадают в осадок и примешиваются к твердым фазам почвы.
5. Биологическую – обязана населяющим почвы растениям и микроорганизмам и заключается в поглощении живыми организмами различных веществ из почвенного раствора.
Катионообменная способность — относится к числу фундаментальных свойств почвы. Ее роль можно охарактеризовать следующими положениями:
1) От состава обменных катионов зависит пептизируемость почв, их агрегатность.
2) От состава обменных катионов зависит поглощение органических веществ твердыми фазами, образование органо-минеральных соединений. Способствуют органо-мениральным взаимодействиям катионы железа, алюминия, кальция и магния.
3) Реакции между обменными катионами и катионами почвенного раствора влияют на рН почвенного раствора и его солевой состав. Эти реакции один из основных способов формирования кислотно-основной и других видов буферной способности почв.
4) От состава обменных катионов зависит классификация почв.
5) Законы катионного обмена являются теоретической основой для некоторых видов химической мелиорации почв и известкования кислых почв и гипсования солонцов.
Катионный обмен – частный случай ионного обмена, под которым в химии понимают обратимый процесс стехиометрического обмена ионами между двумя контактирующими фазами.
Реакцию обмена катионов Mn+ и Мm+ формально можно записать:
П (Мn+)м + nМм+ = П (Мм+)n + м Мn+, (53)
где П – почвенный поглощающий комплекс.
Почвенный поглощающий комплекс — это совокупность минеральных, органических и органо-минеральных компонентов твердой части почвы, обладающих ионообменной способностью. Согласно определению, в ППК входят и способные к обменным реакциям катионы; в противном случае этот комплекс не смог бы выделить в ходе реакции эквивалентное количество катионов в обмен на катионы почвенного pacтвopa. He все твердые фазы почв способны проявлять катионообменную способность.
Важнейшей характеристикой почвенного поглощающего комплекса и почвы в целом является емкость катионного обмена (ЕКО). Которая равна сумме всех обменных катионов, которые можно вытеснить из данной почвы. Величина ЕКО существенно зависит от рН, взаимодействующего с почвой раствора, и несколько варьирует при замене одного вида насыщающего катиона на другой.
Емкость катионного обмена зависит от механического состава почвы и строения веществ, входящих в состав почвенного поглощающего комплекса. Увеличение ЕКО в тяжелых по механическому составу почвах обусловлено не только нарастанием удельной поверхности, но и изменением природы слагающих различные фракции веществ. Пред-илистые и илистые фракции содержат слоистые алюмосиликаты, в них повышено содержание гумусовых веществ.
Основываясь на общих законах ионообменной сорбции, М. Б. Минкин [7] выделяет пять последовательных стадий осуществления реакции обмена катионов раствора на катионы ППК:
— перемещение вытесняющего иона из объема раствора к поверхности ППК;
— перемещение вытесняющего иона внутри твердой фазы ППК к точке обмена;
— химическая реакция обмена катионов;
— перемещение вытесненного иона внутри твердой фазы от точки обмена к поверхности ППК;
— перемещение вытесненного иона от поверхности ППК в раствор
В почвенной среде поток диффундирующего вещества складывается двумя составляющими: диффузией в поровом растворе и перемещением в адсорбированном состоянии за счет поверхностной диффузии [9].
При количественном описании катионного обмена нередко употребляют уравнения изотерм адсорбции, например уравнения Фрейндлиха, Ленгмюра и др. Иногда и само явление обмена рассматривают как один из видов адсорбции. Между тем различия между адсорбционными явлениями и ионным обменом настолько велики, что на этом следует остановиться подробнее. Реакциям катионного обмена свойственны иные признаки. Для катионного обмена характерны:
1. Обратимость реакции.
2. Скорость реакции контролируется диффузионными процессами.
3. Реакции обмена стехиометричны.
4. Выражена селективность по отношению к различным ионам.
Одно из главных различий между адсорбцией и ионным обменом заключается в том, что обменные катионы являются обязательным компонентом ППК и могут быть только заменены на катионы другого рода, но не удалены вовсе. Попытка пространственного расчленения ППК на анионную часть и катионы привела бы к нарушению принципа электронейтральности. В противоположность этому поверхность адсорбента может быть полностью лишена молекул адсорбата. Общее содержание обменных катионов остается сравнительно постоянным (в пределах постоянства величины ЕКО), тогда как количество адсорбированного вещества является функцией активности адсорбата в объеме фазы. Иными словами, адсорбент и адсорбат могут существовать раздельно, тогда, как ППК составляет единое целое.
Дата добавления: 2014-12-27 ; просмотров: 1823 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Подготовка воды ионным обменом
Умягчение, обессоливание и селективное удаление различных ионов из воды.
В технологии водоподготовки, на ряду и в сочетании с технологиями нанофильтрации и обратного осмоса, применяются два основных процесса для удаления из воды ионизированных примесей: катионирование и анионирование.
В зависимости от обменного иона процессы и аппараты называют: натрий-катионирование (натрий-хлор-ионирование), натрий-катионитный фильтр; H (водород)-катионирование, H-катионитный фильтр; OH-анионирование, OH-анионитный фильтр. Соответственно называется фильтрат, полученный в этих процессах: Na-катионированная вода, H-катионированная вода, OH-анионированная вода и т.п.
Процессы Na-катионирование имеет самостоятельное значение и используется для умягчения воды, в то время как процессы H- и OH-ионирование реализуются совместно в схемах обессоливания воды. Н-катионирование может осуществляться в схемах H-Na-катионирования воды.
Процессы ионирования воды на водоподготовительных установках реализуются в напорных насыпных ионитных фильтрах раздельного и смешанного действия.
Технологии ионного обмена:
УМЯГЧЕНИЕ ВОДЫ Na-КАТИОНИРОВАНИЕМ
Процесс Na-катионирования применяют для умягчения воды путем фильтрования ее через слой катионита в натриевой форме. При этом ионы Ca 2+ и Mg 2+ , обуславливающие жесткость исходной воды, задерживаются катионитом в обмен на эквивалентное количество ионов Na 2+ .
Процесс ионного обмена при натрий-катионировании воды:
R — матрица с фиксированными зарядами без обменного иона, считающаяся одновалентной.
Остаточная жесткость фильтра при одноступенчатом Na-катионировании может быть получена при надлежащих условиях регенерации фильтра на уровне 10 — 20 мкг-экв/л, что является определяющим при реализации этого процесса.
Анионный состав Na-катионированной воды остается неизменным, поэтому карбонатная жесткость исходной воды переходит в гидрокарбонат натрия (NaHCO3).
Образование гидрокарбоната натрия при умягчении (Na-катионировании) воды:
R — матрица с фиксированными зарядами без обменного иона, считающаяся одновалентной.
Гидрокарбонат натрия, при нагревании воды более 80 О C, превращается в конечном итоге в гидроксид натрия по реакциям:
который может инициировать щелочную коррозию.
Неизменность величины щелочности при Na-катионировании является основным недостатком этого процесса (применительно к подготовке воды для теплоэнергетики), поэтому он может иметь самостоятельное значение только при подготовке воды для подпитки теплосети и добавочной воды для котлов низкого и среднего давлений при сравнительно низкой щелочности исходной воды.
Второй недостаток рассматриваемой технологии определяется увеличением солесодержания фильтрата при выражении его в массовых единицах, что связано с эквивалентными массами ионов Na + (23 единицы), Ca 2+ (20 единиц) и Mg 2+ (12 единиц). Напомним, что ионный обмен характеризуется эквивалентностью, поэтому из воды удаляются ионы с меньшей эквивалентной массой (Ca 2+ , Mg 2+ ), а их место занимает ион натрия с большей эквивалентной массой.
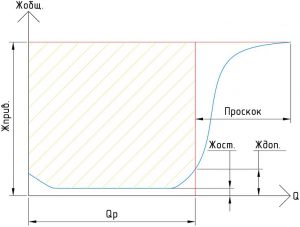
Процесс умягчения при Na-катионировании заканчивается при наступлении проскока жесткости, после чего истощенный катионит в фильтре надо регенерировать, т.е. восстанавливать его способность к обмену ионами.
Кривая качества фильтрата при натрий-катионировании, определяющая величину фильтроцикла — QP (М 3 ):
Жприв. — жесткость исходной (приводной) воды (мг-экв./л);
Жост. — остаточная жесткость фильтрата на протяжении всего фильтроцикла (мг-экв./л);
Ждоп. — максимальная допустимая остаточная жесткость фильтрата (мг-экв./л).
Регенерацию истощенного катионита проводят пропуском через него 6 — 10% раствора NaCl (например поваренная соль). Вследствие относительно большой концентрации ионов Na + в регенерационном растворе происходит замена ими поглощенных ранее катионов Ca 2+ и Mg 2+ .
Процесс восстановления обменной способности катионита в натрий-форме:
R — матрица с фиксированными зарядами без обменного иона, считающаяся одновалентной;
n — избыток NaCl против его стехиометрического расхода.
Несмотря на то, что процесс обмена ионов, в том числе и при регенерации ионита, характеризуется эквивалентностью, для качественной регенерации ионитов расход реагента выбирается с определенным избытком (n).
При подаче раствора соли в фильтр лучше будет отрегенерирован лобовой катионита, контактирующий со свежим раствором. По мере прохождения раствора в глубинные части катионита условия регенерации будут ухудшаться вследствие повышения концентрации в регенерационном растворе ионов Ca 2+ и Mg 2+ , вытесненных из верхних слоев катионита при обеднении регенеранта ионами Na + . Аналогичное действие проявляется за счет загрязнения раствора технической соли ионами Ca 2+ и Mg 2+ .
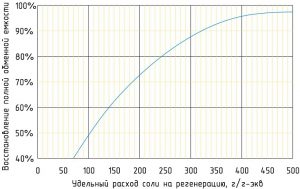
На практике расход соли на регенерацию принимают в пределах 120 — 150 г/г-экв по экономическим и экологическим соображениям, поэтому рабочая обменная емкость не достигает значения полной. Ограничение расхода соли позволяет уменьшить ее количество в сточных регенерационных водах. Эффект прироста обменной емкости с увеличением удельного расхода более 300 г/г-экв заметно снижается.
Зависимость восстановления обменной емкости натрий-катионитовой установки от удельного расхода соли на регенерацию:
Эффект регенерации катионита при выбранном расходе реагента повышается с увеличением продолжительности контакта раствора соли с катионитом, поэтому скорость пропуска регенерационного раствора ограничивают пределами 4 — 6 м/ч. Скорость ниже 4.0 м/ч не используется по гидродинамическим условиям работы фильтра.
Регенерацию ионита в фильтрах можно проводить несколькими способами, которые отличаются друг от друга направлениями потоков обрабатываемой воды и регенерационного раствора. При совпадении направлений потока воды и регенерационного раствора, подаваемых обычно сверху — вниз, регенерацию называют параллельно-точной, такая регенерация создает не самые оптимальные условия для процесса умягчения из-за распределения ионов Na + и ионов жесткости в слое отрегенерированного материала. На выходе из слоя катионита умягчаемая вода, в которой резко снижена концентрация ионов жесткости, проходит через участки плохо отрегенерированного катионита и поэтому не может глубоко умягчаться. Кроме того, такое обстоятельство может привести к переходу некоторой части ионов жесткости из катионита в воду.
При противоточной регенерации регенерационный раствор подается в направлении, противоположном подаче потока обрабатываемой воды, при этом наиболее полно регенерируются выходные (по воде) слои катионита. Это позволяет не только сохранить постоянное значение остаточной концентрации ионов в фильтрате, но и получить фильтрат более высокого качества при сниженных избытках реагента и, следовательно, меньших объемах сточных вод.
Эффективная противоточная технология позволяет сократить количество ступеней очистки воды за счет повышения качества фильтрата. К недостатку противоточной регенерации относится усложнение конструкции фильтра, связанное с недопущением перемешивания слоев ионита при подаче раствора или воды в нижнюю часть фильтра.
Для сокращения расхода реагентов с использованием параллельно-точной технологии регенерации применяют двухступенчатую схему Na-катионирования, т.е. последовательное включение двух фильтров. Фильтр первой ступени регенерируется с относительно наибольшем избытком NaCl (n = 1.8 — 2.4), поэтому остаточная жесткость фильтрата получается высокой, на уровне 0.1 мг-экв/л. Фильтр второй ступени регенерируется с 6.5 — 7.5-кратным избытком соли, поэтому остаточная жесткость воды снижается со 100 до 5 — 10 мкг-экв/л.
Технико-экономические расчеты показывают, что, несмотря на увеличение количества фильтров в двухступенчатой схеме, последняя имеет преимущества перед одноступенчатой схемой за счет снижения расхода соли при равноценном качестве умягченной воды.
Экология СПРАВОЧНИК
Информация
Добавить в ЗАКЛАДКИ
| Поделиться: | Обменные катионыВ катионите, представляющем собой гелеобразную систему, состоящую из крупных мицелл, обмен ионов обусловлен двумя одновременно протекающими процессами: сорбцией катионов из умягчаемой воды на твердой фазе катионита и десорбцией вытесняемых катионов из мицелл катионита в воду. Обмен катионов происходит в строго эквивалентных соотношениях. Энергия вхождения различных катионов в катионит по величине их динамической активности может быть охарактеризована для одинаковых условий следующим рядом: Ыа+ Ме3+ > Ме2+ > Ме+, А4- > А3- > А2+ > А» Комплексообразование в системе Ме” —Ат приводит к образованию соединений с меньшим и даже противоположным зарядом. Например, в системе Ве2+— Р» образуется ряд: Ве2 + , ВеР+, ВеР®, ВеРзгВеР!»». Поэтому способность бериллия к сорбции и катионному обмену уменьшается в ряду: Ве2+ > ВеР+ >ВеР?.[ . ] Качество почвы. Экстракция следов элементов, растворимых в воде. Качество почвы. Определения потенциальной катионообменной емкости и способных к обмену катионов с применением буферного раствора хлорида бария при pH 8,1.[ . ] Емкость поглощения зависит от содержания в почвах коллоидов и их природы. Чем больше в почве гумусовых веществ и ила, содержащего минералы монтмориллонитовой группы, тем выше ЕКО. Состав обменных катионов и степень насыщенности основаниями отражают особенности почвообразовательных процессов.[ . ] Эдафические (от греч. ейарЬоБ — почва)факторы — почвенные условия произрастания растений. Они делятся на химические — реакция почвы, солевой режим почвы, элементарный химический состав почвы, обменная способность и состав обменных катионов; физические — водный, воздушный и тепловой режимы, плотность и мощность почвы, ее гранулометрический состав, структура и др.; биологические — растительные и животные организмы, населяющие почву (Хрусталев, Матишев, 1996). Из них важнейшими экологическими факторами являются влажность, температура, структура и пористость, реакция почвенной среды, засоленность.[ . ] Процессы, протекающие в фильтре, отрегенерированном «голодной» нормой кислоты, можно представить следующим образом. При пропускании воды через верхние слои катионита, практически содержащие лишь обменные катионы водорода, проходят реакции обмена, типичные для обычных водород-катионито-вых фильтров. В результате образуются сильные минеральные кислоты и угольная кислота.[ . ] Качественные изменения происходят и в составе поглощенного комплекса (ПК) глинистых пород. Вне влияния техногенеза на геологическую среду глинистые породы характеризуются повышенными значениями емкости ПК до 40—45 ммоль/100 г. В составе обменных катионов доминирующими являются кальций (до 97%) и магний (7,0— 75%). Доля натрия и калия не превышает 2—4%. Под прудом-накопителем (после прекращения сброса стоков) в результате катионообменных процессов между породой и нефтяными рассолами в глинистых осадках, слагающих основание пруда, концентрация натрия и калия достигает 100-250 мг/100 г (10-53,5%). Доля кальция снижается до 60-47%.[ . ] Основными аналитическими диагностическими показателями являются: показатели состава — содержание и состав гумуса, валовой состав минеральной части, содержание карбонатов, легкорастворимых солей, подвижных форм элементов питания и др.; показатели свойств — реакция, емкость катионного обмена и состав обменных катионов, биологическая активность; физические свойства (плотность, структура) и др.[ . ] Тип III многослойного литологического строения; представлен чередованием слоев песчаных и глинистых отложений казанского и татарского ярусов верхней перми, нижнего и среднего триаса, сформированных в континентально-лагунных условиях. В P2t2 наблюдаются слои и прослои известняков. Характерные минералого-геохимические особенности пласта: очень незначительная загипсованность (преимущественно десятые доли %); тяжелые металлы представлены главным образом гидроокислами; водные вытяжки пород имеют как правило гидрокарбонатный кальциево-магниевый состав; среди обменных катионов преобладают кальций и магний. В литологическом строении зоны аэрации принимают участие элювиальноделювиальные четвертичные отложения, представленные суглинками, глинами, супесями, дресвяными образованиями моашостью до 5-10 м. Водопроводимость пласта от единиц до 50-80 м/сут и более. Коэффициент фильтрации — 0,1-15 м/сут. Пласт распространен на правобережье р.Урал. Вследствие некоторых особенностей вертикального строения водоносного пласта на различных участках территории — глинистости и карбонатности пород, типа проницаемости пород, литологического строения зоны аэрации — тип III подразделен на три подтипа.[ . ] Полиморфность твердой фазы почвы обуславливает ее рыхлость (газо- и влагопроницаемость) и большую суммарную поверхность частиц: 3-5 м2/г у песчаных почв, 30-150 м2/г у супесчаных и суглинистых и до 300-400 м2/г у глинистых. Наименьшие размеры имеют коллоиды почвы — их диаметр измеряется сотыми долями микрометра. Благодаря большой суммарной поверхности почвенные частицы, особенно коллоидная фракция, обладают высокой поглотительной способностью. На частицах этой фракции происходит поглощение электролитов, образование малорастворимых и нерастворимых солей, выпадающих в осадок и примешивающихся к твердой фазе почвы, обмен катионами между твердой фазой и почвенными растворами.[ . ] Взаимодействие воды с присутствующими в ней взвешенными минеральными веществами может быть различным. Часто она является химически связанной с породами, попадающими в нее при размыве берегов или в результате смыва поверхностного покрова, она способна также образовывать адсорбционные стабилизирующие слои на поверхности частиц. Химически связанная вода — кристаллизационная, конституционная и частично цеолит-ная — участвует в построении кристаллической решетки минералов, и для ее удаления требуется расход большого количества энергии. Адсорбированная частицами вода по затрате энергии, необходимой для ее выделения, разделяется на три группы: 1) наиболее прочно связанная, находящаяся под воздействием координационно-ненасыщенных атомов в кристаллической решетке; 2) прочно связанная, гидратирующая обменные катионы частиц породы; 3) слабо связанная, группирующаяся вокруг адсорбционных центров и образующая полислойные пленки с водородными связями.[ . ] источники: http://univod.ru/texnologii/ionnyj-obmen/ http://ru-ecology.info/term/22023/ |