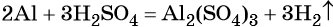Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях
Химической реакцией называют взаимодействия, приводящие к изменению химической природы участвующих в них частиц. При этом происходит изменение их состава и (или) строения. В химических реакциях могут участвовать атомы, молекулы, ионы и радикалы.
В ходе химических реакций атомные ядра не затрагиваются и число атомов каждого химического элемента сохраняется.
Химические реакции протекают при определённых условиях (температура, давление, наличие или отсутствие растворителя, катализа, ультрафиолетовое излучение).
Признаками протекания химических реакций являются выделение или поглощение газа, образование или растворение осадка, изменение цвета, выделение или поглощение теплоты.
Описание качественных реакций, используемых для определения некоторых катионов и анионов, приводится в приложении в конце урока.
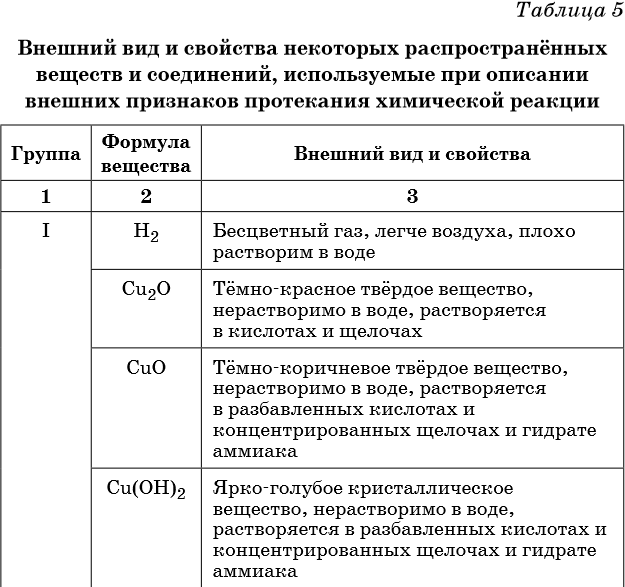
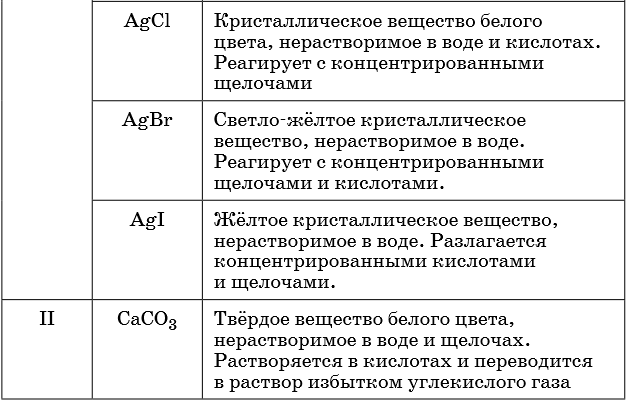
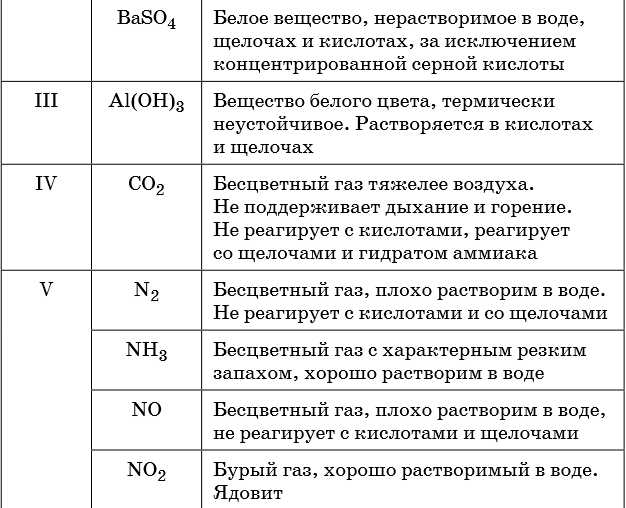
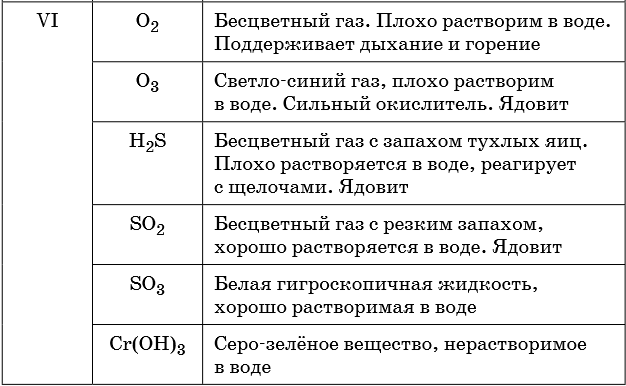
В таблице 5 представлены сведения о внешнем виде и свойствах некоторых распространённых веществ и соединений, используемых при описании внешних признаков протекания химической реакции.
Для описания химических реакций используют химические уравнения, в левой части которых указывают исходные вещества, а в правой — продукты реакции. Обе части химического уравнения соединяют стрелкой (в случае необратимых химических превращений), а если химическая реакция является обратимой, то это показывают с помощью прямой и обратной стрелок.
В неорганической химии, если количество атомов химических элементов в левой и правой частях уравнено с помощью стехиометрических коэффициентов, части уравнения часто соединяют знаком равенства.
Стехиометрией называют учение о количественных соотношениях между реагентами и продуктами реакции.
Коэффициенты стехиометрические — действительные натуральные (то есть положительные, как правило, целые) числа, стоящие перед формулой химического вещества в уравнении реакции. Коэффициенты показывают минимальное количество структурных единиц вещества (атомов, молекул, ионов, радикалов), участвующих в данной реакции.
В вышеприведённой реакции два атома алюминия реагируют с тремя молекулами серной кислоты, в результате чего образуется одна молекула сульфата алюминия (коэффициент, равный одному, перед формулой не ставят) и три молекулы водорода.
В соответствии с законом сохранения массы (закон Ломоносова — Лавуазье) масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Этот закон подтверждает, что атомы являются неделимыми и в ходе химических реакций не изменяются. Молекулы при реакциях претерпевают изменения, но общее число атомов каждого вида не изменяется, и поэтому общая масса веществ в процессе реакции сохраняется.
Тренировочные задания
1. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) растворение осадка
2) выделение чёрного осадка
3) отсутствие внешних признаков
4) выделение синего осадка
2. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) растворение осадка
3) выделение белого осадка
4) выделение синего осадка
3. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение жёлто-зелёного газа
3) выделение жёлтого осадка
4) растворение осадка
4. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) появление оранжевой окраски
2) выделение газа с характерным запахом
3) растворение осадка
4) отсутствие внешних признаков
5. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) отсутствие внешних признаков
3) выделение белого осадка
4) выделение чёрного осадка
6. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Zn и KOH
В) HCl и FeS
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) выделение газа с характерным запахом
3) выделение бесцветного газа
4) выделение чёрного осадка
7. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
8. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
9. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение синего осадка
2) растворение осадка
3) выделение белого осадка
4) выделение бурого осадка
10. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Al и NaOH
В) HCl и K2SO3
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
11. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) отсутствие внешних признаков
12. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu и HNO3 (конц.)
Б) Cu и H2SO4 (конц.)
В) BaCO3 и HCl
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение бесцветного газа
13. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
14. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого осадка
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
15. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа
3) выделение белого осадка
4) выделение чёрного осадка
16. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
17. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение чёрного осадка
18. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
19. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) выделение студенистого бесцветного осадка
20. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
Какое уравнение химической реакции отражает превращение
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Составление уравнений химических реакций
Урок посвящен изучению алгоритма составления уравнения химической реакции. В ходе урока вы научитесь составлять схему и уравнение химической реакции, зная формулы исходных веществ и продуктов реакции.
I. Схема химической реакции
Сущность химической реакции с позиции атомно-молекулярной теории заключается в том, что продукты реакции образуются из тех же атомов, которые входили в состав исходных веществ.
Пример 1. При разложении воды образуются простые вещества – водород и кислород (Рис.1.).
Рис. 1. Разложение воды под действие электрического тока
Запишем формулу исходного вещества воды слева, а формулы продуктов реакции — водорода и кислорода – справа. Между ними поставим стрелку:
Эта запись является схемой реакции.
Схема реакции показывает только состав исходных веществ и продуктов реакции, но не может полностью отражать сущность реакции. В состав молекулы воды входит один атом кислорода, а в состав простого вещества кислорода входят два атома. Это значит, что не выполняется закон сохранения массы веществ.
II. Химические уравнения реакций
Химическое уравнение – это условная запись химической реакции посредством химических формул и коэффициентов.
В результате химического взаимодействия серы и железа получено вещество – сульфид железа (II) – оно отличается от исходной смеси. Ни железо, ни сера не могут быть визуально обнаружены в нем. Невозможно их разделить и с помощью магнита. Произошло химическое превращение.
Запишем протекающую реакцию в виде уравнения химической реакции:
Рассмотрим еще один пример: 2Н2О = 2Н2 + О2
Чтобы не было противоречий с законом сохранения массы веществ, нужно уравнять число атомов каждого химического элемента слева и справа от стрелки.
Чтобы образовалась одна молекула кислорода, в реакцию должны вступить две молекулы воды. Поставив коэффициент «2» перед формулой воды. Теперь уравняем количество атомов водорода, поставив коэффициент «2» перед формулой Н2, вместо стрелки поставим знак равенства:
Эта запись является уравнением химической реакции. В отличие от схемы реакции, уравнение учитывает, что число атомов каждого химического элемента в реакции не меняется.
Цифры, стоящие перед формулой вещества, называются коэффициентами. Коэффициент показывает количество молекул вещества.
Прочитать записанное уравнение можно так: «Из двух молекул воды образуется две молекулы водорода и 1 молекула кислорода».
Составим уравнение химической реакции взаимодействия фосфора и кислорода
1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – H2; N2; O2; F2; Cl2; Br2; I2. Между реагентами ставим знак «+», а затем стрелку:
2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии). Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов:
3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции.
- Вначале уравнивают число атомов, которых в реагирующих веществах (продуктах) содержится больше.
- В данном случае это атомы кислорода.
- Находим наименьшее общее кратное чисел атомов кислорода в левой и правой частях уравнения. Наименьшее кратное для атомов натрия –10:
Естествознание. 10 класс
Конспект урока
Естествознание, 10 класс
Урок 42. Движение как качественное изменение. Химические реакции
Перечень вопросов, рассматриваемых в теме: Как во времени протекает химическая реакция? Что такое механизм химической реакции и как реакции можно классифицировать по механизму их протекания? Как определяется скорость химической реакции для различных процессов? Что такое кинетическое уравнение реакции и в чём его смысл? Как различные факторы влияют на скорость реакции? Каков механизм действия катализатора?
Глоссарий по теме:
Химическая кинетика – это раздел химической науки, изучающий механизм и скорость химической реакции.
Скорость химической реакции определяется изменением количества реагирующих веществ или продуктов реакции за единицу времени в единице объёма (для гомогенных систем) или на единице поверхности (для гетерогенных систем).
Закон действующих масс – при постоянной температуре скорость данной реакции пропорциональна произведению концентраций реагирующих веществ.
Механизм химической реакции – это последовательность элементарных стадий процесса, в результате которого исходные вещества превращаются в продукты реакции.
Энергия активации – это средняя избыточная энергия (по сравнению со средней энергией движения), которой должны обладать реагирующие частицы (атомы, молекулы), чтобы преодолеть энергетический барьер, разделяющий в химической реакции реагенты (исходные вещества) и продукты (конечное состояние).
Правило Вант-Гоффа – при повышении температуры на каждые 10 0 С скорость реакции увеличивается в среднем в 2 – 4 раза.
Катализ – это изменение скорости реакции под действием катализаторов.
Катализатор (от греч. katalysis – разрушение) – это вещества, изменяющие скорость реакции, участвующие в промежуточных стадиях реакции, но при этом не расходующиеся.
Ферменты (от лат. fermentum – закваска) – это вещества, катализирующие биохимические реакции в организмах.
Основная и дополнительная литература по теме урока:
1. Естествознание. 10 класс: учебник для общеобразоват. организаций: базовый уровень / И.Ю. Алексашина, К.В. Галактионов, И.С. Дмитриев, А.В. Ляпцев и др. / под ред. И.Ю. Алексашиной. – 3-е изд. – М.: Просвещение, 2017. – С. 184-189.
2. Энциклопедия для детей. Том 17. Химия. / Глав. ред. В.А. Володин. – М.: Аванта+, 2000. – С. 116-126; 568-576.
3. Савинкина Е.В. История химии. Элективный курс: Учебное пособие / Е.В. Савинкина, Г.П. Логинов, С.С. Плоткин. – М.: БИНОМ. Лаборатория знаний, 2007. – С. 139-144.
Открытые электронные ресурсы по теме урока:
Левченков С.И. Химическая кинетика // Краткий очерк истории химии: Учебное пособие для студентов химфака РГУ. URL:
Теоретический материал для самостоятельного изучения
Многообразие объектов Вселенной отражается в многообразии видов и форм движения. Качественные изменения, которые происходят в ходе химических превращений, можно интерпретировать как особый вид движения, а саму химическую реакцию рассматривать как определенную химическую форму движения. Изучением того, как во времени протекают химические процессы, занимается химическая кинетика – область химической науки, становление которой началось со второй половины XIX века.
Химические процессы протекают с различной скоростью: бронзовый памятник во влажном воздухе медленно покрывается голубоватым налетом, значительно быстрее покрывается ржавчиной железный предмет, лежащий в воде, долька яблока через несколько часов покрывается бурой пленкой, а образование осадка при сливании растворов, например, сульфата натрия и хлорида бария, происходит очень быстро. Для количественной характеристики скорости химической реакции используют не время её протекания, а скорость изменения количества вещества (в моль), вступающего в реакцию или образующегося в ходе реакции. Таким образом, скорость химической реакции определяется изменением количества реагирующих веществ или продуктов реакции за единицу времени в единице объёма (для гомогенных систем) или на единице поверхности (для гетерогенных систем). Напомним, что гомогенная система состоит из одной фазы, а гетерогенная система – из нескольких фаз, разграниченных между собой поверхностями раздела. Наиболее часто в химии рассматривается зависимость концентрации веществ от времени, поэтому скорость реакции можно определять как изменение концентрации одного из реагирующих веществ или одного из образующихся в ходе реакции веществ в единицу времени.
𝑣 = ± ∆с/∆t, где 𝑣 – скорость реакции, ∆с – изменение концентрации вещества, ∆t – промежуток времени, в котором определяют скорость реакции. Если скорость определяют по изменению концентрации реагирующего вещества, которая в ходе реакции уменьшается, то перед формулой ставят знак «–», если скорость определяется по изменению концентрации продукта реакции, которая в ходе реакции увеличивается, то перед формулой ставят знак «+». Скорость химической реакции изменяется во времени, поэтому по приведенной формуле можно вычислить только среднюю скорость реакции в определенном интервале времени. Графическое изображение зависимости концентрации реагентов от времени называется кинетической кривой. С помощью кинетической кривой можно графически определить истинную скорость реакции в каждый момент времени.
Чтобы управлять химической реакцией – замедлять или ускорять химические процессы, необходимо знать, от чего зависит скорость реакции. Особенно важно знать зависимость скорости реакции от концентрации реагирующих веществ. Впервые скорость химической реакции и её зависимость от концентрации исходных веществ исследовал немецкий химик Людвиг Фердинанд Вильгельми (1812 – 1864), изучая гидролиз сахарозы. В своей работе, опубликованной в 1850 году, он привел формулу, отражающую зависимость скорости реакции от концентрации реагирующих веществ – первое кинетическое уравнение химической реакции. В 1864 – 1867 гг. норвежские учёные Като Максимилиан Гульдберг (1836 – 1902) и Петер Вааге (1833 – 1900) опубликовали работы, в которых на основе сотен экспериментов доказали, что скорость реакции пропорциональна произведению «действующих масс» реагентов, т.е. (концентрациям). Таким образом, количественно зависимость между скоростью реакции и концентрацией определяется основным законом химической кинетики – законом действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для некоторой реакции xA + yB → zD эта зависимость будет иметь вид: 𝑣 = k∙CA x ∙CB y , где СА и СВ – молярные концентрации веществ А и В, k – коэффициент пропорциональности, называемый константой скорости химической реакции, численно равный скорости реакции при концентрации всех реагирующих веществ, равных 1 моль/л и определяемый экспериментально. Зависимость скорости реакции от концентрации реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Скорость гетерогенных реакций, протекающих на границе раздела фаз не зависит от концентрации. Как правило, при низких температурах скорость гетерогенных реакций зависит от площади поверхности раздела фаз и температуры.
Превращение одних веществ в другие не является одномоментным событием, – это сложный процесс, который развертывается во времени и пространстве. Еще в XIX веке учёные определили, что химические реакции в подавляющем большинстве являются многостадийными процессами. Последовательность элементарных стадий процесса, в результате которого исходные вещества превращаются в продукты реакции, называется механизмом реакции. По числу стадий реакции подразделяются на простые (элементарные) и сложные. Простые реакции осуществляются в одну стадию, химическое уравнение таких реакций полностью отражает какие и сколько частиц участвуют непосредственно в элементарном акте химического взаимодействия. В реакциях изомеризации или диссоциации, например, происходит химическое превращение одной молекулы. Есть простые реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или разных) или даже трёх частиц. Сложные реакции осуществляются в несколько стадий, каждая из которых является простой реакцией. Каждая из стадий протекает со своей скоростью. Скорости отдельных стадий могут существенно отличаться друг от друга. Скорость сложной реакции в целом будет определяться скоростью самой медленной стадии, которая называется лимитирующей. Механизмы химических реакций определяются экспериментально.
Скорость химической реакции зависит от температуры. Впервые влияние температуры на скорость реакции было учтено Якобом Генриком Вант-Гоффом (1852 – 1911), им было сформулировано эмпирическое правило (правило Вант-Гоффа): при повышении температуры на каждые 10°С скорость реакции увеличивается в 2 – 4 раза. Однако это правило носит приближенный характер и применимо лишь в узком интервале температур. Более точно зависимость скорости химической реакции от температуры была определена шведским химиком Сванте Августом Аррениусом (1859 – 1927), он ввёл понятие энергии активации и сформулировал закон температурной зависимости для константы скорости простых реакций.
Многие химические процессы в растворе или газовой фазе происходят при столкновении частиц реагирующих веществ. Число таких соударений огромно. Если бы все соударения частиц приводили к химическому взаимодействию, то реакции протекали бы мгновенно, однако этого не происходит. Это объясняется тем, что не все соударения приводят к химическому взаимодействию. Чтобы соударение было эффективным (привело к химическому взаимодействию) столкнувшиеся частицы должны обладать достаточной энергией для разрыва или ослабления химических связей в молекулах реагирующих веществ. В результате происходит образование некоторого промежуточного неустойчивого комплекса (активированного комплекса) с последующим перераспределением электронной плотности и образованием продуктов реакции. Средняя избыточная энергия (по сравнению со средней энергией движения), которой должны обладать реагирующие частицы (атомы, молекулы), чтобы преодолеть энергетический барьер, разделяющий в химической реакции реагенты (исходные вещества) и продукты (конечное состояние) называется энергией активации. Так как при повышении температуры доля частиц, обладающих избыточной энергией увеличивается, то увеличивается и число эффективных соударений и, следовательно, константа скорости реакции.
На скорость реакции могут оказывать влияние вещества, которые получили название катализаторов. Еще с начала XIX века химики обратили внимание на необычные химические реакции, для протекания которых требовалось добавление некоторых веществ. Эти вещества в реакциях не расходовались, но без их добавления реакции не протекали. В 1835 году все известные на тот момент каталитические исследования обобщил шведский химик Йёнс Якоб Берцелиус (1779 – 1848), он же первым использовал термин «катализ» (от греч. katalysis – разрушение). Однако, механизм влияния этих добавок был непонятен химикам XIX века. Только в самом конце XIX века немецкий химик Вильгельм Фридрих Оствальд (1853 – 1932) сумел дать современные определения катализа и катализатора. Появление современных теорий катализа относится к 20-м годам XX века. Первой из них была мультиплетная теория, которую разработал российский химик Алексей Александрович Баландин (1898 – 1967).
Катализаторы – это вещества, изменяющие скорость реакции, участвующие в промежуточных стадиях реакции, но при этом не расходующиеся. Изменение скорости реакции под действием катализаторов называют катализом. Известны различные виды катализа. Катализ может быть положительным – увеличивать скорость реакции, или отрицательным – уменьшать скорость реакции. Отрицательный катализ часто называют ингибированием, а отрицательные катализаторы, замедляющие течение реакции – ингибиторами. Катализ, при котором катализатор образует одну фазу с реагирующими веществами, называют гомогенным катализом. Если катализатор образует самостоятельную фазу и реакция происходит на поверхности катализатора, то катализ называется гетерогенным катализом. Хорошо известный Вам из школьного курса процесс получения оксида серы (VI) SO3 из оксида серы (IV) SO2 (2SO2 + O2 = 2SO3 + Q) можно проводить с использованием разных катализаторов.
В начале XX века этот процесс осуществляли в газовой фазе с использованием оксида азота (II) NO в качестве катализатора – это пример гомогенного катализа. Если в качестве катализатора использовать оксид ванадия (V) V2O5, который является твердым веществом, то реакция протекает на его поверхности – это пример гетерогенного катализа. Гетерогенный катализ может быть усилен добавлением промоторов – веществ, которые сами не являются катализаторами, но повышают активность катализатора данной реакции. Так, для синтеза аммиака, идущего с использование железного катализатора, используется добавление оксидов алюминия и калия. Однако, есть вещества, которые наоборот снижают активность катализатора. Такие вещества называются каталитическими ядами. Так, например, платиновый катализатор очень чувствителен по отношению к соединениям серы и селена.
Важными свойствами катализаторов является их специфичность и селективность. Под специфичностью катализатора понимается его способность ускорять только какую-то одну группу реакций и никак не влиять на скорость других реакций. Хорошо известный Вам пример: платина Pt и никель Ni являются катализаторами процессов гидрирования. Другое свойство катализаторов – селективность (избирательность) заключается в способности катализаторов ускорять только одну из возможных при данных условиях параллельных реакций. На этом свойстве катализаторов основаны способы получения разных продуктов из одних и тех же исходных веществ. Например, из этилового спирта C2H5OH в присутствии оксида алюминия Al2O3 получают этилен CH2=CH2, а в присутствии меди Cu – уксусный альдегид CH3COH. Наибольшей селективностью отличаются биологические катализаторы белковой природы – ферменты. Кроме того, ферменты обладают высокой активностью, что объясняется значительным снижением энергии активации биохимического процесса ферментами.
В чем же заключается действие катализатора? Оказывается, катализаторы снижают энергию активации реакции, в результате чего увеличивается число частиц, обладающих энергией, достаточной для химического взаимодействия. Катализаторы участвуют в образовании активированного комплекса, требующего меньшей энергия активации.
Таким образом, превращение одних веществ в другие – это процесс, развертывающийся во времени, т. е. имеющий свою временную структуру, которая выражена механизмом реакции. Вместе с тем механизм реакции учитывает не только изменения в составе веществ-участников реакции, но и изменение положений атомов в пространстве по мере протекания реакции. Поэтому можно говорить о пространственно-временной структуре реакции. Любое превращение одних веществ в другие, т.е. химическую реакцию, можно рассматривать как качественное изменение и особую форму движения.
1. Скорость химической реакции определяется изменением количества реагирующих веществ или продуктов реакции за единицу времени в единице объёма (для гомогенных систем) или на единице поверхности (для гетерогенных систем).
2. На скорость реакции оказывают влияние: природа реагирующих веществ, их концентрация (для гомогенных систем), площадь поверхности (для гетерогенных систем), температура и наличие катализатора.
3. Количественно зависимость между скоростью реакции и концентрацией определяется основным законом химической кинетики – законом действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
4. Большинство химических реакций являются многостадийными процессам, механизм которых определяется экспериментально. Под механизмом химической реакции понимают последовательность элементарных стадий процесса, в результате которых исходные вещества превращаются в продукты реакции.
5. Многие химические реакции являются каталитическими, т.е. для их осуществления необходимы катализаторы – вещества, изменяющие скорость реакции, участвующие в промежуточных стадиях реакции, но при этом не расходующиеся.
6. Химическая реакция – имеет сложную пространственно-временную структуру, что позволяет её рассматривать не только как качественное изменение веществ, но и особую форму движения.
Примеры и разбор решения заданий тренировочного модуля:
1. Укажите верные утверждения:
Правильный ответ и пояснение
А. Химическое уравнение не отражает механизм протекания реакции.
Правильное утверждение. Химическое уравнение не отражает механизм протекания реакции, механизм реакции определяется экспериментально.
Б. Катализатор ускоряет реакцию, но сам в реакции не участвует.
Неправильное утверждение. Катализаторы – вещества, изменяющие скорость реакции, участвующие в промежуточных стадиях реакции, но при этом не расходующиеся.
В. Закон действующих масс выражает количественную зависимость скорости реакции от концентрации реагирующих веществ.
Правильное утверждение. Количественно зависимость между скоростью реакции и концентрацией определяется основным законом химической кинетики – законом действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
2. Установление соответствие между элементами двух множеств. К каждой позиции первого столбца подберите соответствующую позицию второго.
1. Процесс гидрирования этилена СН2=СН2 c использованием никеля Ni в качестве катализатора.
А. Гомогенный катализ
Б. Гетерогенный катализ
2. Процесс получения оксида серы (VI) SO3 из оксида серы (IV) SO2 с использованием оксида азота (II) NO в качестве катализатора.
3. Процесс получения оксида серы (VI) SO3 из оксида серы (IV) SO2 с использованием оксида ванадия (V) V2O5 в качестве катализатора.
Правильный ответ:1 – Б; 2 – А; 3 – Б.
1. Процесс гидрирования этилена СН2=СН2 c использованием никеля Ni в качестве катализатора.
Б. Гетерогенный катализ
2. Процесс получения оксида серы (VI) SO3 из оксида серы (IV) SO2 с использованием оксида азота (II) NO в качестве катализатора.
А. Гомогенный катализ
3. Процесс получения оксида серы (VI) SO3 из оксида серы (IV) SO2 с использованием оксида ванадия (V) V2O5 в качестве катализатора.
http://kardaeva.ru/88-dlya-uchenika/8-klass/124-sostavlenie-uravnenij-khimicheskikh-reaktsij
http://resh.edu.ru/subject/lesson/4784/conspect/