Какое уравнение используется для анализа квантовой модели атома
3.1.2 Волновое уравнение. Квантовомеханическое объяснение строения атома
Неопределенность установления положения и скорости электрона столь велика, что необходимо вообще отказаться от анализа траектории его движения. Однако есть возможность вероятностного описания строения атома.

m – масса электрона Масса покоя электрона me=9,109 . 10 -31 кг ;
E – полная энергия электрона;
x , y , z – координаты.
Решением уравнения Шредингера является волновая функция Ψ и соответствующее ей значение энергии электрона E. Вероятность нахождения электрона в пространстве характеризуется квадратом волновой функции, т.е. величиной | Ψ | 2 . Для описания строения атома можно рассматривать электрон как бы “размазанным” в пространстве в виде электронного облака. Величина | Ψ | 2 , полученная из волнового уравнения, является мерой электронной плотности в данном элементе объема, или мерой вероятности нахождения электрона в данном элементе объема атома.
Таким образом, в квантовомеханической (вероятностной) модели атома исчезает смысл орбиты, на которой находится электрон. Взамен ее мы имеем дело с электронной плотностью, “размазанной” в пространстве атома. Тело, образованное “размазанным” электроном, называют орбиталью . Обычно под орбиталью понимают часть пространства, заключающую 90% электронного облака.
Наличие трех измерений пространства приводит к тому, что в выражении волновой функции Ψ , являющейся решением уравнения Шредингера, появляются три величины, которые могут принимать только дискретные целочисленные значения – три квантовых числа. Они обозначаются символами n , l и ml . Эти квантовые числа характеризуют состояние электрона не только в атоме водорода, но и в любом другом атоме.
а) Главное квантовое число ( n ) определяет средний радиус электронного облака, или общую энергию электрона на данном уровне. Оно принимает натуральные значения от 1 до ∞ . В реальных атомах n имеет 7 значений, обозначаемых латинскими буквами K, L, M, N, O, P, Q. Значение n=1 отвечает уровню с самой низкой энергией (т.е. наиболее устойчивому состоянию электрона). Теоретически количество уровней не ограничено, но в атоме главным образом бывают заняты электронами уровни с низкой энергией.
б) Побочное, или орбитальное, квантовое число ( l ). В спектрах многоэлектронных атомов наблюдается мультиплетная структура линий, т.е. линии расщеплены на несколько компонент. Мультиплетность линий означает, что энергетические уровни представляют собой совокупности энергетических подуровней, т.к. любой линии в спектре отвечает переход электрона из одного состояния в другое. Энергетические различия в состоянии электронов в данном уровне связаны с различием в форме электронных облаков.
Для характеристики энергетических подуровней используется орбитальное квантовое число l . Оно может принимать в пределах каждого уровня целочисленные значения от 0 до n –1. Таким образом, уровень в зависимости от l подразделяется на подуровни, которые имеют также буквенные обозначения: s ( l=0), p ( l=1), d ( l=2), f ( l=3). Электроны, находящиеся в этих состояниях, называются s -, p -, d — и f-электронами.
Форма s-электронного облака . Это облако обладает сферической симметрией, т.е. имеет форму шара. График волновой функции Ψ расположен по одну сторону от оси абсцисс (рисунок 3.1), т.е. волновая функция s-электрона положительна.
Рисунок 3.1 – График волновой функции s-электрона в зависимости от расстояния до ядра. Форма s-орбитали
Форма p-электронного облака . Для p-электрона при удалении от ядра по некоторому направлению волновая функция имеет перегиб (рисунок 3.2). По одну сторону от ядра Ψ положительна , а по другую – отрицательна (не путать знак волновой функции со знаком электрического заряда!). В начале координат Ψ обращается в нуль. В отличие от s-орбитали , p-орбиталь не обладает сферической симметрией, а имеет форму, напоминающую гантель (рисунок 3.2).
Рисунок 3.2 – График волновой функции p-электрона. Форма p-электронного облака
Знаки “+” и “–” от носятся не к вероятности нахождения электрона (она всегда положительна и равна | Ψ | 2 ), а к волновой функции, которая в разных частях электронного облака имеет различный знак.
Еще более сложную форму имеют электронные облака d — и f-электронов. Например, d-орбитали могут иметь четырехлепестковое строение, причем знаки волновой функции в “лепестках” чередуются:
в) Магнитное квантовое число ( ml ). Если атом поместить во внешнее магнитное поле, то происходит дальнейшее расщепление спектральных линий. Это означает, что при данных значениях n и l может существовать несколько состояний электрона с одинаковой энергией. Такие энергетические состояния называются вырожденными. Вырождение исчезает при воздействии на атом внешнего магнитного поля, что и приводит к появлению новых линий в спектре.
Энергетические изменения под действием магнитного поля объясняются различием в характере расположения электронных облаков в пространстве и, следовательно, их различной ориентацией по отношению к силовым линиям поля. Магнитное квантовое число ml для данного подуровня – это целочисленная величина в диапазоне от – l до + l . Таким образом, при данном l оно имеет (2 l+1) различных значений. Например, для s-подуровня ( l=0) имеется только одно значение ml , равное нулю. Поэтому s-подуровень содержит единственную орбиталь . Для p-подуровня ( l=1) возможны три значения: ml ∈ <–1,0,1>. В соответствии с этим каждый p-подуровень состоит из трех орбиталей гантелеобразной формы, ориентированных перпендикулярно друг другу вдоль трех координатных осей и обозначаемых px , py , pz . Легко определить, что на d-подуровне ( l=2) содержится 2 l+1=5 орбиталей , а на f-подуровне ( l=3) – 7 орбиталей .
На рисунке 3.3 показано постепенное усложнение представлений о структуре электронной оболочки атома (от уровней к подуровням и далее к орбиталям ).
Рисунок 3.3 – Эволюция представлений о строении электронной оболочки атома. Энергетическая диаграмма уровней с 1-го по 3-й
г) Спиновое квантовое число ( ms ) не связано с движением электрона вокруг ядра, а определяет его собственное состояние. Природа этого состояния неизвестна до сих пор. Предполагается, что она связана с вращением электрона вокруг собственной оси «Spin» в переводе с английского — «кружение», «верчение». . Число ms принимает два значения: +1/2 и –1/2.
Для определения состояния электрона в многоэлектронном атоме важное значение имеет принцип Паули, согласно которому в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми. Следовательно, каждая орбиталь , характеризующаяся определенными значениями n , l и ml , может быть занята не более чем двумя электронами, спины которых имеют противоположные знаки. Такие электроны называются спаренными.
Пользуясь принципом Паули, можно подсчитать, какое максимальное число электронов может находиться на каждом подуровне, т.е. определить емкость подуровней:
Здесь электроны на орбиталях изображены стрелками, направленными вверх или вниз в зависимости от знака спинового квантового числа.
Квантовая теория атома
Квантовая теория построения атома – это одно из важных достижений в механике квантов. Многочисленные опыты подтвердили, что атом состоит из тяжелого, заряженного позитивно, ядра и легких, отрицательно заряженных, электронов, которые колеблются. Данные электроны принимают непосредственное участие в формировании оболочек атома.
Суть квантовой теории атома Томсона
Теория строения атома Томсона, которую ученый предложил в 1903 году, исторически считается классической моделью. В соответствии с этой моделью, атом является шаром, с положительно заряженным центром, внутри которого колеблются электроны.
В сумме заряд всех отрицательно заряженных электронов равняется положительному заряду ядра, то есть в итоге атом заряжен нейтрально. Приблизительно величина ядра, определяемая по законам классической электростатики, соответствовала истинным его размерам.
Для напряженности электрополя в середине атома справедливо выражение:
где \(e\) – положительный заряд ядра.
«Квазиупругая» сила воздействия на электрон рассчитывается по формуле:
Ядерная модель атома Резерфорда
В 1911 году в своих опытах, ученый Э. Резерфорд доказал несовершенство модели Томсона. Данные опыты проводились с альфа-частицами, которые рассеивались при проникновении сквозь барьер из тонкой металлической фольги. Альфа-частицы – это частицы с массой ma и позитивным зарядом \(qa+2qe\) , которые образуются во время радиоактивного распада тяжелых элементов.
Эксперименты Резерфорда показали, что наряду с множеством альфа-частиц, которые незначительно отклоняются от оси при проникновении сквозь тонкую фольгу, наблюдается часть таких частиц, которые сильно отклоняются, на гораздо больший угол.
Также можно утверждать, что данное явление не вызвано влиянием электронов на альфа-частицы, так как масса электронов намного меньше массы альфа-частиц. То есть, данное сильное отклонение вызвано действием атомных ядер на альфа-частицы. Резерфорд теоретически работал над задачей рассеивания альфа-частиц в кулоновском поле, которое создается положительным зарядом атомного ядра.
Не нашли что искали?
Просто напиши и мы поможем
Структура ядерной модели Резерфорда была похожа на Солнечную систему с массивным ядром по центру, и вращающимися по своим орбитам вокруг него планетами. Потому данная модель получила название планетарная.
Резерфорд понимал, что статическая модель атома не может существовать, что помогло ему прийти к определению модели с вращающимися электронами. В соответствии с теоремой Ирншоу для классической электростатики, система неподвижных электрических зарядов, которые расположены на фиксированных расстояниях друг от друга, не может сохранять равновесие лишь под действием кулоновских сил. Также данная модель вызывает необходимость постоянного электромагнитного излучения атомами.
Теория атомного строения Бора
Модель Резерфорда определенно противоречила понятиям классической физики. По принципам классической электродинамики, вращающийся по орбите электрон излучает электромагнитные волны, а соответственно, должен терять энергию и в итоге упасть на ядро, но в реальности такое не происходит.
Данное противоречие пытался разрешить ученый Бор, выдвинув теорию строения простейших атомов водорода и одноэлектронных ионов. Он предположил, что существуют некоторые стационарные орбиты, перемещаясь по которым электроны не поглощают и не излучают энергию. Причем каждой такой орбите будет соответствовать определенная величина энергии движения электрона \(E_n\) . Совокупность таких разрешенных величин энергии создает энергетический спектр атома электрона.
Сложно разобраться самому?
Попробуй обратиться за помощью к преподавателям
Важнейшим принципом теории Бора служит квантованность энергии и момента импульса. В классической механике данные величины при вращении тела вокруг своей оси могут изменяться и принимать любые значения от нуля и до бесконечно больших величин, а в квантовой механике они принимают лишь «разрешенные» значения, соответствующие движению по конкретной орбите.
Не нашли нужную информацию?
Закажите подходящий материал на нашем сервисе. Разместите задание – система его автоматически разошлет в течение 59 секунд. Выберите подходящего эксперта, и он избавит вас от хлопот с учёбой.
Гарантия низких цен
Все работы выполняются без посредников, поэтому цены вас приятно удивят.
Доработки и консультации включены в стоимость
В рамках задания они бесплатны и выполняются в оговоренные сроки.
Вернем деньги за невыполненное задание
Если эксперт не справился – гарантируем 100% возврат средств.
Тех.поддержка 7 дней в неделю
Наши менеджеры работают в выходные и праздники, чтобы оперативно отвечать на ваши вопросы.
Тысячи проверенных экспертов
Мы отбираем только надёжных исполнителей – профессионалов в своей области. Все они имеют высшее образование с оценками в дипломе «хорошо» и «отлично».
Гарантия возврата денег
Эксперт получил деньги, а работу не выполнил?
Только не у нас!
Деньги хранятся на вашем балансе во время работы над заданием и гарантийного срока
Гарантия возврата денег
В случае, если что-то пойдет не так, мы гарантируем возврат полной уплаченой суммы
Отзывы студентов о нашей работе




























«Всё сдал!» — безопасный онлайн-сервис с проверенными экспертами
Используя «Всё сдал!», вы принимаете пользовательское соглашение
и политику обработки персональных данных
Сайт работает по московскому времени:
Принимаем к оплате 


Квантово-механическая модель атома и его строение
Планетарная квантово-механическая модель атома Бора часто запоминается за счет аккуратной и знакомой картины электронов. Они вращаются вокруг центрального ядра, подобно планетам вокруг Солнца. Из-за этого может быть сложно заменить картину той, которая более точно представляет квантово-механическую модель атома, используемую современными физиками.
Как располагается и движется атом?
Атом обладает крошечным ядром и волнами острых орбит. Расположение и движение электронов описывается волнами их материи. Эти структуры предсказывают вероятность нахождения электрона в данной области атома. Но откуда появилась квантово механическая модель атома Бора?
Планетарная модель положила начало процессу введения квантовой теории в структуру атома. Бор ввел идею стационарных состояний, в которых атом был устойчив. Переходы между этими состояниями объясняли существование спектральных линий. В случае водорода он смог получить энергетические уровни:
- Переходы между его энергетическими уровнями соответствовали линиям в водородном спектре.
- Его модель не могла предсказать уровни энергии для любых других атомов (хотя уровни водородоподобных щелочных металлов можно было бы приблизить к истине).
Отдельно проводились работы Гейзенберга и Шредингера, чтобы придумать способы более полного описания квантованных энергетических уровней атомов.
Аналогии Гейзенберга и Шредингера: как они привели уравнение к доказательству волны
Квантово-механическая модель строения атома обладает уникальным набором свойств. Гейзенберг использовал матрицы, а Шредингер разработал волновое уравнение, чтобы доказать абсолютность разницы в поведении кванта. Детальнее двоякость частицы показана на видео.
Уравнения Шредингера обеспечивают представление плотности картины вероятности электронов вокруг ядра атома. Большинство определений квантовой теории и квантовой механики предлагают одинаковое описание для обоих. Они по существу описывают квантовую теорию, в которой и энергия, и материя имеют характеристики волн в одних условиях и характеристики частиц — в других.
Чтобы идея была понятней, люди стали проводить эксперименты в условиях мысленного посыла.
- Квантовая теория предполагает, что энергия приходит в дискретных пакетах, называемых квантами (или — в случае электромагнитного излучения — фотонами).
- Квантовая теория имеет некоторое математическое развитие, часто называемое квантовой механикой, которая предлагает объяснения поведения электронов внутри электронных облаков атомов.
Основные положения квантово механической модели строения атома — это двойственность волн электронов в электронном облаке, которая ограничивает нашу способность одновременно измерять энергию и положение электрона.
Скрытые особенности электронов
Чем точнее мы измеряем энергию или положение электрона, тем меньше мы знаем о другом. Мы не можем точно отметить одновременно положение и импульс электрона. Это приводит к невозможности предсказать траекторию для частицы. Следовательно, поведение электрона описывается иначе, чем поведение частиц нормального размера. Необходимо знать:
- Наиболее распространенным способом описания электронов в атомах в соответствии с квантовой механикой является решение уравнения Шредингера для энергетических состояний электронов этом облаке.
- Когда электрон находится в этих состояниях, его энергия четко определена, а положение — нет.
- Положение описывается картой распределения вероятностей, называемой орбитальной.
Траектория, которую мы обычно связываем с макроскопическими объектами, заменяется электронами в облаках электронов, причем в статистических описаниях указывается не путь, а область, в которой он найден. Поскольку именно электрон в облаке электронов атома определяет его химическое поведение, для понимания химии необходимо описание конфигурации электронов в ключе квантово-механической модели атома.
Принцип неопределенности Гейзенберга: область внутри атома
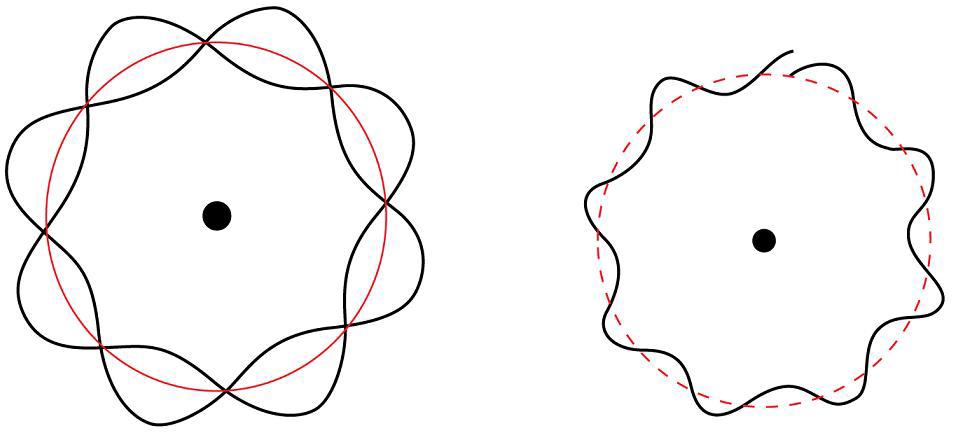
Луи де Бройль предложил, чтобы все частицы можно было рассматривать, как материальные волны с длиной волны — лямбда, определяемая следующим уравнением:
Лямбда = фактическое время (час) + милливольтчас
Эрвин Шредингер предложил квантово-механическую модель атома. Кратко: она рассматривает электроны, как волны вещества.
Квадрат волновой функции представляет вероятность нахождения электрона в данной области внутри атома. Атомная орбита определяется, как область внутри атома, которая находится там, где электрон.
Принцип неопределенности Гейзенберга гласит, что мы не можем знать ни энергию, ни положение электрона. Поэтому, когда мы больше узнаем о положении электрона, мы меньше знаем о его энергии, и наоборот. Электроны имеют внутреннее свойство, называемое спином. Любые два электрона, занимающие одну и ту же орбиту, должны иметь противоположные спины.
Светоносный эфир в квантовом мире
Природа света была предметом исследования с древности. В семнадцатом веке Исаак Ньютон провел эксперименты с линзами и призмами. Он смог продемонстрировать, что белый свет состоит из отдельных цветов радуги, объединенных вместе. Ньютон объяснил результаты своей оптики «корпускулярным» взглядом на свет, в котором свет состоял из потоков чрезвычайно мелких частиц, движущихся на высоких скоростях в соответствии с законами движения Ньютона. Стоит заметить:
Кристиан Гюйгенс показал, что оптические явления такие, как отражение и преломление, могут быть одинаково хорошо объяснены с точки зрения света как волны, движущиеся с высокой скоростью через среду, называемую «светоносный эфир». Она пронизывает все пространство.
В начале девятнадцатого века Томас Янг продемонстрировал, что свет, проходящий через узкие, близко расположенные щели, создает интерференционные картины, которые не могут быть объяснены с точки зрения ньютоновских частиц, но могут быть легко растолкованы с точки зрения волн.
Сегодня эти области называют классической механикой и классической электродинамикой (или классическим электромагнетизмом).
Как прогрессировала идея о внедрении новых понятий в физике
К концу девятнадцатого века ученые рассматривали физическую вселенную как приблизительно состоящую из двух отдельных областей:
- материи, сформированной из частиц, движущихся согласно законам движения Ньютона;
- электромагнитного излучения, состоящего из волн, управляемых уравнениями Максвелла.
Парадоксы привели к современной структуре квантово-механической модели атома Шредингера, которая тесно связывает частицы и волны на фундаментальном уровне, называемом дуальностью волны-частицы, которая заменила классический взгляд.
Дискретная волна Бора: как ведут себя спектры излучения водорода
Согласно модели Бора, спектры излучения различных элементов содержат дискретные линии. Представить видимую область спектров излучения водорода можно при помощи таблицы.
| Основное квантовое число | Количество подуровней | Количество электронов |
| 1 | 1 | 2 |
| 2 | 2 | 8 |
| 3 | 3 | 18 |
| 4 | 4 | 32 |
Это схематическое представление квантов, где известно число электронов и уровней. В жизни в условиях вакуума точно нельзя сказать ограничение по подуровням, но их не может быть больше 7. Квантованные спектры излучения указывали Бору, что электроны могут существовать внутри атома только при определенных атомных радиусах и энергиях.
Построив модель, Бор вывел уравнение, которое правильно предсказывало различные уровни энергии в атоме водорода. Квантовая механическая модель подходила только для представления этого конкретного случая. Уровни соответствовали линиям излучения в спектре вещества.
Модель Бора, которая доказала одноэлектронные системы водорода
Скорость электрона на уровне энергии основного состояния водорода составляет 2,2×10 6 s÷m, где s — длина, m — масса. Мы можем подставить постоянную, а также массу и скорость электрона в уравнение де Бройля. Но при этом он не смог объяснить электронную структуру в атомах, которые содержали более одного электрона.
Если обратиться к химии, квантово-механическая модель атома водорода должна состоять только из протонов. При встрече с электронами или нейтронами частица начинает себя вести, как волна. В остальных случаях атомы другого вещества могут независимо от структуры вести себя подобно волнам или частицам. Если сказать кратко, квантово-механическая модель атома водорода представляет собой материальный дуализм волны, но не частицы.
Наложение волн одну на другую: как не смешиваются пути пересечения атомов
Радиоволны от мобильного телефона, рентгеновские снимки, используемые стоматологами, энергия, используемая для приготовления пищи в вашей микроволновой печи, лучистое тепло от раскаленных предметов и свет от экрана телевизора — все это формы электромагнитного излучения, которые проявляют волнообразное поведение. Необходимо запомнить:
- Волна — это колебание или периодическое движение, которое может переносить энергию из одной точки пространства в другую.
- Встряхивание конца веревки передает энергию от вашей руки к другому концу веревки; падение гальки в пруд приводит к волнам, распространяющимся вдоль поверхности воды; расширение воздуха, сопровождающее удар молнии, генерирует звуковые волны (гром), которые могут путешествовать наружу на несколько миль.
- В каждом из этих случаев кинетическая энергия передается через вещество (веревку, воду или воздух), в то время как вещество остается на месте.
Волны не должны быть ограничены, чтобы путешествовать сквозь материю. Как показал Максвелл, электромагнитные волны состоят из электрического поля, колеблющегося в такт с перпендикулярным магнитным полем. Они перпендикулярны направлению движения. Эти волны могут проходить через вакуум с постоянной скоростью 2,998 × 108 м/с, где с — скорость света.
http://spravochnikvs.com/kvantovaya_teoriya_atoma
http://www.syl.ru/article/450064/kvantovo-mehanicheskaya-model-atoma-i-ego-stroenie