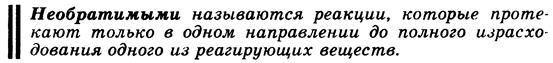Какое уравнение называют уравнением изобары химической реакции
Большинство химических реакций протекают одновременно в двух направлениях: в сторону образования продуктов реакции (прямая реакция) и в сторону разложения последних (обратная реакция). Вследствие химической обратимости реакции не доходят до конца. Скорость прямой реакции уменьшается, а скорость обратной, напротив, возрастает. Когда эти скорости выравниваются наступает состояние химического равновесия.
Так как химически обратимые реакции до перехода в равновесное состояние протекают с конечными скоростями, то с точки зрения термодинамики они не обратимы. Однако можно мысленно представить, что эти реакции идут бесконечно медленно через смежные равновесные состояния. Тогда к ним можно применить общие условия термодинамического равновесия.
Для гомогенных обратимых реакций экспериментально Гульбергом и Ваге был установлен закон действующих масс. При постоянной температуре отношение произведения равновесных концентраций (или парциальных давлений) продуктов реакции к произведению равновесных концентраций (или парциальных равновесий) исходных веществ есть величина постоянная.
Этот экспериментально установленный закон может быть получен методом термодинамических потенциалов. Рассмотрим реакцию в газовой фазе:
аА(г) + b В ↔ сС + dD
Когда система достигает термодинамического равновесия, то термодинамический потенциал при фиксированных естественных переменных достигает минимума. Равновесие, таким образом, можно охарактеризовать выражением химических потенциалов, когда потенциалы продуктов реакции сравняются с потенциалами исходных веществ:
с μ ( с ) + d μ (D) – a μ (a) — b μ (b) = 0 (6 – 1)
Если естественными переменными являются p и T , то 


Отсюда для систем, подчиняющихся закону идеальных газов, можно получить выражения для μ i
μ i = μ i ° + RTlnCi (6 – 2) 
где μ i ° — стандартный химический потенциал.
Подставляется (6 – 2) в (6 – 1) и перенося постоянные величины в левую часть, получаем
сμ C ° + d μ D ° — a μ A ° — b μ B ° = — RTln 

Поскольку в левой части выражение не зависит от концентраций, то выражение под логарифмом является постоянной величиной при постоянной температуре:

Для идеального газа парциальные давления пропорциональны концентрациям, поэтому константа равновесия может быть всегда выражена через равновесные парциальные давления:
Аналогично может быть записано выражение через мольные доли:
Для идеальных газов эти константы связаны между собой соотношением:
где
Следует обратить внимание, что в полученных соотношениях только KN зависит от общего давления. Она позволяет нам оценивать сдвиг равновесия в газовых реакциях при изменении общего давления. Следует иметь в виду, что давление в этих выражениях складывается из парциальных давлений компонентов системы и не учитывает влияние инертных газов, если они присутствуют в реакционной смеси. Естественно инертный газ «разбавляет» компоненты реакционной смеси и поэтому влияет на KN .
Из уравнения (6 – 3) вытекает связь константы равновесия с ∆ rG °:

Это уравнение было впервые получено Вант – Гофором методом циклов и получило название уравнения изотермической химической реакции. Очевидно, в этом уравнении ∆ rGT ° относится к этой температуре, при которой определена Кр. Уравнение изотермической химической реакции позволяет определить константу равновесия при заданных условиях не прибегая к исследованию равновесия. Величина ∆ rGT ° может быть рассчитана на основе термических констант для индивидуальных веществ.
Если заданы концентрации (парциальные давления) отличные от равновесных, то можно записать более общий вид уравнения изотермической химической реакции:
Это выражение позволяет определить направление самопроизвольного процесса.
Уравнение изотермы химической реакции позволяет получить выражение для температурной зависимости константы равновесия.
Запишем уравнение Гиббса – Гельмгольца:
Подставим выражение для 

Дифференцируем уравнение (6 – 5)


Из уравнения (6 — 5´) получаем уравнение изобары химической реакции:

Если проинтегрировать уравнение (6 – 6) в предположении, что ∆ rHT ° не зависит от температуры, то получим уравнение:
где С – константа интегрирования.
Уравнение (6 – 7) хорошо выполняется в узких интервалах температур и позволяет определить ∆ rGT °.
Для широких интервалов температур ln K р представляют в виде степенных рядов или других аналитических формах:
Такие выражения позволяют рассчитать все термодинамические функции для процессов, для которых данные зависимости получены.
Выражения для термодинамических потенциалов, полученные для идеального газа. Для реальных газов, а особенно для газовых растворов возникают затруднения. Это связано с тем, что расчет концентраций и давлений должен быть проведен исходя из уравнения состояния. Однако для реальных систем единое достаточно простое уравнение состояния получить не удалось.
В связи с этим в термодинамике реальных систем применяется эмпирический метод, предложенный Льюисом. Льюис предложил в уравнениях термодинамики, полученных для идеальных систем заменить давления p на величину летучести f , а концентрации С на активности a .
При такой замене выражения для констант равновесия не меняются по форме. Но этот прием позволяет связать экспериментально найденные свойства реального газа с термодинамическими параметрами.
Летучести и активности – это экспериментальные величины, которые находятся из условия, что для раствора при бесконечном разбавлении или газа при давлении стремящимся к 0 активность приближается к аналитической концентрации, а летучесть к реальному давлению идеального газа. Исходя из этой посылки рассчитываются активности и летучести.
При 1273 К и общем равновесии 30 атм. В равновесной системе




В соответствии с законом Авогадро, объёмный процент равен мольному проценту. Следовательно, 
Отсюда находим
В отличие от 




Для 25% 
Следовательно,
При 2000°С и общем давлении 1 атм. 2% воды диссоцииовано на водород и кислород. Рассчитайте константу равновесия реакции 
Уравнение изобары химической реакции
Термодинамические условия равновесия. Стандартная энергия Гиббса образования вещества, стандартная энергия Гиббса биологического окисления вещества. Стандартная энергия Гиббса реакции. Примеры экзергонических и эндергонических процессов, протекающих в организме. Принцип энергетического сопряжения.

Под стандартной энергией Гиббса биологического окисления ΔG°, понимают изменение энергии Гиббса при реакции биологического окисления 1 моль вещества, находящегося в стандартном состоянии
Под стандартной энергией Гиббса образования ΔG°, понимают изменение энергии Гиббса при реакции образования 1 моль вещества, находящегося в стандартном состоянии
Химическое равновесие. Обратимые и необратимые по направлению реакции. Термодинамические условия равновесия в изолированных и закрытых системах. Константа химического равновесия.
Обратимые по направлению химические реакции – реакции, которые при данных внешних условиях могут самопроизвольно протекать как в прямом, так и в обратном направлениях
Константа химического равновесия – для обратимой реакции общего вида aA + bB ó pP + qQ при постоянных внешних условиях в равновесии отношение произведений концентраций продуктов к произведению концентрации реагентов есть величина постоянная, не зависящая от химического состава системы
Kc = [A] a [B] b = const при p, T = const
Уравнение изотермы химической реакции:
Уравнение изобары химической реакции
Прогнозирование смещения химического равновесия. С помощью уравнения изотермы можно рассчитать G реакции при заданном значении Πc, если известна Kc реакции. И наоборот, если известна G реакции при заданном Πc, то можно рассчитать Kc.
Гомеостаз — относительное динамическое постоянство внутренней среды (крови, лимфы, тканевой жидкости) и устойчивость основных физиологических функций (кровообращения, дыхания, терморегуляции, обмена веществ и т.д.) организма человека и животных. Регуляторные механизмы, поддерживающие физиологическое состояние или свойства клеток, органов и систем целостного организма на оптимальном уровне, называются гомеостатическими.
Учение о гомеостазе — это учение о жизненных процессах, имеющих только одну цель: поддержание постоянства условий жизни во внутренней среде, как необходимый элемент свободной и независимой жизни.
Основная функция буферных систем предотвращение значительных сдвигов рН путём взаимодействия буфера как с кислотой, так и с основанием. Действие буферных систем в организме направлено преимущественно на нейтрализацию образующихся кислот.
В организме одновременно существует несколько различных буферных систем. В функциональном плане их можно разделить на бикарбонатную и небикарбонатную. Небикарбонатная буферная система включает гемоглобин, различные белки и фосфаты. Она наиболее активно действует в крови и внутри клеток.
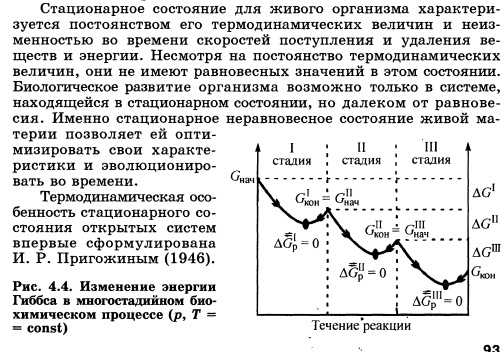
Организм можно определить как физико-химическую систему, существующую в окружающей среде в стационарном состоянии. Именно эта способность живых систем сохранять стационарное состояние в условиях непрерывно меняющейся среды и обусловливает их выживание. Для обеспечения стационарного состояния у всех организмов — от морфологически самых простых до наиболее сложных — выработались разнообразные анатомические, физиологические и поведенческие приспособления, служащие одной цели — сохранению постоянства внутренней среды.
Организм взрослого человека характеризуется относительным постоянством многих параметров, в том числе и биохимических показателей, представляющих собой определенные концентрации биологически активных веществ. Однако такое состояние нельзя назвать равновесием, так как оно не приложимо к открытым системам.
Организм человека, как живая система, постоянно обменивается с окружающей средой различными веществами: потребляет питательные вещества и выделяет продукты их окисления и распада. Следовательно, для организма характерно стационарное состояние, определяемое как постоянство параметров при постоянной скорости обмена системы с окружающей средой веществом и энергией. В первом приближении стационарное состояние можно рассматривать как ряд родственных состояний, связанных между собой процессами релаксации.
Для поддержания стационарного состояния организму взрослого человека требуется поступление извне около 3000 ккал в сутки. Рациональное питание предусматривает сбалансированное питание при соотношении белков, жиров и углеводов по массе 1:1:4.
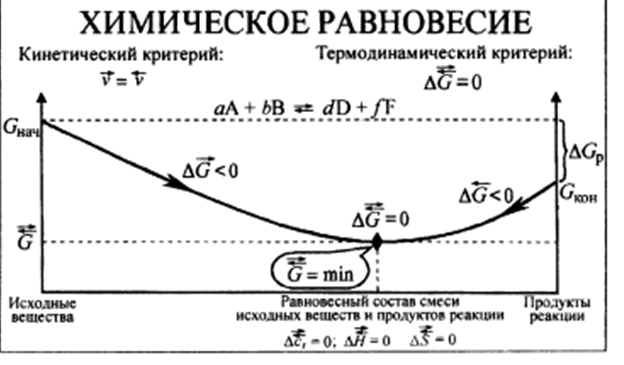
Химическое равновесие
Абстрагируя (а именно, игнорируя флуктуации), в термодинамике считают, что тело находится в равновесном состоянии, если все характеризующие его признаки (без влияния извне каких-либо процессов) во всех участках тела будут оставаться неизменными сколь угодно долго.
Химическое равновесие — это особая разновидность состояния химической реакционной системы. Оно характеризуется таким составом системы, который обеспечивает протекание обратимых реакций между составляющими систему веществами, а также неизменность во времени параметров состояния системы и вследствие этого — максимальную устойчивость системы.
Химическое равновесие обладает подвижностью и способно самопроизвольно восстанавливаться после небольших отклонений от состояния равновесия. Естественно, что состав реакционной равновесной системы постоянен до тех пор, пока сохраняются условия его существования.
Рассматривать химическое равновесие можно с двух позиций: с кинетической и термодинамической. Это непосредственно вытекает из того, что любую химическую реакцию можно описывать как с позиций кинетики, так и с позиций термодинамики.
4.1. ПРИРОДА ХИМИЧЕСКОГО
Кинетический (динамический) характер химического равновесия
Из кинетики известно, что химические реакции одновременно с разными конечными скоростями протекают в двух направлениях — в сторону образования продуктов реакции (прямая реакция) и в обратном направлении (обратная реакция). Вследствие этого явления, называемого химической обратимостью, реакция никогда до конца не доходит. В тот момент, когда скорости прямого и обратного процессов сравниваются, наступает химическое равновесие. Хорошо демонстрирует кинетический (динамический) характер химического равновесия вывод константы равновесия на основе применения закона действующих масс. В соответствии с этим законом для простой реакции можно записать:


Поскольку условием равновесия является равенство v1 = v2, то, приравнивая правые части уравнений (4.2) и (4.3), имеем

Здесь Кс — константа равновесия, постоянная величина, характеризующая реакцию (4.1). Подстрочный индекс с в обозначении константы равновесия указывает, что эта константа является концентрационной и определена через концентрации веществ. Если воспользоваться соотношением концентрации и активности вещества (типа а=ус) и определить константу через активности веществ, тогда выражение для нее примет вид 
Физический смысл константы равновесия можно связать с тем, что она показывает, во сколько раз константа скорости прямой реакции больше константы скорости обратной реакции (см. равенство 4.4).
С учетом вытекающей из уравнения состояния идеального газа (1.3) взаимосвязи между парциальных давлений реагирующих газов и их концентраций формулу (4.4) можно представить, заменив концентрации соответствующих веществ их парциальными равновесными давлениями (

Для любой реакции диссоциации константу равновесия можно выразить через степень диссоциации a — долю (от исходного количества) продиссоциировавших молекул вещества. Для соединения вида МА (где М и А однозарядные катион и анион соответственно) можно записать реакцию диссоциации: МА = М+ + А-. Поэтому константа равновесия, соответствует константе диссоциации и равняется:

Если принять, что аналитическая концентрация растворенной соли МА равна сан., то с учетом того, что см= сА = a сан. , а концентрация недиссоциированных молекул растворенного вещества сМА равна (1 — a)сан. получим:

Полученная формула представляет собой известное выражение для закона разбавления Оствальда (для бинарного электролита).
Итак, в равновесном состоянии, при неизменных термодинамических условиях реакции концентрации реагирующих веществ оказываются постоянными и, как следует из закона действующих масс, соответствуют некоторому отношению констант скоростей прямой и обратной реакций.
Термодинамический характер химического равновесия
С термодинамической точки зрения любые химические реакции необратимы, поскольку до наступления равновесия они протекают с изменением энтропии и конечными скоростями. Тем не менее, можно мысленно представить, что эти реакции в обоих направлениях протекают бесконечно медленно, через равновесные состояния. Это означает, что при постоянстве концентраций и неизменных внешних условиях они термодинамически обратимы, а равновесная реакционная система должна характеризоваться общими условиями термодинамического равновесия. Эти условия для конкретной ситуации представлены в таблице 2.7. Например, если равновесная реакционная система находится при постоянных давлении и температуре, то условием равновесия для этой системы будет равенство нулю изменения энергии Гиббса, т. е. DG = 0.
Гетерогенную систему удобно характеризовать термодинамическими условиями равновесия, выраженными с помощью представлений о химическом потенциале, т. е.:
Таким образом, химическое равновесие обладает кинетическими и термодинамическими характеристиками.
Контрольное задание 13.
13.1. Представление об обратимых и необратимых реакциях в химической кинетике и в химической термодинамике:
а. взаимно соответствуют;
б. не соответствуют друг другу.
4.2. ИЗОТЕРМА ХИМИЧЕСКОЙ РЕАКЦИИ
Особенно выразительно двойственная природа химического равновесия проявляется при рассмотрении вывода изотермы химической реакции.
Рассмотрим уравнение химической реакции, записанное в общем виде (см. выражение 4.1).
Предположим, что реакция протекает в газовой фазе при постоянных температуре и давлении. Пусть реагенты имеют свойства идеального газа. В этом случае изменение энергии Гиббса при температуре Т можно выразить уравнением:
где DGº — постоянная для данной температуры величина, а также:


С учетом введенных обозначений уравнение (4.10) примет вид:

Для равновесных условий DG = 0, поэтому


Поскольку DGº и RT постоянны, то и отношение 

нетрудно найти связь между изменением энергии Гиббса и величиной Кр, которая имеет вид:
Сопоставляя уравнения (4.13) и (4.14) можно получить выражение:

С учетом (4.15) имеем:

Последнее уравнение называется уравнением изотермы химической реакции. Его часто используют для оценки направленности реакции при различных исходных составах реакционной смеси. Для этого сравнивают значения Кр и 
Величина константы равновесия зависит от способа выражения концентраций веществ, образующих равновесную систему. Используя уравнение состояния идеального газа p = сRT, нетрудно перейти к выражению изотермы химической реакции с концентрационной константой равновесия, а с учетом связи между активностью вещества и его аналитической концентрацией – к записи изотермы с термодинамической константой равновесия.
Контрольное задание 14
14.1. Можно ли утверждать, имея в виду равенство DGº = — RTln К,, что при постоянных температуре и давлении постоянными окажутся и значения равновесных давлений, которые определяют константу равновесия?
14.2. Как изменится соотношение между парциальными давлениями отдельных газов, в равновесной газовой системе при увеличении общего давления?
4.3. ИЗОБАРА ХИМИЧЕСКОЙ РЕАКЦИИ
(зависимость константы равновесия от температуры)
С изменением температуры положение равновесия химической реакции смещается. Поэтому константа равновесия является функцией температуры.
Количественно смещение химического равновесия при изменении температуры удобно проанализировать, рассматривая температурную зависимость константы химического равновесия на примере константы Кр. Для этого рассмотрим уравнение изотермы химической реакции (4.17). Отношение 

Подставим в уравнение Гиббса — Гельмгольца (2.66)
выражения для DG и 

Аналогично, рассматривая процесс при постоянных объеме и температуре, можно вывести уравнение изохоры химической реакции, которое имеет вид

Дифференциальная форма изобары для практической работы неудобна. Поэтому ее обычно представляют в интегральной форме. Для этого разделим переменные и проинтегрируем уравнение (4.19):

Чтобы проинтегрировать это уравнение, надо знать зависимость теплового эффекта от температуры. При небольшом изменении температуры можно принять, что DH постоянна. Тогда результатом интегрирования будет следующее:

С учетом того, что DGº = — RTln Кр, а также DGº = DHº- TDSº имеем

Рассматривая влияние температуры, следует помнить, что речь по-прежнему идет об изотермических реакциях. Иначе говоря, температура процесса может быть разная, но в конкретном случае процесс проходит при постоянной температуре.

Рис. 4.1. Зависимость lnKp от 1/T
Из рисунка видно, что тангенс угла наклона прямой должен быть равен — DH/R, а точка пересечения графика с осью координат дает величину В равную DS/R.
Принцип подвижного равновесия (принцип Ле — Шателье.)
Следует отметить, что уравнения изобары, а также изохоры являются частными количественными аналогами общего физико-химического правила называемого принцип подвижного равновесия (принцип Ле — Шателье).
Принцип формулируется следующим образом: если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий, определяющее состояние равновесия, то усилится то из направлений процесса, протекание которого уменьшает эффект произведенного воздействия.
В общем случае принцип подвижного равновесия связан с оценкой величины работы процесса. Если dW=0 (или dН=0 при р= const), то процесс равновесный, в противном случае идет неравновесный процесс.
Характер неравновесного процесса можно раскрыть при анализе изобары. Действительно, уравнение (4.23) показывает, что градиент логарифма константы равновесия по температуре dlnKp/dt отрицательный для экзотермических реакций, но положительный для эндотермических реакций. Отрицательный градиент означает, что константа равновесия с увеличением температуры уменьшается. Это обстоятельство, в частности, объясняет, почему равновесие смещается в случае эндотермической реакции в сторону образования продуктов, а в случае экзотермической реакции в сторону образования реагентов.
Контрольное задание 15
Выберите правильный ответ и обоснуйте его.
15.1. В случае эндотермической реакции Ст +Н2О(пар)=СО(газ)+ Н2(газ), если одновременно уменьшить общее давление и повысить температуру в реакторе равновесие сместится в сторону:
а. образования продуктов реакции;
б. образования исходных веществ;
в. для ответа приведенной информации недостаточно.
15.2. Можно ли равновесие в системе: вода, толуол и хорошо растворимое в воде вещество В описать с помощью химических потенциалов?
б. Можно, но химические потенциалы вещества В в бензоле и воде различаются.
в. Можно, химические потенциалы вещества В в обеих фазах одинаковы.
15. Известно, что константа равновесия Кр реакции синтеза метилового спирта СО + 2 Н2 ↔ СН3ОН (г)
при 298 К равна 4,13∙10-10 Па2, а тепловой эффект при 800 К равен DН(800 К) = -103,7 кДж. Рассчитайте константу равновесия реакции при 800 К.

а также lnKp(800) =-0,026 + lnKp(298) = -21,633
1. Почему химическое равновесие можно рассматривать как с позиций термодинамики, так и с позиций кинетики. Приведите кинетические и термодинамические условия химического равновесия.
2. Константа равновесия реакции H2+I2=2HI при 693 К равна 50. Будет ли происходить образование иодоводорода, если исходные концентрации H2=2 моль/л, I2-5 моль/л, HI-10 моль/л?
3. Как константа равновесия зависит от температуры? (Приведите анализ уравнения изобары).
4. Вычислите константу равновесия для реакции СO + 2Н2=С Н3OH(г) при 750 K, если при 25 oС Кр=4,1∙10-10 Па2, а DH(750) = -103,5 кДж.
5. Вычислите константу равновесия для реакции 3С2Н2(г)=С6Н6(г) протекающей при стандартных условиях, принимая, что газы идеальные.
6. При 30 oС степень диссоциации по реакции SO2Cl2= SO2 +Cl2 и общем давлении 5066,25 Па равна 0,2342. Вычислите К р (в СИ).
http://lektsii.org/14-29468.html
http://pandia.ru/text/80/315/341.php