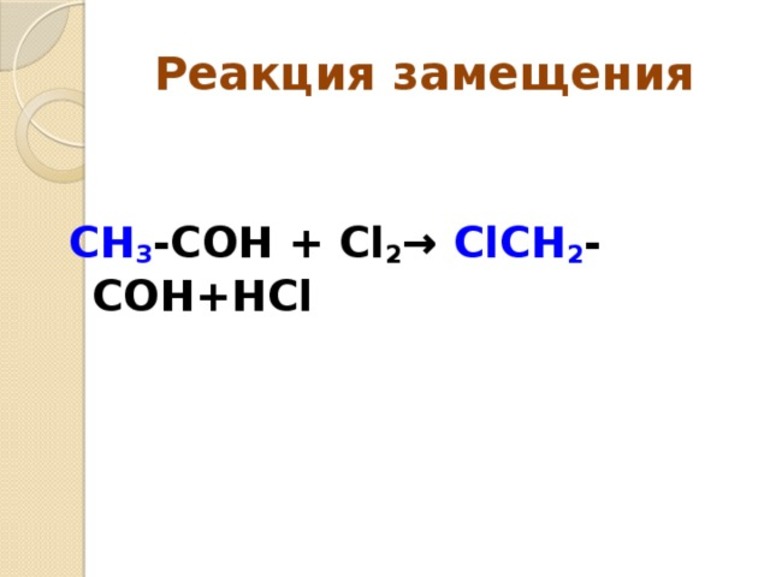
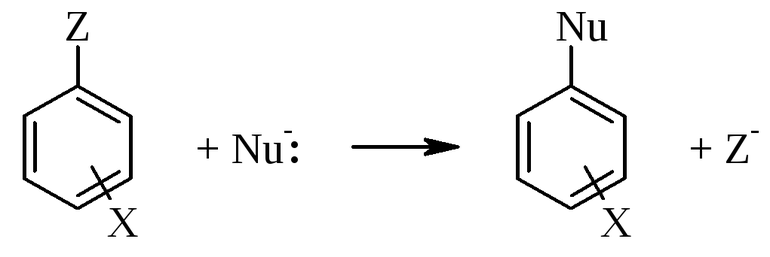Какое уравнение соответствует реакции замещения
Какое уравнение соответствует реакции разложения?
1)
2)
3)
4)
Рассмотрим каждую реакцию:
1) реакция разложения
2) реакция обмена
3) реакция замещения
4) реакция замещения
Правильный ответ указан под номером 1.
Какое уравнение соответствует реакции обмена?
1)
2)
3)
4)
Рассмотрим каждую реакцию:
1) реакция замещения
2) реакция замещения
3) реакция обмена
4) реакция соединения
Правильный ответ указан под номером 3.
Аналоги к заданию № 50: 2225 Все
Какое уравнение соответствует реакции замещения?
1)
2)
3)
4)
Рассмотрим каждую реакцию:
1) реакция обмена
2) реакция соединения
3) реакция замещения
4) реакция разложения
Правильный ответ указан под номером 3.
Аналоги к заданию № 72: 4801 Все
В реакцию разложения, сопровождающуюся изменением степени окисления, вступает
1)
2)
3)
4)
В реакцию разложения, сопровождающуюся изменением степени окисления, вступает перманганат калия:
Правильный ответ указан под номером 4.
Гидроксид магния-нерастворимое основание(осадок)и оно раскладывается под температурой на оксид мет.и воду.
Кристина, но при этом не изменяется степень окисления.
В реакцию замещения вступают между собой
1) и
2) и
3) и
4) и
Реакция замещения − это реакция простого вещества со сложным, в результате которой получаются другое простое вещество и другое сложное. Из представленных вариантов простое вещество есть только в варианте 3.
Тест по теме «Классификация химических реакций»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«Актуальность создания школьных служб примирения/медиации в образовательных организациях»
Свидетельство и скидка на обучение каждому участнику
Тема. Химические реакции. Классификация химических реакций.
Химические реакции и уравнения. 1 вариант
1. Какое уравнение соответствует реакции замещения?
1) 
3) 
2. Какое уравнение соответствует реакции соединения?
1) 
3) 
3. Какое уравнение соответствует реакции разложения?
1) 
3) 
4. В реакцию с Н2 SO 4 , сопровождающуюся изменением степени окисления, вступает
1) 


5. В реакцию замещения вступают между собой
1) 






7. Взаимодействие раствора сульфата меди(II) с гидроксидом натрия относится к реакциям
1) замещения 2) соединения 3) обмена 4) разложения
8. В реакцию разложения, протекающую с изменением степени окисления, вступает
1) 


9. Реакция, уравнение которой 
1) разложения 2) соединения 3) замещения 4) обмена
10. К химическим явлениям не относится процесс
1) плавление льда 2) горения спирта 3) брожения глюкозы 4) разложение перекиси водорода
11. В уравнении химической реакции, схема которой А l + HCl = AlCl 3 + H 2 коэффициент перед формулой вещества водород равен
1) 1 2) 2 3) 3 4) 4
12. Охарактеризовать реакцию задания 11 по классификациям (1. – по числу и составу реагирующих веществ, 2 – по направлению, 3 – по изменению степени окисления, 4 – по тепловому эффекту, 5 – по наличию катализатора, 6 – по агрегатному состоянию)
Тема. Химические реакции. Классификация химических реакций.
Химические реакции и уравнения. 2 вариант
1. Какое уравнение соответствует реакции замещения?
1) 
3) 
2. Какое уравнение соответствует реакции обмена
1) 
3) 
3. Между какими веществами происходит реакция соединения?
1) 






4. К окислительно-восстановительным реакциям относится:
1) 
3) 
5. К реакции замещения относится:
1) 
3) 
6. В реакцию разложения, протекающую без изменения степени окисления, вступает
1) 


7. Горение сероводорода 
1) окислительно-восстановительной, некаталитической, экзотермической
2) окислительно-восстановительной, каталитической, эндотермической
3) замещения, некаталитической, эндотермической
4) обмена, некаталитической, экзотермической
8. Взаимодействие алюминия с соляной кислотой относится к реакциям
1) соединения 2) обмена 3) окислительно-восстановительным 4) замещения
9. Реакция, уравнение которой 
1) разложения 2) соединения 3) замещения 4) обмена
10. К химическим явлениям не относится процесс
1) возгонки иода 2) горения спирта 3) брожения глюкозы 4) горения ацетилена
11. В уравнении химической реакции, схема которой FeSO 4 + NaOH = Fe ( OH )2 + H 2 O коэффициент перед формулой гидроксид натрия равен
1) 1 2) 2 3) 4 4) 8
12. Охарактеризовать реакцию задания 11 по классификациям (1. – по числу и составу реагирующих веществ, 2 – по направлению, 3 – по изменению степени окисления, 4 – по тепловому эффекту, 5 – по наличию катализатора, 6 – по агрегатному состоянию)
Тема. Химические реакции. Классификация химических реакций.
Химические реакции и уравнения. 3 вариант
1. К реакции замещения относится:
1) 
3) 
2. К реакции ионного обмена относится:
1) 
3) 
3. Оксид железа(III) вступает в реакцию замещения с
1) 


4. Серная кислота вступает в реакцию обмена с
1) 


5. Какое уравнение соответствует реакции соединения?
1) 
3) 
6. Какое уравнение соответствует реакции разложения?
1) 
3) 
7. Какое уравнение соответствует реакции обмена?
1) 
3) 
8. Реакция, уравнение которой 
1) замещения 2) соединения 3) разложения 4) обмена
9. Какое уравнение не относится к реакции обмена?
1) 
3) 
10. К химическим явлениям относится процесс
1) плавления парафиновой свечи 2) образования инея
3) распространения запаха духов 4) горения древесины
11. В уравнении химической реакции, схема которой А l + HCl = AlCl 3 + H 2 коэффициент перед формулой соляной кислоты равен
1) 1 2) 2 3) 6 4) 4
12. Охарактеризовать реакцию задания 11 по классификациям (1. – по числу и составу реагирующих веществ, 2 – по направлению, 3 – по изменению степени окисления, 4 – по тепловому эффекту, 5 – по наличию катализатора, 6 – по агрегатному состоянию)
Реакция замещения в химии — как определить, признаки, примеры уравнений
Общие сведения
Все вещества принято разделять на два вида. Химические тела, образованные атомами одного химического реагента, называют простыми. Например, железо, в состав которого входят молекулы, образованные атомами Fe. Тела, состоящие из атомов разных элементов, относят к сложному виду — например, серная кислота. Состоит H2SO4 из молекул, образующихся атомами водорода, серы и кислорода.
В процессе химических взаимодействий новые вещества получаются только из тех атомов, которые имелись в исходном состоянии. Для того чтобы понять, по каким признакам происходит классификация химических реакций, следует рассмотреть несколько уравнений.
Медь, взаимодействуя с кислородом, образует оксид меди два: 2Cu + O2 — 2CuO. При смешении сульфата меди и гидроксида натрия образуется синий гидроксид меди и сульфат натрия: CuSO4 + 2NaOH — Cu (OH)2 + Na2SO4. Оксид гидраргиума распадается на двухвалентный кислород и ртуть: 2HgO — 2Hg + O2. Кальций, соединяясь с углекислым газом, образует карбонат: CaO +CO2 — CaCO3. Цинк при смешении с серной кислотой вытесняется ею: Zn + H2SO4 — ZnSO4 + H2, гидроксид железа распадается на трёхвалентное железо и воду: 2Fe (OH) — Fe2O3 + 3H2O.
Таким образом, различные реакции можно объединить в группы по количеству, составу и качеству исходных веществ и продуктов. Всего их существует четыре вида:
- Соединения. Условно записывают как А + Б = АБ или АБ + ВГ = АБВГ. Под таким типом понимают взаимодействие, при которой из ряда простых или сложных реагентов образуется одно.
- Замещения. В этой реакции происходит взаимодействие двух веществ — простого и сложного. В результате части первого вещества вытесняют один из элементов сложного. Условно этот тип записывается как А + БВ — АВ + Б.
- Обмена. Это взаимодействие, происходящее между двумя сложными реагентами, которые отдают друг другу свои составные части. В итоге появляются два новых элемента. Схема записи такой реакции выглядит как АБ + ВГ — АГ + ВБ.
- Разложения. Реакция, при которой из одного исходного элемента образуется несколько менее сложных или простых веществ. Химическая схема взаимодействия выглядит как АБВГ — АБ + ВГ или АБ — А + Б.
Впервые высказал предположение о классификации реакций Д. И. Менделеев. Судить об их прохождении можно по изменению цвета, выпадению осадка, выделению газа, образованию свечения.
Механизмы взаимодействия
Протекание реакций замещения в органической химии описывают механизмами. Под ними понимают процесс детального изучения всех стадий и промежуточных веществ, а также природы взаимодействия реагентов между собой. Ими описывают характер разрыва связей и изменение энергии при переходе из начального состояния в конечное.
Механизмы замещения характеризуют по наиболее часто используемой классификации Ингольда, основоположником многих понятий органической химии. По его таблице, реакцию замещения (S) разделяют по составу частиц входящих во взаимодействия. Она бывает:
- свободнорадикальная ®;
- нуклеофильная (N);
- электрофильная (E).
Это удобная классификация, хотя они и не учитывает молекулярность соединений. Её альтернативной является разделение по Июпаку. Оно реже используется и основано на описании базовых актов создания и уничтожения связей. Предложена классификация была в 1988 году. Июпак утверждал, что использование классификации Ингольда вызывает двусмысленные ситуации, когда одно объяснение может использоваться для разного замещения, например, одностадийного ароматического замещения и двустадийной реакции алифатического атома углерода.
В его описании используются символы A и D, пишущиеся слитно при отщеплении и разделенные плюсом, если стадии происходят отдельно. Нижние индексы обозначают тип реакции. Такое описание обычно громоздкое, поэтому в учебной литературе редко когда приводится.
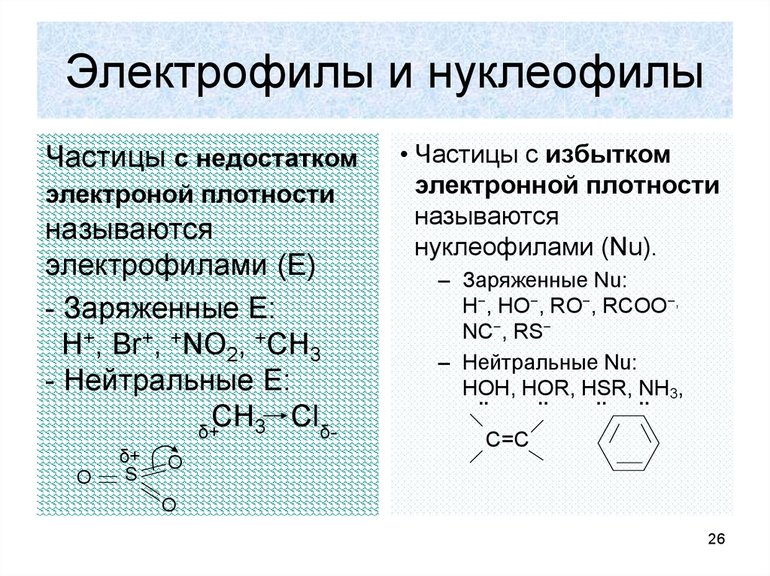
Электрофильные и нуклеофильные
Самое важное, что нужно знать об электрофильных реакциях, это то, что существует два варианта разрыва связи: монополярная и гетерополярная. В первом случае электронная пара разрушающегося соединения не разрывает связь с атомом углерода. Например, вещество, для которого характерна реакция замещения, метан: H3CH — H3C +H, то есть из предельного углеводорода образуется отрицательно заряженный карбанион, а электронная пара остаётся у атома углерода.
Карбанионы могут быть разной гибридизации sp2 и sp3. Чем больше их устойчивость, тем у них ниже способность к реакциям. Определяется она степенью делокализации заряда у атома углерода. Устойчивость уменьшается в ряду: фенил — винил — циклопропил — метил. Самая слабая у вторичного и третичного карбаниона (разделение происходит по количеству связей углерода).
Образование новой связи происходит путём обобщения освободившейся свободной пары углерода с реагентом. При этом последний должен иметь положительный заряд или секстет электронов. Элемент в этом случае является электрофильной химической частичкой. Например, к таким реакциям замещения относится взаимодействие брома с углеродом. Формула такой записи, следующая: H3C: Br+: Br- — H3CBr + Br. Электрофильные реагенты бывают:
- нейтральными молекулами с нейтральной орбиталью (AlCl3, FeBr3, SnCl4);
- катионами (SO3H+, NO2+, NO+);
- молекулами с пониженной плотностью электронов (Cl2, Br2, I2).
Нуклеофильная реакция будет протекать при разрушении углеродной связи. В этом случае электронная пара отсоединяется. Образуется углеродный ион с положительным зарядом. Формула записи будет соответствовать виду: H3C: Cl — H3C+: Cl-. Образуемый элемент носит название карбкатион. Электронная пара теряет атом углерода. Положительный заряд находится в sp2-гибридизации, то есть, меняет своё валентное состояние на более энергетически выгодное. Устойчивость карбкатионов определяется степенью делокализации. Она увеличивается в ряду метил — катион — первичный — вторичный — третичный.
При нуклеофильной реакции происходит обобщение электронной пары, которую представляет реагент. Субстрат обладает дефицитом электронов (+), а реагент (-). Например, H3C+ + K+OH- — H3COH + K+. Есть закономерность, что все гетерополярные реакции проходят легче с полярными соединениями и поляризующимися связями.
Радикальные реакции
Радикалами называют отдельные атомы или их группы с неспаренным электроном. Алкильные обозначаются латинской буквой R с рядом стоящей точкой. Свободный электрон находится на p -орбитали, находящийся на перпендикулярной плоскости С. На геометрию радикала сильное влияние оказывают заместители. Существуют такие атомы короткое время и их количество незначительно.
Затормозить свободнорадикальные реакции можно ингибиторами или инициаторами, так как они очень реакционноспособные частицы. В качестве ингибиторов выступает кислород, йод, полифенол, амин и другие соединения. Есть два способа появления радикалов:
- госмолитический разрыв ковалентной связи;
- перенос с иона или на него электрона.
Устойчивое состояние определяется делокализацией свободной частицы, пространственным и конформационным фактором. К первичным радикалам относят: метилы, этилы, пропилы и изобутилы. К вторичным — изопропилы, втор-бутилы, а к третичным — трет-бутилы. Стабилизация возрастает от первичных к третичным.
Наиболее типичным механизмом является реакция замещения хлорирования метана:
CH 4 + Cl 2 — CH3Cl + HCl.
При радикальном замещении происходит следующее:
- Инициирование цепи путём гомолитического разрыва Cl: Cl — Cl* + Cl* под действием фотолиза.
- Радикалы хлора пытаются стабилизироваться и начинают воздействовать на молекулы метана: Cl* + CH — HCl + *CH3. Хлор оттягивает на себя водород, а метан переходит в состояние метил радикала. На этой стадии происходит шквальное увеличение количества радикалов (рост цепи).
- Чтобы стабилизироваться, радикалы воздействуют на молекулы хлора, и образуется хлорметан с радикалом хлора CH3* + Cl2 — CH3Cl + Cl*.
- На конечной стадии происходит разрыв цепи, то есть радикалы встречаются и замыкаются друг на друге: 2Cl* — Cl или Cl* + CH — CH3Cl.
К более серьёзным реакциям относится взаимодействие брома с пропаном в результате термолиза: CH3CH2CH3 + Br2 — CY3CHCH3: Br + HBr. При обрыве цепи, после взаимодействия двух радикалов, образуется молекула брома. Реакция радикала с изопропилом приводит к появлению двух бром пропан, а также образованию соединение «два, три диметилбутан».
Взаимодействие с галогенами зависит от их расположения и соответствует следующему: F2 > Cl2 > Br2 > I2. С йодом реакция уже не идёт.
Типичное замещение
Различные задания на определение типа реакций начинают решать в восьмом классе. Для того чтобы решать задачи, необходимо не только правильно знать, как записать процесс, но и определить невозможный тип, а также различать вид термического процесса. Ведь протекание любой химической реакции невозможно без поглощения или выделения тепла. Такие процессы соответственно называются экзотермическими и эндотермическими.
К особенностям элементов, способных участвовать в реакции, относят:
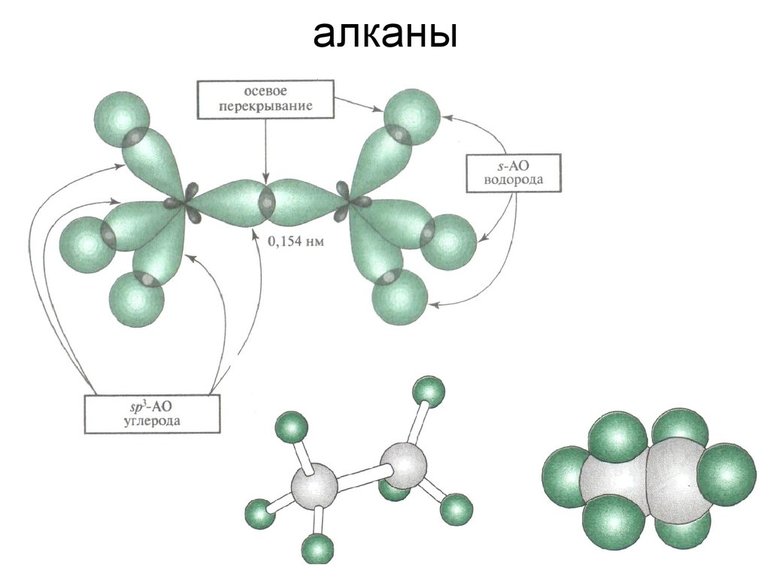
- Алканы. Соединения, состоящие из простых связей, насыщенных углеводородом: CnH2n + 2. Из-за большого количества органических соединений, состоящих из водорода и углерода реакция разложения для них неосуществима.
- Галогены. Они все являются окислителями. К ним относятся неметаллы. Наиболее яркие представители: хлор, йод, фтор, бром, астат. В процессе галогенирования водород, присутствующий в соединении, заменяется галогеном. Начиная с пропана С3Н8, алканы при радикальном замещении образуют изомеры. При термическом галогенировании процесс определяется числом C — H — связей и зависит от скорости, с которой галогены заменят водород.
- Алкены. Выделяются они присутствием в молекулах одной двойной связи. Именно она отвечает за их химические свойства. Реакция замещения свойственна элементам с двойными и тройными связями. К ней относят гидрирование H2C = CH2 + H2 — H3C, гидрогалогенирование H2C = CH2 + HBr — H3C — CH2Br, гидратацию H2C = CH2 + H20 — H3C — CH2OH. При этом есть три механизма разрыва: образование свободного радикала, иона, присоединение водорода к более гидрированному атому углерода (реакция полимеризации).
Все эти элементы могут вступать в реакцию с образованием простого или сложного нового вещества. Во время процесса образуются новые соединения. Это происходит до тех пор, пока не иссякнут все свободные радикалы.
Примеры и онлайн-решения
Реакции замещения в своём большинстве являются окислительно-восстановительными. Примеры процессов, в которых не наблюдается изменение степени окисления, немногочисленны.
Из распространённых реакций, можно привести следующие:
- Cu+Hg (NO3)2 — Hg+Cu (NO3)2.
- Fe+CuSO4 — Cu+FeSO4.
- ZnO + SO3 — ZnSO4.
- 2KBr+ Cl2 — 2KCl+ Br2.
- Ba + 2HCl — BaCl2 + H2.
- C2H6 + Cl2 — CH3CH2CL + HCL.
- CH3CH2Cl + KOH — CH3CH2OH + KCl.
- NаНСО3 + НСl = NаСl + Н2О + СО2
- Fe+ 2HCl — FeCl2+ H2.
- СrСl 3 + ЗNаОН — Сr (ОН) 3 + ЗNаСl.
Для проверки своих знаний существуют интернет-сервисы, позволяющие быстро решить любое химическое уравнение онлайн, например, chemequations.com. Пользоваться им сможет любой, даже тот, кто не умеет правильно указать обозначения химических элементов. Для работы с сайтом необходимо написать части соединения (система будет сама предлагать правильное их обозначение) и нажать «Поиск». Правильное решение будет рассчитано автоматически.
http://infourok.ru/test-po-teme-klassifikaciya-himicheskih-reakcij-5742621.html
http://nauka.club/khimiya/reaktsiy-zameshcheniya.html