Тест по теме: Типы химических реакций. (8 класс)
1 вариант.
1. Какое уравнение соответствует реакции разложения?
1) Ca(OH)2 + CO2 = CaCO3 + H2O
2) 2HCl + Ba(OH)2 = BaCl2 + 2H2O
3) Na2S + Br2 = 2NaBr + S
4) 2AgI = 2Ag + I2
2. Какое уравнение соответствует реакции замещения?
1) 2K + 2H2O = 2KOH + H2
2) 2Al(OH)3 = Al2O3 + 3H2O
3) CH4 + 2O2 = CO2 + 2H2O
4) 2KNO3 = 2KNO2 + O2
3. Какое уравнение соответствует реакции обмена?
1) 2Al + Fe2O3 = 2Fe + Al2O3
2) CuCl2 + Fe = FeCl2 + Cu
3) 2Na + O2 = Na2O2
4) 2KOH + H2SO4 = K2SO4 + 2H2O
4. Какое уравнение соответствует реакции соединения?
1)Fe + 2HCl = FeCl2 + H2
2)4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
3)Cu(OH)2 = CuO + H2O
4)Na3PO4 + 3HNO3 = 3NaNO3 + H3PO4
5. Какое уравнение соответствует реакции разложения?
1)Cu + Hg(NO3)2 = Cu(NO3)2 + Hg
2)4NO2 + 2H2O + O2 = 4HNO3
3)2HCl + MgO = MgCl2 + H2O
4)(NH4)2CO3 = 2NH3 + CO2 + H2O
Тест по теме: Типы химических реакций. (8 класс)
2 вариант.
1. Какое уравнение соответствует реакции обмена?
1) Ca(OH)2 + CO2 = CaCO3 + H2O
2) 2HCl + Ba(OH)2 = BaCl2 + 2H2O
3) Na2S + Br2 = 2NaBr + S
4) 2AgI = 2Ag + I2
2. Какое уравнение соответствует реакции разложения?
1) 2K + 2H2O = 2KOH + H2
2) 2Al(OH)3 = Al2O3 + 3H2O
3) CH4 + 2O2 = CO2 + 2H2O
4) 2KNO3 = 2KNO2 + O2
3. Какое уравнение соответствует реакции замещения?
1) 2Al + Fe2O3 = 2Fe + Al2O3
2) CuCl2 + Fe = FeCl2 + Cu
3) 2Na + O2 = Na2O2
4) 2KOH + H2SO4 = K2SO4 + 2H2O
4. Какое уравнение соответствует реакции замещения?
1)Fe + 2HCl = FeCl2 + H2
2)4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
3)Cu(OH)2 = CuO + H2O
4)Na3PO4 + 3HNO3 = 3NaNO3 + H3PO4
5. Какое уравнение соответствует реакции соединения?
1)Cu + Hg(NO3)2 = Cu(NO3)2 + Hg
2)4NO2 + 2H2O + O2 = 4HNO3
3)2HCl + MgO = MgCl2 + H2O
4)(NH4)2CO3 = 2NH3 + CO2 + H2O
Тест по теме: Типы химических реакций. (8 класс)
3 вариант.
1. Какое уравнение соответствует реакции обмена?
1)2SO2 + O2 = 2SO3
2)H2S + CаO = CаS + H2O
3)SO3 + Na2O = Na2SO4
4)H2SO4 + Zn = ZnSO4 + H2
2. Какое уравнение соответствует реакции разложения?
1)Fe + H2SO4 = FeSO4 + H2
2)Ca + 2H2O = Ca(OH)2 + H2
3)Na2O + 2HСl = 2NaCl + H2O
4)2Al(OH)3 = Al2O3 + 3H2O
3. Какое уравнение соответствует реакции замещения?
1)Fe + CuSO4 = FeSO4 + Cu
2)CaCl2 + K2CO3 = CaCO3 + 2KCl
3)AgNO3 + NaСl = AgCl + NaNO3
4)Zn(OH)2 = ZnO + H2O
4. Какое уравнение соответствует реакции замещения?
1)Na2O + H2O = 2NaOH
2)BaCl2 + H2SO4 = BaSO4 + 2HCl
3)2KClO3 = 2KCl + 3O2
4)Zn + H2SO4 = ZnSO4 + H2
5. Какое уравнение соответствует реакции соединения?
1)NH3 + HNO3 = NH4NO3
2)H2S + MgO = MgS + H2O
3)SO3 + 2NaOН = Na2SO4 + Н2О
4)CuO + H2 = Cu + H2O
Тест по теме: Типы химических реакций. (8 класс)
4 вариант.
1. Какое уравнение соответствует реакции замещения?
1)2SO2 + O2 = 2SO3
2)H2S + CаO = CаS + H2O
3)SO3 + Na2O = Na2SO4
4)H2SO4 + Zn = ZnSO4 + H2
2. Какое уравнение соответствует реакции обмена?
1)Fe + H2SO4 = FeSO4 + H2
2)Ca + 2H2O = Ca(OH)2 + H2
3)Na2O + 2HСl = 2NaCl + H2O
4)2Al(OH)3 = Al2O3 + 3H2O
3. Какое уравнение соответствует реакции разложения?
1)Fe + CuSO4 = FeSO4 + Cu
2)CaCl2 + K2CO3 = CaCO3 + 2KCl
3)AgNO3 + NaСl = AgCl + NaNO3
4)Zn(OH)2 = ZnO + H2O
4. Какое уравнение соответствует реакции соединения?
1)Na2O + H2O = 2NaOH
2)BaCl2 + H2SO4 = BaSO4 + 2HCl
3)2KClO3 = 2KCl + 3O2
4)Zn + H2SO4 = ZnSO4 + H2
5. Какое уравнение соответствует реакции замещения?
1)NH3 + HNO3 = NH4NO3
2)H2S + MgO = MgS + H2O
3)SO3 + 2NaOН = Na2SO4 + Н2О
4)CuO + H2 = Cu + H2O
Реакция замещения в химии — как определить, признаки, примеры уравнений
Общие сведения
Все вещества принято разделять на два вида. Химические тела, образованные атомами одного химического реагента, называют простыми. Например, железо, в состав которого входят молекулы, образованные атомами Fe. Тела, состоящие из атомов разных элементов, относят к сложному виду — например, серная кислота. Состоит H2SO4 из молекул, образующихся атомами водорода, серы и кислорода.
В процессе химических взаимодействий новые вещества получаются только из тех атомов, которые имелись в исходном состоянии. Для того чтобы понять, по каким признакам происходит классификация химических реакций, следует рассмотреть несколько уравнений.
Медь, взаимодействуя с кислородом, образует оксид меди два: 2Cu + O2 — 2CuO. При смешении сульфата меди и гидроксида натрия образуется синий гидроксид меди и сульфат натрия: CuSO4 + 2NaOH — Cu (OH)2 + Na2SO4. Оксид гидраргиума распадается на двухвалентный кислород и ртуть: 2HgO — 2Hg + O2. Кальций, соединяясь с углекислым газом, образует карбонат: CaO +CO2 — CaCO3. Цинк при смешении с серной кислотой вытесняется ею: Zn + H2SO4 — ZnSO4 + H2, гидроксид железа распадается на трёхвалентное железо и воду: 2Fe (OH) — Fe2O3 + 3H2O.
Таким образом, различные реакции можно объединить в группы по количеству, составу и качеству исходных веществ и продуктов. Всего их существует четыре вида:
- Соединения. Условно записывают как А + Б = АБ или АБ + ВГ = АБВГ. Под таким типом понимают взаимодействие, при которой из ряда простых или сложных реагентов образуется одно.
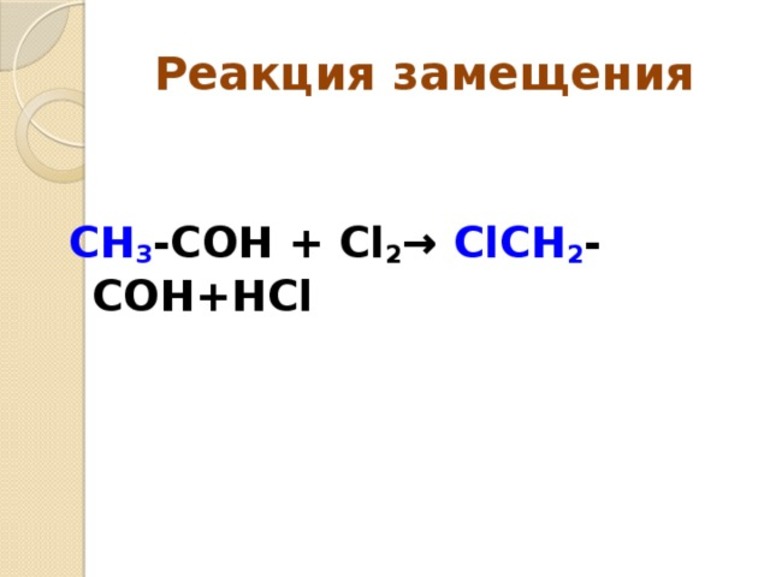
- Замещения. В этой реакции происходит взаимодействие двух веществ — простого и сложного. В результате части первого вещества вытесняют один из элементов сложного. Условно этот тип записывается как А + БВ — АВ + Б.
- Обмена. Это взаимодействие, происходящее между двумя сложными реагентами, которые отдают друг другу свои составные части. В итоге появляются два новых элемента. Схема записи такой реакции выглядит как АБ + ВГ — АГ + ВБ.
- Разложения. Реакция, при которой из одного исходного элемента образуется несколько менее сложных или простых веществ. Химическая схема взаимодействия выглядит как АБВГ — АБ + ВГ или АБ — А + Б.
Впервые высказал предположение о классификации реакций Д. И. Менделеев. Судить об их прохождении можно по изменению цвета, выпадению осадка, выделению газа, образованию свечения.
Механизмы взаимодействия
Протекание реакций замещения в органической химии описывают механизмами. Под ними понимают процесс детального изучения всех стадий и промежуточных веществ, а также природы взаимодействия реагентов между собой. Ими описывают характер разрыва связей и изменение энергии при переходе из начального состояния в конечное.
Механизмы замещения характеризуют по наиболее часто используемой классификации Ингольда, основоположником многих понятий органической химии. По его таблице, реакцию замещения (S) разделяют по составу частиц входящих во взаимодействия. Она бывает:
- свободнорадикальная ®;
- нуклеофильная (N);
- электрофильная (E).
Это удобная классификация, хотя они и не учитывает молекулярность соединений. Её альтернативной является разделение по Июпаку. Оно реже используется и основано на описании базовых актов создания и уничтожения связей. Предложена классификация была в 1988 году. Июпак утверждал, что использование классификации Ингольда вызывает двусмысленные ситуации, когда одно объяснение может использоваться для разного замещения, например, одностадийного ароматического замещения и двустадийной реакции алифатического атома углерода.
В его описании используются символы A и D, пишущиеся слитно при отщеплении и разделенные плюсом, если стадии происходят отдельно. Нижние индексы обозначают тип реакции. Такое описание обычно громоздкое, поэтому в учебной литературе редко когда приводится.
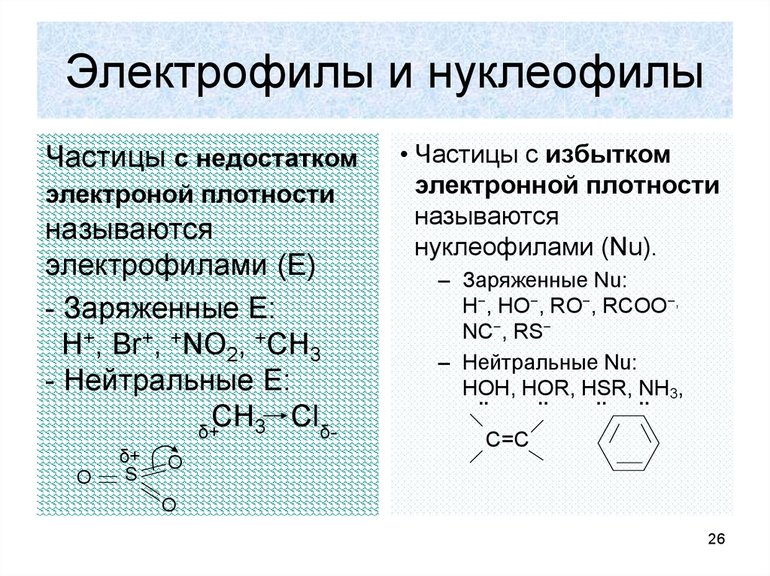
Электрофильные и нуклеофильные
Самое важное, что нужно знать об электрофильных реакциях, это то, что существует два варианта разрыва связи: монополярная и гетерополярная. В первом случае электронная пара разрушающегося соединения не разрывает связь с атомом углерода. Например, вещество, для которого характерна реакция замещения, метан: H3CH — H3C +H, то есть из предельного углеводорода образуется отрицательно заряженный карбанион, а электронная пара остаётся у атома углерода.
Карбанионы могут быть разной гибридизации sp2 и sp3. Чем больше их устойчивость, тем у них ниже способность к реакциям. Определяется она степенью делокализации заряда у атома углерода. Устойчивость уменьшается в ряду: фенил — винил — циклопропил — метил. Самая слабая у вторичного и третичного карбаниона (разделение происходит по количеству связей углерода).
Образование новой связи происходит путём обобщения освободившейся свободной пары углерода с реагентом. При этом последний должен иметь положительный заряд или секстет электронов. Элемент в этом случае является электрофильной химической частичкой. Например, к таким реакциям замещения относится взаимодействие брома с углеродом. Формула такой записи, следующая: H3C: Br+: Br- — H3CBr + Br. Электрофильные реагенты бывают:
- нейтральными молекулами с нейтральной орбиталью (AlCl3, FeBr3, SnCl4);
- катионами (SO3H+, NO2+, NO+);
- молекулами с пониженной плотностью электронов (Cl2, Br2, I2).
Нуклеофильная реакция будет протекать при разрушении углеродной связи. В этом случае электронная пара отсоединяется. Образуется углеродный ион с положительным зарядом. Формула записи будет соответствовать виду: H3C: Cl — H3C+: Cl-. Образуемый элемент носит название карбкатион. Электронная пара теряет атом углерода. Положительный заряд находится в sp2-гибридизации, то есть, меняет своё валентное состояние на более энергетически выгодное. Устойчивость карбкатионов определяется степенью делокализации. Она увеличивается в ряду метил — катион — первичный — вторичный — третичный.
При нуклеофильной реакции происходит обобщение электронной пары, которую представляет реагент. Субстрат обладает дефицитом электронов (+), а реагент (-). Например, H3C+ + K+OH- — H3COH + K+. Есть закономерность, что все гетерополярные реакции проходят легче с полярными соединениями и поляризующимися связями.
Радикальные реакции
Радикалами называют отдельные атомы или их группы с неспаренным электроном. Алкильные обозначаются латинской буквой R с рядом стоящей точкой. Свободный электрон находится на p -орбитали, находящийся на перпендикулярной плоскости С. На геометрию радикала сильное влияние оказывают заместители. Существуют такие атомы короткое время и их количество незначительно.
Затормозить свободнорадикальные реакции можно ингибиторами или инициаторами, так как они очень реакционноспособные частицы. В качестве ингибиторов выступает кислород, йод, полифенол, амин и другие соединения. Есть два способа появления радикалов:
- госмолитический разрыв ковалентной связи;
- перенос с иона или на него электрона.
Устойчивое состояние определяется делокализацией свободной частицы, пространственным и конформационным фактором. К первичным радикалам относят: метилы, этилы, пропилы и изобутилы. К вторичным — изопропилы, втор-бутилы, а к третичным — трет-бутилы. Стабилизация возрастает от первичных к третичным.
Наиболее типичным механизмом является реакция замещения хлорирования метана:
CH 4 + Cl 2 — CH3Cl + HCl.
При радикальном замещении происходит следующее:
- Инициирование цепи путём гомолитического разрыва Cl: Cl — Cl* + Cl* под действием фотолиза.
- Радикалы хлора пытаются стабилизироваться и начинают воздействовать на молекулы метана: Cl* + CH — HCl + *CH3. Хлор оттягивает на себя водород, а метан переходит в состояние метил радикала. На этой стадии происходит шквальное увеличение количества радикалов (рост цепи).
- Чтобы стабилизироваться, радикалы воздействуют на молекулы хлора, и образуется хлорметан с радикалом хлора CH3* + Cl2 — CH3Cl + Cl*.
- На конечной стадии происходит разрыв цепи, то есть радикалы встречаются и замыкаются друг на друге: 2Cl* — Cl или Cl* + CH — CH3Cl.
К более серьёзным реакциям относится взаимодействие брома с пропаном в результате термолиза: CH3CH2CH3 + Br2 — CY3CHCH3: Br + HBr. При обрыве цепи, после взаимодействия двух радикалов, образуется молекула брома. Реакция радикала с изопропилом приводит к появлению двух бром пропан, а также образованию соединение «два, три диметилбутан».
Взаимодействие с галогенами зависит от их расположения и соответствует следующему: F2 > Cl2 > Br2 > I2. С йодом реакция уже не идёт.
Типичное замещение
Различные задания на определение типа реакций начинают решать в восьмом классе. Для того чтобы решать задачи, необходимо не только правильно знать, как записать процесс, но и определить невозможный тип, а также различать вид термического процесса. Ведь протекание любой химической реакции невозможно без поглощения или выделения тепла. Такие процессы соответственно называются экзотермическими и эндотермическими.
К особенностям элементов, способных участвовать в реакции, относят:
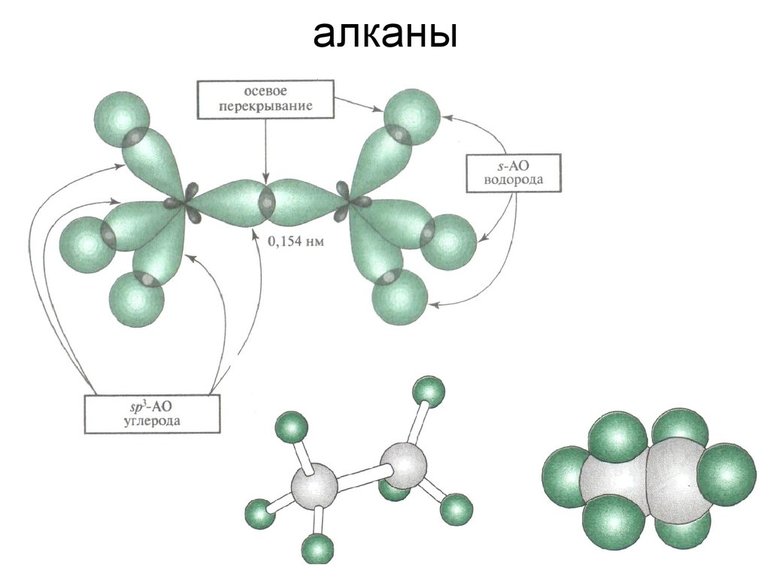
- Алканы. Соединения, состоящие из простых связей, насыщенных углеводородом: CnH2n + 2. Из-за большого количества органических соединений, состоящих из водорода и углерода реакция разложения для них неосуществима.
- Галогены. Они все являются окислителями. К ним относятся неметаллы. Наиболее яркие представители: хлор, йод, фтор, бром, астат. В процессе галогенирования водород, присутствующий в соединении, заменяется галогеном. Начиная с пропана С3Н8, алканы при радикальном замещении образуют изомеры. При термическом галогенировании процесс определяется числом C — H — связей и зависит от скорости, с которой галогены заменят водород.
- Алкены. Выделяются они присутствием в молекулах одной двойной связи. Именно она отвечает за их химические свойства. Реакция замещения свойственна элементам с двойными и тройными связями. К ней относят гидрирование H2C = CH2 + H2 — H3C, гидрогалогенирование H2C = CH2 + HBr — H3C — CH2Br, гидратацию H2C = CH2 + H20 — H3C — CH2OH. При этом есть три механизма разрыва: образование свободного радикала, иона, присоединение водорода к более гидрированному атому углерода (реакция полимеризации).
Все эти элементы могут вступать в реакцию с образованием простого или сложного нового вещества. Во время процесса образуются новые соединения. Это происходит до тех пор, пока не иссякнут все свободные радикалы.
Примеры и онлайн-решения
Реакции замещения в своём большинстве являются окислительно-восстановительными. Примеры процессов, в которых не наблюдается изменение степени окисления, немногочисленны.
Из распространённых реакций, можно привести следующие:
- Cu+Hg (NO3)2 — Hg+Cu (NO3)2.
- Fe+CuSO4 — Cu+FeSO4.
- ZnO + SO3 — ZnSO4.
- 2KBr+ Cl2 — 2KCl+ Br2.
- Ba + 2HCl — BaCl2 + H2.
- C2H6 + Cl2 — CH3CH2CL + HCL.
- CH3CH2Cl + KOH — CH3CH2OH + KCl.
- NаНСО3 + НСl = NаСl + Н2О + СО2
- Fe+ 2HCl — FeCl2+ H2.
- СrСl 3 + ЗNаОН — Сr (ОН) 3 + ЗNаСl.
Для проверки своих знаний существуют интернет-сервисы, позволяющие быстро решить любое химическое уравнение онлайн, например, chemequations.com. Пользоваться им сможет любой, даже тот, кто не умеет правильно указать обозначения химических элементов. Для работы с сайтом необходимо написать части соединения (система будет сама предлагать правильное их обозначение) и нажать «Поиск». Правильное решение будет рассчитано автоматически.
Взаимодействие углекислого газа с веществами и его химические свойства
Общие химические свойства углекислого газа: CO2 инертен, то есть химически не активен; при попадании в водный раствор легко вступает в реакции.
Большинство кислотных оксидов устойчивы к высоким температурам, но углекислота при их воздействии восстанавливается.
Взаимодействие с другими веществами:
1) Углекислота относится к кислотным оксидам, то есть в сочетании с водой образуется кислота. Однако угольная кислота неустойчива и распадается сразу. Эта реакция имеет обратимый характер:
Диоксид углерода + вода ↔ угольная кислота

2) При взаимодействии углекислого газа и соединений азота с водородом (аммиаком) в водном растворе происходит разложение до углеаммонийной соли.
Аммиак + углекислота = гидрокарбонат аммония

Полученное вещество часто используется в приготовлении хлеба и различных кондитерских изделий.
3) Ход некоторых реакций должен поддерживаться высокими температурами. Примером является производство мочевины при 130 °C и давлении 200 атм., схематически изображаемое так:
Аммиак + диоксид углерода → карбамид + вода
Также под воздействием температуры около 800 градусов протекает реакция образования оксида цинка:
Цинк + двуокись углерода → оксид цинка + оксид углерода
4) Возможно уравнение с гидроксидом бария, при котором выделяется средняя соль.
Гидроксид бария + углекислота = карбонат бария + оксид водорода.
Применяется для регулировки калориметров по теплоемкости. Также вещество используют в промышленности для производства красных кирпичей, синтетических тканей, фейерверков, гончарных изделий, плитки для ванн и туалетов.
5) Углекислый газ выделяется при реакциях горения.
Метан + кислород = углекислота + вода (в газообразном состоянии) + энергия
Этилен + кислород = диоксид углерода + оксид водорода + энергия
Этан + кислород = двуокись углерода + вода + энергия
Этанол + кислород = вода + углекислота + энергия
6) Газ не поддерживает горения, этот процесс возможен только с некоторыми активными металлами, например, магнием.
Магний + углекислота = углерод + оксид магния.
MgO активно применяется при производстве косметических средств. Вещество используют в пищевой промышленности как пищевую добавку.
7) Двуокись углерода реагирует с гидроксидами с получением солей, которые существуют в двух формах, как карбонаты и бикарбонаты. Например, углекислый газ и гидроксид натрия, согласно формуле, образуют гидрокарбонат Na:
диоксид углерода + гидроксид натрия → гидрокарбонат натрия.
Или же при большем количестве NaOH образуется карбонат Na с образованием воды:
Диоксид углерода + гидроксид натрия → карбонат натрия + вода
Кислотно-щелочные реакции углекислоты используются на протяжении веков для затвердевания известкового раствора, что может быть выражено простым уравнением:
Гидроксид кальция + двуокись углерода → карбонат кальция + оксид водорода

Диоксид углерода + вода → глюкоза + кислород.
9) Химические свойства углекислоты используются в промышленности при производстве соды, суть этого процесса можно выразить суммарным уравнением:
Хлорид натрия + Диоксид углерода + аммиак + вода → гидрокарбонат натрия + хлорид аммония
10) Фенолят Na разлагается при взаимодействии с углекислым газом, при этом малорастворимый фенол выпадает в осадок:
Фенолят натрия + двуокись углерода + оксид водорода = фенол + гидрокарбонат натрия
11) Пероксид натрия и углекислый газ, взаимодействуя, образуют среднюю соль карбоната Na с выделением кислорода.
Пероксид натрия + углекислота → карбонат натрия + кислород

Образование углекислоты происходит при растворении в воде кальцинированной соды (стиральной соды).
Гидрокарбонат натрия + вода → углекислота + вода + гидроксид натрия
При этой реакции (гидролиз по катиону) образуется сильнощелочная среда.
12) CO2 вступает в реакцию с гидроксидом калия, последний образуется путем электролиза хлористого калия.
Гидроксид калия + углекислота → карбонат калия + вода
13) Газ в силу своего строения не реагирует с благородными газами, то есть гелием, неоном, аргоном, криптоном, ксеноном, радоном, оганесоном.
Заключение
Мы привели большую часть химических реакций, в которых участвует CO2. Ученые всего мира пытаются решить проблему увеличения концентрации углекислоты в воздухе, не без помощи реакций с другими веществами, которые известны химикам. А какие химические формулы взаимодействия углекислого газа знаете вы?
Спасибо, что указали на ошибку. Исправили.
Скажите пожалуйста На производстве углекислоты мы заменили на комрессорном агрегате старый охладитель углекислого газа с трубками из нержавейки на новый, с латунными трубками. То есть в начале этих трубок охладителя Углекислый газ будет под давлением 16 бар и температурой 130 градусов, на выходе + 10 градусов, всё это с выделением конденсата. Не будет ли какой-то непредвиденной реакции в зоне взаимодействия уг. газа, латуни и воды? Охладитель работает хорошо, но не разрушаться ли трубки от коррозии?
Необходимо определиться для начала, откуда поступает к вам углекислый газ, какие еще газы поступают вместе с углекислым газом в охладитель. У нас, в энергетическом производстве, на определенном участке пароводяного тракта установлены латунные трубки, в которых происходит нагрев теплоносителя. Мы производим замеры растворенного кислорода в конденсате перед подачей его на подогреватели с трубками из латуни. В нашем случае большая концентрация кислорода в воде, при нагревании последней, приводит к коррозии латунных трубок.
Здравствуйте Вячеслав. Углекислый газ поступает с брожения пивного сусла. Углекислый газ (у.г.) сжимается компрессором и при t 130* подаётся на теплообменник (т.о.). хладоносителем t -4*. На латунных стенках т.о. образуется конденсат который отделяется от у.г. в конденсатоотводчике. Содержание кислорода в конденсате не должно быть большим, если вообще не минимальное. После установки нового т.о. конденсатоотводчик стал забиваться непонятной серой массой похожей на мокрый графит. Компрессор разбирали — проблема не в нём (думали одно из графитовых колец размолотило). Разбирать и осматривать т.о. более трудоёмкий процесс.
Затрудняюсь вам ответить на этот вопрос, надо изучать состав газа на входе в теплообменник. Возможно образование угольной кислоты в теплообменнике. А при наличии кислорода кислота может вызывать коррозию, но это не точно.
http://nauka.club/khimiya/reaktsiy-zameshcheniya.html
http://uglekislygaz.ru/dioksid-ugleroda/himicheskie-svojstva-co2/