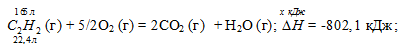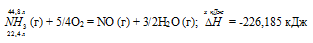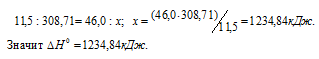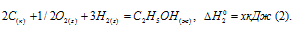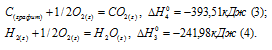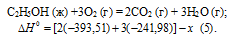Изменение энтальпии при реакции MnO2 + 2C = Mn + 2 CO равно 70 кДж/ моль. Теплота образования CO 26,4 кДж/ моль. Определить теплоту образования MnO2
Ответы
Serpentio` 6 (15726) 2 4 16 11 лет
ΔH(реакции) = ΣΔHf (продукты) — ΣΔHf (реагенты)
ΔН(r) = +70 kJ/mol
ΔHf(обр. С) = 0 kJ/mol — потому что энтальпия образование простых веществ всегда равна 0 kJ/mol
ΔHf(обр. Mn) = 0 kJ/mol
ΔHf(обр. CO) = 26.4 kJ/mol
ΔHf(обр. MnO2) = ?
Подставляем числа:
70 = (0+2*26,4) — (ΔH(MnO2) +2*0)
ΔH(MnO2) = -17,2 kJ/mol
Wolfsangel 6 (17779) 2 4 14 11 лет
Верь Серпентино. Он правильно ответил 🙂 И вообще ему пиво за такой ответ положено:)
Составление термохимического уравнения реакции и вычисление теплот образования веществ
Теплота образования веществ
Задание 88.
Тепловой эффект какой реакции равен теплоте образования метана? Вычислите теплоту образования метана, исходя из следующих термохимических уравнений:
а) Н2 (г) + 1/2О2 (г) = Н2О (ж); 
б) С (к) + О2 (г) = СО2 (г); 
в) СН4 (г) + 2О2 (г) = 2Н2О (ж) + СО2 (г); 
Ответ: -74,88 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование метана из водорода и углерода можно представить так:
С (графит) + 2Н2 (г) = СН4 (г); 
Исходя из данных уравнений по условию задачи, учитывая, что водород сгорает до воды, углерод — до углекислого газа, метан – до углекислого газа и воды и, на основании закона Гесса, с термохимическими уравнениями можно оперировать также как и с алгебраическими. Для получения искомого результата нужно уравнение горения водорода (а) умножить на 2, а затем, сумму уравнений горения водорода (а) и углерода (б) вычесть из уравнения горения метана (в):
СН4 (г) + 2О2 (г) — 2 Н2 (г) + О2 (г) — С (к) + О2 (г) =
= 2Н2О (ж) + СО2 — 2Н2О — СО2;

СН4 (г) = С (к) + 2Н2 (к); 
Так как теплота образования равна теплоте разложения с обратным знаком, то

Ответ: -74,88 кДж.
Задание 89.
Тепловой эффект какой реакции равен теплоте образования гидроксида кальция? Вычислите теплоту образования гидроксида кальция, исходя из следующих термохимических уравнений:
Са (к) + 1/2О (г) = СаО (к); 
Н2 (г) + 1/2О2 (г) = Н2О (ж); 
СаО (к) + Н2О (ж) = Са(ОН)2 (к); 
Ответ: —986,50 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование гидроксида кальция из простых веществ можно представить так:
Са (к) + О2 (г) + Н2 (г) = Са(ОН)2 (к); 
Исходя из уравнений, которые даны по условию задачи и, учитывая, что водород сгорает до воды, а кальций, реагируя с кислородом, образует СаО, то на основании закона Гесса с термохимическими уравнениями можно оперировать также как с алгебраическими. Для получения искомого результата нужно все три уравнения сложить между собой:
СаО (к) + Н2О (ж) + Са (к) + 1/2О (г) + Н2 (г) + 1/2О2 (г = (ОН)2 (к) + СаО (к) + Н2О (ж); 
Так как стандартные теплоты образования простых веществ условно принята равными нулю, то теплота образования гидроксида кальция будет равна тепловому эффекту реакции образования его из простых веществ (кальция, водорода и кислорода):


Ответ: -986,50 кДж.
Задание 90.
Тепловой эффект реакции сгорания жидкого бензина с образованием паров воды и диоксида углерода равен -3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования С6Н6 (ж). Ответ: +49,03 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 

Термохимическое уравнение реакции имеет вид:
С6Н6 (ж) + 7/2O2 = 6CO2 (г) + 3Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:









Ответ: +49,03 кДж.
Теплота образования
Задание 91.
Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена С2Н2, если продуктами сгорания являются диоксид углерода и пары воды? Ответ: 924,88 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 

Уравнение реакции имеет вид:
С2Н2 (г) + 5/2O2 (г) = 2CO2 (г) + Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при сгорании 165 л ацетилена по этой реакции, определим из пропорции:
22,4 : -802,1 = 165 : х; х = 165 (-802,1)/22,4 = -5908,35 кДж; Q = 5908,35 кДж.
Ответ: 5908,35 кДж.
Задание 92.
При сгорании газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 л NO в пересчете на нормальные условия? Ответ: 452,37 кДж.
Решение:
Уравнение реакции имеет вид:
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при сгорании 44,8 л аммиака, вычислим из пропорции:
22,4 : -226,185 = 44,8 : х; х = 44,8 (-226,185)/22,4 = -452,37 кДж; Q = 452,37 кДж.
Ответ: 452,37 кДж
Тепловой эффект реакции
Задание 93.
Реакция горения метилового спирта выражается термохимическим уравнением:
СН3ОН (ж) +3/2О2 (г) = СО2 (г) + 2Н2О (ж); 
Вычислите тепловой эффект этой реакции, если известно, что молярная теплота парообразования СН3ОН (ж) равна +37,4 кДж. Ответ: -726,62 кДж.
Решение:
(СН3ОН (ж)) = (СН3ОН (г)); 
+37,4 кДж = -201,17 — 

Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Ответ: -726,62 кДж.
Термохимическое уравнение реакции
Задание 94.
При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н5ОН(ж). Ответ: —277,67 кДж.
Решение:
Мольная масса С2Н5ОН равна 46,0г/моль.
Находим тепловой эффект реакции горения этилового спирта из пропорции:
Следовательно, термохимическое уравнение реакции будет иметь вид:
С2Н5ОН (ж) +3О2 (г) = 2СО2 (г) + 3Н2О (г); 
Обозначим искомую величину через х, запишем термохимическое уравнение образования С2Н5ОН из простых веществ:
Запишем также термохимические уравнения образования СО2(г) и Н2О(ж):
Из уравнений (2), (3) и (4) можно получить уравнение (5). Для этого умножим уравнение (4) на три, уравнение (2) — на два, а затем из суммы уравнений (3) и (4) вычтем уравнение (2), получим:
Сравнивая уравнения (1) и (5), находим:
Ответ: 
Какое уравнение соответствует теплоте образования mno2
MnO2(к). Термодинамические свойства кристаллического диоксида марганца в стандартном состоянии при температурах 100 – 2000 К приведены в табл. MnО2_c. За стандартное состояние MnО2(к) в интервале 0 — 2000 К принята тетрагональная модификация, минерал пиролюзит, β-MnO2 (структурный тип рутила, TiO2). Известные другие модификации MnО2 (α-, γ- и др.) являются метастабильными и при нагревании до температур
600К необратимо переходят в β-MnO2. Термохимия метастабильных модификаций MnО2 недавно исследована в работе Фритш и др. [ 98FRI/POS].
При Т -1 ·моль -1 и 0.03 кДж·моль -1 соответственно. Менее точные результаты измерений теплоемкости MnО2 в ранних работах Миллара [ 28MIL2] (72-294 K) и Келли и Мур [ 43KEL/MOO] (53 – 297 К) не учитывались.
При температурах выше 298.15 К для MnО2 имеются только данные по теплоемкости в интервале 298 – 380 К в работе Роби и Хемингуэйя [ 85ROB/HEM] и результаты измерений инкрементов энтальпии Hº(T) — Hº(298.15 K) в работе Мур [ 43MOO] (12 измерений в интервале 341-778 К). Методом Шомейта была проведена совместная обработка этих данных, причем данные [ 85ROB/HEM] вводились в виде 8 значений Hº(T) — Hº(298.15 K) в интервале 310 – 380 К, а из данных [ 43MOO] была исключена выпадающая точка при 358.3 К. Точность указанных данных была оценена в 0.3% и 0.5% соответственно. Полученное трехчленное уравнение для теплоемкости MnО2 (см. табл. Mn.1) хорошо описывает исходные данные и принималось для экстраполяции теплоемкости в интервале температур 800 – 2000 К. При 1400 К это уравнение приводит к значению 92.7 Дж·К -1 ·моль -1 , которое удовлетворительно согласуется с экспериментальным значением теплоемкости для Mn2O3. Температура плавления MnO2 не определена ввиду его разложения при
1000 К на Mn2O3 и кислород.
Погрешности вычисленных значений Ф°(Т) при 298.15, 500, 1000, 1500 и 2000 К оцениваются в 0.2, 0.3, 1, 3 и 6 Дж·K –1 ·моль –1 соответственно. Расхождения с таблицей термодинамических функций MnO2(к), приведенной в справочнике Барина [ 95BAR] (298.15 — 800 K), составляют
0.5 Дж·K –1 ·моль –1 в значениях Sº(T) ввиду того, что в справочнике [ 95BAR] не учтена работа [ 85ROB/HEM].
В настоящем издании принимается значение энтальпии образования MnO2(к), равное:
D fH°(MnO2, к, 298.15 K) = -521.0 ± 1.0 кДж × моль ‑1 .
Принятое значение основано на прецизионных измерениях энтальпий растворения в серной кислоте марганца и его окисла состава Mn3O4, выполненных в работе [ 43SHO].
Для получения энтальпии образования в [ 43SHO] было использовано два термохимических цикла, а именно: (1) растворение Mn, MnO2 и Н2О2 в серной кислоте, содержащей Fe +2 , и (2) растворение эквивалентных количеств Mn3O4 и смеси (2MnO + MnO2) в том же растворе.
Для первого цикла выполненные измерения привели к значению энтальпии образования MnO2(к): ‑124.30 ± 0.31 ккал × моль ‑1 (в работе принято 1 кал = 4.1833 Дж). Пересчет дает значение D fH°(MnO2, к, 298.15 K) = ‑520.0 ± 1.3 кДж × моль ‑1 . Использование второго цикла приводит для реакции 2MnO(к) + MnO2(к) = Mn3O4(к) к значению D rH°(298.15 K) = ‑22.709 ± 0.058 ккал × моль ‑1 = ‑95.00 ± 0.24 кДж × моль ‑1 , откуда с принятыми для MnO(к) и Mn3O4(к) значениями получаем D fH°(MnO2, к, 298.15 K) = ‑522.4 ± 1.5 кДж × моль ‑1 . Принято средневзвешенное значение.
Эксперименты по термическому разложению MnО2(к) до Mn3O4(к) в калориметрической бомбе [ 39SIE] приводят к степени разложения около 98% от теоретического значения. Для реакции 3MnO2(к) = O2(г) + Mn3O4(к) в [ 39SIE] получено значение D rH°(298.15 K) = 39.2 ± 3 ккал × моль ‑1 = 164 ± 13 кДж × моль ‑1 ; (при пересчетах нами принято 1кал = 4.1833 Дж , как в работе [ 43SHO]; в [ 39SIE] коэффициент пересчета не указан). Комбинация этого значения с принятой в данном документе энтальпией образования Mn3O4(к) приводит к величине D fH°(MnO2, к, 298.15 K) = ‑517 ± 5 кДж × моль ‑1 . В [ 39SIE] приведено D fH°(MnO2, к, 298.15 K) = ‑125.4 ± 1.0 ккал × моль ‑1 = ‑524.6 ± 4.2 кДж × моль ‑1 ; различие связано, главным образом, с различием в принятой энтальпии образования Mn3O4(к). Обратим внимание на то, что в опытах с синтетическим препаратом в [ 39SIE] были получены заметно отличные результаты: D rH°(298.15 K) = 43.5 и 41.3 ккал × моль ‑1 .
Принятому значению соответствует величина:
Константа равновесия реакции MnО2(к) = Mn(г) + 2O(г) вычислена с использованием значения D fH°(0) = 1292.997 ± 2.2 кДж × моль ‑1 , соответствующего принятым энтальпиям образования.
Толмач П.И., Бергман Г.А. bergman@yandex.ru


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
http://buzani.ru/zadachi/khiniga-shimanovich/913-termokbimicheskie-uravnenia-teplota-obrazovanie-88-94
http://www.chem.msu.su/Zn/Mn/MnO2_c.html