Необратимость тепловых процессов. Второй закон термодинамики. Понятие энтропии
Первый закон термодинамики – закон сохранения тепловых процессов, устанавливающий связь между количеством теплоты Q и изменением ∆ U внутренней энергии и работой А , совершенной над внешними телами:
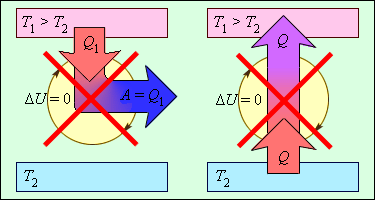
Исходя из закона, энергия не может быть создана или уничтожена: производится процесс передачи от одной системы к другой, принимая другую форму. Еще не было получено процессов, нарушающих первый закон термодинамики. Рисунок 3 . 12 . 1 показывает устройства, противоречащие первому закону.
Рисунок 3 . 12 . 1 . Циклически работающие тепловые машины, запрещаемые первым законом термодинамики: 1 – вечный двигатель 1 рода, совершающий работу без потребления энергии извне; 2 – тепловая машина с коэффициентом полезного действия η > 1 .
Обратимый и необратимый процессы
Первый закон термодинамики не устанавливает направления тепловых процессов. Опыты показывают, что большинство тепловых процессов протекают в одном направлении. Их называют необратимыми.
Если имеется тепловой контакт двух тел с разными температурами, тогда направление теплового потока направляется от теплого к холодному. Самопроизвольной передачи тепла от тела с низкой температуры к телу с высокой не наблюдается. Отсюда следует, что теплообмен с конечной разностью температур считается необратимым.
Обратимым процессом называется переход системы из одного равновесного расстояния в другое, которые возможно проводить в обратном направлении в той же последовательности промежуточных равновесных состояний. Она вместе с окружающими телами возвращаются к исходному состоянию.
Если система находится в состоянии равновесия во время процесса, она называется квазистатической.
Когда рабочее тело тепловой машины контактирует с тепловым резервуаром, температура которого неизменна во время всего процесса, то только изотермический квазистатический процесс считается обратимым, так как протекает с бесконечно малой разницей температур рабочего резервуара. Если имеется два резервуара, причем с разными температурами, тогда обратимым путем можно провести процессы на двух изотермических участках.
Так как адиабатический процесс проводится в обоих направлениях (сжатие и расширение), наличие кругового процесса с двумя изотермами и двумя адиабатами (цикл Карно) говорит о том, что это и есть единственный обратимый круговой процесс, где рабочее тело контактируется с двумя тепловыми резервуарами. Остальные при наличии 2 тепловых резервуаров считаются необратимыми.
Превращение механической работы во внутреннюю энергию считаются необратимыми при наличии силы трения, диффузии в газах и жидкостях, а процесс перемешивания по причине начальной разности давлений и так далее. Все реальные процессы считаются необратимыми, даже если значения будут максимально приближены к обратимым. Обратимые рассматриваются как пример реальных процессов.
Первый закон термодинамики не различает их. Правило требует от термодинамического процесса определенного энергетического баланса, но не говорит о том, возможен ли он. Установка направления прохождения процесса определяется вторым законом термодинамики. Его формулировка может звучать как запрет на определенные термодинамические процессы.
Второй закон был трактован У. Кельвином в 1851 .
В циклически действующей тепловой машине невозможно прохождение процесса, единственным результатом которого было бы преобразование в механическую работу всего количества теплоты, полученного от единственного теплового резервуара.
Предположительно, машина с такими процессами могла бы получить название вечного двигателя второго рода.
При земных условиях могла бы быть отбита энергия Мирового океана и полностью превратилась бы в ее работу. Масса воды Мирового океана – 10 21 к г . Для его охлаждения хотя бы на 1 градус потребуется огромное количество энергии ≈ 10 24 Д ж , которое сравнимо с сжиганием 10 17 к г угля. Вырабатываемая энергия на Земле за год в 10 4 раз меньше. Отсюда и вывод о том, что вечный двигатель второго рода мало вероятен, как и двигатель первого, потому как оба они недопустимы, исходя из первого закона термодинамики.
Второй закон термодинамики
Формулировка 2 -го закона термодинамики была дана физиком Р. Клаузиусом.
Невозможно прохождение процесса, единственным результатом которого была бы передача энергии при помощи теплообмена от тела с низкой температуры к телу с более высокой.
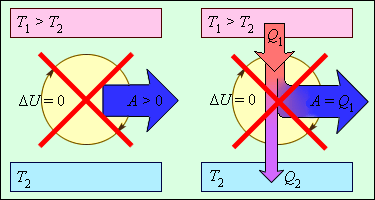
Рисунок 3 . 12 . 2 объясняет процессы, которые запрещены вторым законом, но разрешены согласно первому. Они соответствуют трактовкам второго закона термодинамики.
Рисунок 3 . 12 . 2 . Процессы, не противоречащие первому закону термодинамики, но запрещаемые вторым законом: 1 – вечный двигатель второго рода; 2 – самопроизвольный переход тепла от холодного тела к более теплому (идеальная холодильная машина).
Формулировки обоих законов считаются эквивалентными.
Когда тело без помощи внешних сил переходит при теплообмене от холодного к горячему, то возникает мысль о возможности создания вечного двигателя второго рода. Если такая машина получит количество теплоты Q 1 от нагревателя и отдаст холодильнику Q 2 , тогда совершается работа A = Q 1 — Q 2 . Если бы Q 2 самопроизвольно перешло к нагревателю, то конечный результат тепловой машины и идеальной холодильной машины выглядело бы таким образом Q 1 — Q 2 . Причем сам переход происходил бы без изменений холодильника. Отсюда вывод – комбинация тепловой машины и идеальной холодильной машины равноценна двигателю второго рода.
Прослеживается связь между вторым законом термодинамики и необратимостью реальных тепловых процессов. Энергия теплового движения молекул отлична от механической, электрической и так далее. Она способна превратиться в другой вид энергии только частично. Поэтому при наличии энергии теплового движения молекул любой процесс считается необратимым, так как полностью в обратном направлении он не осуществим.
Свойство, относящееся к необратимым процессам, говорит о том, что они проходят в термодинамически неравновесной системе, а результат получается в виде замкнутой системы, приближающейся к состоянию термодинамического равновесия.
Теоремы Карно
Имеются теоремы Карно, которые могут быть доказаны, исходя из второго закона термодинамики.
КПД тепловой машины, работающей при данных значениях температур нагревателя холодильника, не может иметь значение больше, чем КПД действия машины, работающей согласно обратимому циклу Карно с теми же значениями температур нагревателя и холодильника.
КПД действия тепловой машины, работающей по циклу Карно, не зависит от рода рабочего тела, а только от температур нагревателя и холодильника.
Отсюда следует, что КПД действия машины с циклом Карно считается максимальным.
η = 1 — Q 2 Q 1 ≤ η m a x = η К а р н ю = 1 — T 2 T 1 .
Знак равенства данной записи говорит об обратимости процесса. Если машина работает по циклу Карно, тогда:
Q 2 Q 1 = T 2 T 1 или Q 2 T 2 = Q 1 T 1 .
Знаки Q 1 и Q 2 всегда отличаются независимо от направления цикла. Поэтому получаем:
Q 1 T 1 + Q 2 T 2 = 0 .
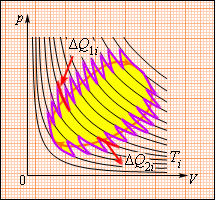
Рисунок 3 . 12 . 3 говорит о том, что данное соотношение обобщается и представляется в виде последовательности малых изометрических и адиабатических участков.
Рисунок 3 . 12 . 3 . Произвольный обратимый цикл как последовательность малых изотермических и адиабатических участков.
Полный обход замкнутого обратимого цикла имеет вид:
∑ ∆ Q i T i = 0 (обратимый цикл).
Откуда ∆ Q i = ∆ Q 1 i + ∆ Q 2 i – количество теплоты, полученное рабочим телом на двух изотермических участках с температурой T i . Чтобы данный цикл провести наоборот, нужно рабочее тело сконтактировать со многими тепловыми резервуарами с T i .
Энтропия
Отношение Q i T i получило название приведенного тепла. Формула показывает, что полное приведенное тепло на любом обратимом цикле равно нулю. Благодаря ей вводится еще одно понятие – энтропия, обозначаемая S . Ее открыл Р. Клаузиус в 1865 году.
При переходе из одного равновесного состояние в другое изменяется и ее энтропия. Разность энтропий двух состояний равняется приведенному теплу, полученному системой во время обратного перехода состояния.
∆ S = S 2 — S 1 = ∑ ( 1 ) ( 2 ) ∆ Q i о б р T .
Если рассматривается адиабатический процесс ∆ Q i = 0 , тогда энтропия S не изменяется.
Изменение энтропии ∆ S во время перехода в другое состояние фиксируется как формула:
∆ S = ∫ ( 1 ) ( 2 ) d Q о б р T .
Определение энтропии достаточно точное. Разность ∆ S двух состояний системы подразумевает физический смысл. Если имеется необратимый переход, а необходимо найти энтропию, тогда нужно придумать обратимый процесс, который свяжет начальное и конечное состояние. После этого перейти к нахождению приведенного тепла, полученного системой.
Рисунок 3 . 12 . 4 Модель энтропии и фазовых переходов.
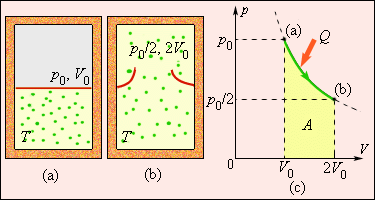
Рисунок 3 . 12 . 5 показывает необратимый процесс расширения шага с отсутствием теплообмена. Равновесными считаются начальное и конечное значение, изображаемые на диаграмме p , V . Точки a и b соответствуют состояниям и располагаются на одной изотерме. Чтобы найти ∆ S , следует перейти к рассмотрению обратимого изотермического перехода из a в b . При изопроцессе газ получает определенное количество теплоты окружающих тел Q > 0 , тогда при необратимом расширении энтропия возрастет до ∆ S > 0 .
Рисунок 3 . 12 . 5 . Расширение газа в «пустоту». Изменение энтропии ∆ S = Q T = A T > 0 где A = Q – работа газа при обратимом изотермическом расширении.
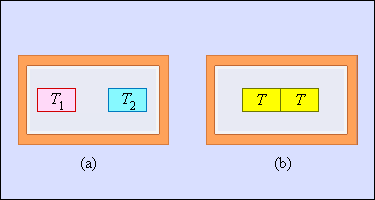
Еще одним примером необратимого процесса считается теплообмен при конечной разности температур. Рисунок 3 . 12 . 6 и показывает два тела, заключенные в адиабатическую оболочку, где начальные температуры обозначаются как T 1 и T 2 T 1 . Течение процесса теплообмена способствует выравниванию температур. Очевидно, что теплое тело отдает, а холодное принимает. Холодное тело превосходит по модулю приведенное тепло, отдаваемое горячим. Отсюда вывод – изменение энтропии в замкнутой системе необратимого процесса ∆ S > 0 .
Рисунок 3 . 12 . 6 . Теплообмен при конечной разности температур: a – начальное состояние; b – конечное состояние системы. Изменение энтропии Δ S > 0 .
Все самопроизвольно протекающие процессы в изолированных термодинамических процессах характеризуются ростом энтропии.
Обратимые процессы имеют постоянную энтропию ∆ S ≥ 0 . Соотношение называют законом возрастания энтропии.
При любых процессах, протекающих в термодинамических изолированных системах, энтропия либо не меняется, либо возрастает.
Наличие энтропии говорит о самопроизвольно протекающем процессе, а ее рост – приближение всей системы к термодинамическому равновесию, где S принимает максимальное значение. Возрастание энтропии можно трактовать как формулировку второго закона термодинамики.
В 1878 году Л. Больцман дал вероятностное определение понятию энтропии, так как было предложено рассматривать ее в качестве меры статистического беспорядка замкнутой термодинамической системы. Все самопроизвольно протекающие процессы в таких системах приближают ее к равновесному состоянию, так как сопровождаются ростом энтропии, и направляют в сторону увеличения вероятности состояния.
Если состояние макроскопической системы содержит большое число частиц, то его реализация может предусматривать несколько способов.
Термодинамическая вероятность W системы – это количество способов, которыми реализуется данное состояние макроскопической системы, макросостояний, осуществляющих его.
Из определения имеем, что W ≫ 1 .
При наличии 1 м о л ь газа в емкости существует число N способов размещения молекулы по двум половинам емкости: N = 2 N А , где N А — число Авогадро. Каждое из них – это микросостояние.
Одно из них соответствует случаю с молекулами, собранными в одной половине сосуда. Вероятность такого события приравнивается к нулю. Большое количество состояний соответствует такому, где молекулы распределяются равномерно по всей площади емкости.
Тогда равновесное состояние является наиболее вероятным.
Равновесное состояние считается состоянием наибольшего беспорядка в термодинамической системе с максимальной энтропией.
Исходя из трактовок Больцмана, энтропия S и термодинамическая вероятность W связаны:
S = k · ln W , где k = 1 , 38 · 10 — 23 Д ж / К является постоянная Больцмана. Отсюда следует, что определение энтропии определяется логарифмом числа микросостояний. Именно они способствуют реализации данного макросостояния. Тогда энтропия может быть рассмотрена в качестве меры вероятности состояния термодинамической системы.
Вероятностная трактовка второго закона термодинамики допускает самопроизвольное отклонение системы от состояния термодинамического равновесия. Их называют флуктуациями.
В системах с большим числом частиц отклонения от состояния равновесия имеют достаточно малую вероятность на существование.
Основное уравнение термодинамики обратимых процессов
Основное уравнение термодинамики обратимых процессов
- Как показано в данном разделе, 2-й закон термодинамики обратимого процесса в термически однородной системе можно свести к следующему утверждению: 1.Количество тепла, которое система получает в обратимых процессах, всегда имеет интегральный коэффициент. 2.Среди интегральных коэффициентов формулы dQ есть множитель, который зависит только от температуры системы.
Если обратная величина этого фактора обозначается через T = T (m), то эти утверждения можно представить в виде равенств. йд = т(м)ДС(а,, …а, а. м),(2.28) т.) Где S-S(.Аₜ,…а, а, м)является специфической государственной функции системы(процесс является обратимым, то есть, квази-статических, так там термодинамического равновесия на каждом этапе) Это полностью определяет состояние системы по переменным Приступайте к доказательству этих утверждений.
Это объясняет экспериментально наблюдаемые волновые свойства процесса теплопереноса при низких температурах — распространение тепловой волны с конечной скоростью, отражение тепловой волны. Людмила Фирмаль
Теплотворная способность dQ, которую система приобретает в обратимых процессах、 dQ = dE + dW; (2.29) (2.30) йй. + (2.31) Используйте результаты, показанные в § 14.Во-первых, обратите внимание, что церемония (2.3) была выполнена там для работы. д (2.32)) Это относится не только к изотермам, но и к обратимым процессам. Это связано, во-первых, с тем, что в выражение работы процесса не входит разность температур, а во-вторых, с уравнением (как уже указано на рис. 14 ₄ (2.33).
Она эффективна на каждой стадии равновесного состояния, то есть обратимого процесса. Итак, в случае квазистатического процесса работа может быть записана следующим образом: ДГ—ДГ + ^ д-т. (2.34) Где d + = 2 для + 37-полная производная от S ’(a, m). Как уже упоминалось (§ 14), свободная энергия до сих пор определялась аддитивно, до сих пор к любой температурной функции. С помощью (2.34) выражение количества тепла, выделяемого системой, может быть описано в следующем виде: йд = де + ДГ-Д(Е-V)+ в ДТ .
Я введу обозначения G = E-V、 Я понял. (2.35) д (2.36) (Функцию G иногда называют «энергией связи«.)В этих обозначениях йй ^ ДГ-АДТ. (237) уравнение для dQ (2.31) содержит n + 1 переменных. ля.«. a», m CE и A-указанные функции).Как пользоваться В результате 2-го закона изотермического процесса мы преобразовали dQ в Формулу (2.37)и включили только 3 переменные G, m, o. теперь для дальнейшего вывода мы можем использовать свойство в линейной форме при дифференцировании 3 переменных.
Это проще, чем свойство в виде переменной n + 1). Рассмотрим тепловое уравнение. ДГ-АДТ = 0. (2.38> Есть 2 возможных случая. Первый случай, когда G, O и M являются независимыми переменными. Тогда уравнение dQ-0 интегрируется по прямой с 2 equations. In фактически, установите G = g ® (это приемлемо, потому что переменные независимы) и установите o-g’W по (2.38).Это уравнение прямой линии в трехмерном пространстве, такие как переменные G, a и так далее on. In в этом случае нарушается принцип существования состояния, которое не может быть достигнуто адиабатически. Что?
Чтобы понять это, используйте графическое изображение на плоскости G, m (Рис.2).Каждому состоянию системы соответствует точка (G, m) в определенном направлении: a = g’M = dG / dt. поскольку g-произвольная функция, то на плоскости G, m всегда можно провести линию, проходящую через любые точки A и B в любом направлении. Это также означает, что, соблюдая уравнение dQ-0, путь изоляции может перейти из любого состояния(m, G,0)в любое другое состояние. Поэтому, если 1 из «переменных» — это 2 другие функции, рассмотрим 2-й возможный случай. Г = г (о, м). 2.39.
Тогда выражение в DQ сводится к выражению с 2 независимыми переменными. йд = (2.40> Как мы знаем, для 2 независимых переменных, потому что всегда есть интегрируемый фактор、 •) Совсем не обязательно сводить эту задачу к 3 переменным. Можно только обойти применение Интеграла уравнения типа = 0 с η> 2, который указан в конце теоремы§ 15.As применение этой теоремы было показано в основном исследовании: К.
- Калатеодри-математика. Энн. В 1909. 67, стр. 355, сразу же приводят к выводу d dQ =или множество ц-1 / ((- является «интегральным делителем») dQ = Xdr \и t] — r](o, m),= =((o, m) — функция a и m. In в этом случае уравнение адиабатического процесса интегрируется в соотношении 1, а Интеграл Щ(о, м)= с,(2.41) Содержит только произвольную константу C. Поэтому, если у вас есть состояние, удовлетворяющее этому уравнению для определенного значения C, вы можете перейти только в состояние, удовлетворяющее условию (2.41) для того же значения C адиабатически обратимым образом. Адиабатическая в данном случае недостижима.
До сих пор мы показали, что 1) интегральный коэффициент присутствует в уравнении dQ. 2) G, o и m связаны некоторым отношением (2.42) Если вы вводите значения G и a, вы можете написать: Е — ’ Р-Е (- и’л). 2.43) Где g-неизвестная функция 2 переменных o и m. Передайте в доказательство 2-го утверждения. Среди интегральных коэффициентов докажем, что формула количества тепла dQ является формулой только температуры, и более того, универсальной функцией температуры*). Для этого рассмотрим систему с двухкомпонентной конфигурацией.
Уравнение теплопроводности гиперболического типа сочетает в себе свойства как классического закона Фурье, описывающего чисто диссипативный способ передачи энергии, так и волнового уравнения, описывающего распространение незатухающих волн. Людмила Фирмаль
Его полная энергия е равна сумме энергий этих частей. Е = Е,+ Е«(2.44) В этом случае, конечно, подразумевается, что эпергия добавляется аддитивно (энергия взаимодействия не учитывается).Кроме того, свободная энергия системы будет равна сумме свободной энергии ее частей. То есть эту энергию можно рассматривать как дополнительную amount. In дело в том, что изменение свободной энергии при постоянной температуре равно (отрицательной) работе системы, а работа, проделанная системой, равна сумме работы этой части.
Это свойство можно передать и самой свободной энергии. Сюда входит даже любая температурная функция, если рассматривать эту функцию как сложение, которое до сих пор было совершенно произвольным. Таким образом, Φ, Vi и обозначают свободную энергию системы и ее частей、 Ч — Е、 «ФЗ. (2.44 ’) * ) В теории приведенное здесь рассуждение эквивалентно выводам, впервые приведенным Шиллером (доклад физического университета, Киев, 1897, стр. 1), затем повторенным кальтеотери. в отношении м.、 Или, в нотации、 (2.45> (2.46> .
Следовательно, величина G-E-W также является дополнительной величиной. (2.47> Г = Г+ Г. Опишите состояние всей системы и ее частей (2.42). Г = г(О, М), Г = Г,(О» Т), Г,= ГЗ(о Т). (2.48>(2.48), а также (2.47) и (2.46) к г(о,+ ОА, М) — Г(О, М)+ ги(комплексе O₂, м). Чтобы найти решение этого функционального уравнения, мы дифференцируем относительно 01 и о, а затем получаем следующее (m остается постоянным, опущенным в обозначении): Г ’(°Я +°Я)= Г ’ Т («.). г ’(°я + о)= л(°я)- Таким образом, g₂ (о.)=gₜ(о.).Но такое равенство может быть выражено как производная g и g! не зависит от o и 01 ги(ОИ)= г’2(ОИ) = г ’(ЗС + Ио)= а(м). (2.49> .
Таким образом, функция G является функцией только температуры. (2.49) может быть записано для любых 2 систем, поэтому a (m)является универсальной функцией m. уравнение (2.49) содержит 3 уравнения, и если вы их решите、 gₜ(oₜ)-а(T)0i + ДПМ), ги ОИ) — а(м)О + П / К), Г(О) — А (М) О + П (М) (2.50> используя тот факт, что: g = g,+ g、 а(м) (о!+ Ой)+|> (м)= а(М)01 + ОИ) + ДПМ)+ пн(Р). Это условие П (т) -₽, (т)+ п (т). (2.50 ′> Подставляя o =(G-p) / a в (2.37), получаем [в соответствии с (2.48) и (2.50)]. йд = ДГ-с ДТ = ДГ-^ −5 л.
В этой формуле (включая 2 переменные Vit) Интегральный делитель Т、 = ДС ■И dS-полный differential. In факт, легко проверить, что dS является полностью дифференцируемой функцией=Γ (m)-m только. — =S + Р » р (2.51) (2.52) (2.53) поскольку А является универсальной функцией температуры м, то Т также является универсальной (то есть одинаковой для всех объектов) функцией м. Величина Т называется температурой на абсолютной термодинамической шкале Кельвина.
Поэтому, поскольку он оказался неотъемлемым элементом dQ、 dQ-TdS. (2.54) кроме того, S-это a и m, где a = — d ’¥/ dx-функция a» …. потому что это » i, m, S-функция состояния системы, то есть функция внешнего параметра a. , а температура t: S-S(aₗₜ..а«, т).Эта функция называется энтропией тела. Итак, мы получаем следующие выводы: В случае обратимого процесса основная тепловая величина dQ, полученная системой, равна абсолютной температуре T, умноженной на производную энтропии.
Изоляция скользит в количестве 1 моль, каждый отделен поршнем. Для этой термически неоднородной системы (системы с различными температурами для частей в равновесии) dQ показывает, что интегрального коэффициента нет(Т. А. Афанасьева-пример Эренфеста). Решение. Используя уравнение состояния, pV = RT, имея в виду p,-pr (равновесие) 、 йй-йй,+ йд,= с «ДТ+ ПДВ+ с» ДТ+ ПДВ、- — (С. Я + Р) ДТ+(СП + Р) ДТ-(Рип) (Г,+ Т.) ДП.




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Обратимость термодинамических процессов
Задачей термодинамики является разработка рекомендаций по организации рабочего процесса теплового двигателя по наиболее экономичному и эффективному круговому процессу. Для определения степени совершенства любого термодинамического процесса и вводится понятие термодинамического процесса.
Всякий реальный процесс изменения состояния тела представляет собой отклонение от состояния равновесия.
Равновесный процесс – процесс протекающий настолько медленно, что в системе успевает установиться равновесное состояние. В противоположном случае – неравновесный процесс.
Обратимым называется такой процесс изменения теплового состояния рабочего тела, в котором отсутствуют потери любого рода (как внутренние, так и внешние). Этот процесс протекает как в прямом, так и в обратном направлении без остаточных изменений в рабочем теле и окружающей среде. Внешние потери связаны с теплообменом с окружающей средой, с трением рабочего тела о стенки ограничивающих каналов. Внутренние потери связаны с теплообменом между отдельными участками тела, трением между ними и т.д. Обратимые процессы в чистом виде в природе не всречаются, т.к. реальные процессы всегда протекают с конечными скоростями и конечными Δt.
Следует еще раз подчеркнуть, что термодинамика изучает только равновесные состояния и равновесные процессы (т.е. такие, для которых предполагается, что по всей массе рабочего тела каждый из параметров имеет одинаковое значение, т.е. в различных частях объема данного газа давление, концентрация молекул и температура одинаковы). Только для таких состояний и таких процессов известны характеристические уравнения и уравнения процессов изменения состояния.
Понятие равновесного процесса необходимо потому, что отсутствие потерь любого рода для обратимых процессов предопределяет наличие требований, предъявляемых к равновесным процессам.

Отсутствие потерь является основой понятия обратимости, а совпадение кривых сжатия и расширения является следствием этого.
Определим условия, которые должны быть созданы, чтобы термодинамический процесс был обратимым.
Отсутствие потерь на трение обеспечится, видимо, бесконечно малым изменением давления по объему рабочего тела.
Тепловые потери связаны с неравномерностью распределения температуры, которое может быть устранено при условии наличия бесконечно малой разности температур между ГИ и РТ. Таким образом, практически осуществить обратимый процесс нельзя. Приближается к обратимым процесс под поршнем, нагружаемым пылевидным грузом.
Все действительные процессы далеки от идеальных и потому необратимы (они протекают с достаточно высокими скоростями и часто сопровождаются еще и агрегатным изменением состояния рабочего тела). Это приводит к тому, что часть тепловой энергии расходуется на преодоление потерь. Реальные процессы практически невозможно изобразить графически или описать математически из-за сложнейших физических превращений, происходящих в рабочих телах вследствие трения.
Поэтому в термодинамике вынуждены прибегать к такому понятию, как квазистатические процессы и состояния (quazi – по латыни якобы, как бы). После введения такого понятия становится возможным оценивать различные термодинамические процессы.
Очевидно, что наиболее экономичной будет тепловая машина, работающая по циклу, состоящему из наиболее обратимых процессов. Из всего множества политропных процессов хоть чем-то напоминают обратимые адиабатный и изотермный процессы.
Следует еще раз особо подчеркнуть два обстоятельства: 1) обратимые процессы сжатия и расширения изображаются одной и той же линией;
2) при взаимодействии рабочего тела с источником теплоты процессы протекают при бесконечно малой разности температур между РТ и ИТ.
Протекание процессов р = const и v = const отмечается той особенностью, что в них требуется теплообмен, т.е. температура РТ меняется. Поэтому необходимо совершать подвод и отвод теплоты при помощи бесконечно большого числа теплообменников, температуры которых отличаются на бесконечно малую величину.
Цикл Карно
Круговые процессы (циклы) могут состоять из самых разных процессов, для осуществления которых необходимо иметь в общем случае бесконечное количество горячих и холодных источников (источников температуры ИТ).
Минимальным количеством ИТ могут быть два: верхний с Т = Т1 и нижний, имеющий Т = Т2.
Однако две изотермы не могут образовать цикл. Учитывая, что других источников нет, обратимый переход между Т1 и Т2 возможен только по адиабатам.
На рис. 20 изображен цикл Карно, где 4–1 и 3–2 – изотермы, 4–3 и 1–2 – адиабаты.


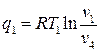

Подставив q1 и q2 в выражение для 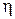

Из соотношения параметров адиабатного процесса 




Идеальный цикл Карно не может иметь 

Таким образом, ни один из реальных циклов не может достичь 
Очень важным выводом является то, что 

http://lfirmal.com/osnovnoe-uravnenie-termodinamiki-obratimyh-processov/
http://allrefrs.ru/3-10444.html